要旨
理化学研究所(理研)放射光科学総合研究センター 城生体金属科学研究室の當舎武彦専任研究員(研究当時)、杉本宏専任研究員(研究当時)、久保稔専任研究員(研究当時)、城宜嗣主任研究員(研究当時、現兵庫県立大学大学院生命理学研究科)、高輝度光科学研究センターXFEL利用研究推進室の登野健介チームリーダーらの共同研究グループ※は、X線自由電子レーザー(XFEL)[1]施設SACLA[2]において、生体内で起こる化学反応を可視化する技術を開発しました。
酵素は、生体内でさまざまな化学反応を行っています。そのメカニズムを知るためには、酵素の構造とその変化を原子レベルで見ることが不可欠です。しかしこれまでは、反応前や反応後など酵素が止まっているときの構造は見られても、酵素が反応している最中の構造を見ることは困難でした。
今回、共同研究グループは、光を照射すると基質を放出するケージド化合物とSACLAの高品質なX線を組み合わせることで、酵素が反応している最中の構造を原子レベルで見る技術を開発しました。そしてその技術を用いて、一酸化窒素還元酵素[3]が、反応相手の分子を取り込む瞬間の構造を捉えることに成功しました。
本技術を用いることで今後、さまざまな酵素の働く仕組みが解明され生命現象の理解が進むだけでなく、新薬の設計や開発などへの応用も期待できます。
本研究は、国際科学雑誌『Nature Communications』(11月17日付:日本時間11月17日)に掲載されます。
本研究は、文部科学省X線自由電子レーザー重点戦略研究課題「無損傷・動的結晶構造解析による生体エネルギー変換過程の可視化(研究代表者:吾郷日出夫)」、「創薬ターゲット蛋白質の迅速構造解析法の開発(研究代表者:岩田想)」、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」、戦略的創造研究推進事業(CREST)「多様な天然炭素資源を活用する革新的触媒の創製」、日本学術振興会 科学研究費補助金 基盤研究S「一酸化窒素の生体内動態の分子科学(研究代表者:城宜嗣)」などの支援を受けて実施されました。
※共同研究グループ
理化学研究所 放射光科学総合研究センター
城生体金属科学研究室
専任研究員(研究当時) 當舎 武彦 (とうしゃ たけひこ)
(現 放射光科学総合研究センター ビームライン基盤研究部 専任研究員)
特別研究員(研究当時) 野村 高志 (のむら たかし)
(現 放射光科学総合研究センター ビームライン研究開発グループ 特別研究員)
専任研究員(研究当時) 杉本 宏 (すぎもと ひろし)
(現 放射光科学総合研究センター ビームライン基盤研究部 専任研究員)
専任研究員(研究当時) 久保 稔 (くぼ みのる)
(現 放射光科学総合研究センター ビームライン研究開発グループ 専任研究員)
主任研究員(研究当時) 城 宜嗣 (しろ よしつぐ)
(現 兵庫県立大学大学院生命理学研究科 教授)
利用技術開拓研究部門 SACLA利用技術開拓グループ
研究員(研究当時) 南後 恵理子(なんご えりこ)
(現 放射光科学総合研究センター ビームライン研究開発グループ 研究員)
特別研究員(研究当時) 菅原 道泰 (すがはら みちひろ)
(現 京都大学大学院医学研究科 特定研究員)
グループディレクター 岩田 想 (いわた そう)
利用システム開発研究部門 ビームライン基盤研究部
生命系放射光利用システム開発ユニット
基礎科学特別研究員 山下 恵太郎(やました けいたろう)
専任技師 平田 邦生 (ひらた くにお)
専任研究員 吾郷 日出夫(あごう ひでお)
部長 山本 雅貴 (やまもと まさき)
XFEL研究開発部門 ビームライン研究開発グループ
グループディレクター 矢橋 牧名 (やばし まきな)
高輝度光科学研究センター XFEL利用研究推進室 先端光源利用研究グループ
実験技術開発チーム
チームリーダー 登野 健介 (との けんすけ)
背景
私たちの体の中には多種多様なタンパク質が存在し、生命活動を支えています。タンパク質とは、遺伝子により精密に設計された機能性分子です。その中でも代謝などの物質変換をはじめとした化学反応を行うタンパク質を、酵素と呼びます。酵素の特徴は、作用する分子(基質)を選択し、人工的には困難な化学反応を温和な条件の下で行えることです。酵素が働く仕組みを理解し、それを模倣した分子を人工的に設計することは化学における夢の一つといえます。
酵素が働く仕組みを理解するには、酵素の構造を原子レベルで知ることが不可欠であり、これまでX線結晶構造解析[4]という実験手法を用いて、多くの酵素の構造が明らかにされてきました。しかし、従来のX線結晶構造解析では、反応前や反応後など酵素が止まっているときの構造は見られても、反応している最中の酵素の構造やその変化を見ることは技術的に困難でした。
最近、SACLAのX線を用いて、タンパク質が動く姿を瞬間的に捉える画期的なX線結晶構造解析手法が開発され、光に応答するタンパク質の働く様子が動画のように観察されました注1)。共同研究グループはこのSACLAを用いた手法に注目し、それを基盤に酵素が化学反応を行う姿を見るための技術開発に取り組みました。
注1)2016年12月23日プレスリリース「タンパク質中の原子の動き、自由電子レーザーにより動画撮影に成功」
研究手法と成果
今回、共同研究グループは、光を照射すると基質を放出する化合物(ケージド化合物)を利用することで、酵素が構造を変化させながら化学反応を行う姿を、原子レベルで可視化する技術を開発しました(図1)。この技術では、ケージド化合物を酵素の結晶に浸み込ませておいて、光を照射します。するとケージド化合物から基質が放出されて、酵素と基質の反応が始まります。任意の時間経過後にSACLAビームライン(BL3)のX線を照射してX線結晶構造解析を行えば、反応状態の酵素の姿が捉えられます。
共同研究グループはこの技術を、カビの中で働いている一酸化窒素還元酵素に応用しました。この酵素は鉄原子を含んでおり、鉄原子上で一酸化窒素ガス(NO)を亜酸化窒素ガス(N2O)に変換します。酵素とNOの反応開始から0.02秒後の状態を解析し、酵素がNOを取り込む様子を可視化しました(図2)。NOは反応性に富む不安定な分子ですが、酵素はNOを少し傾けて(鉄-N-O角158o)安定な捕捉構造をとることが明らかになりました。
今後の期待
ケージド化合物には、さまざまな生体内反応に関連するケージド電子やケージドATP[5]などたくさんの種類があります。また、ケージド化合物の有用性が注目されてきており、多種多様なケージド化合物が日々開発されています。それらと本研究成果を組み合わせることで、多くの酵素の働く姿が原子レベルで可視化できます。開発した技術を用いて自然が設計した酵素の仕組みを理解することで、人工酵素や新薬の設計の大きな進展が期待できます。
原論文情報
- Takehiko Tosha, Takashi Nomura, Takuma Nishida, Naoya Saeki, Kouta Okubayashi, Raika Yamagiwa, Michihiro Sugahara, Takanori Nakane, Keitaro Yamashita, Kunio Hirata, Go Ueno, Tetsunari Kimura, Tamao Hisano, Kazumasa Muramoto, Hitomi Sawai, Hanae Takeda, Eiichi Mizohata, Ayumi Yamashita, Yusuke Kanematsu, Yu Takano, Eriko Nango, Rie Tanaka, Osamu Nureki, Osami Shoji, Yuka Ikemoto, Hironori Murakami, Shigeki Owada, Kensuke Tono, Makina Yabashi, Masaki Yamamoto, Hideo Ago, So Iwata, Hiroshi Sugimoto, Yoshitsugu Shiro, Minoru Kubo, "Capturing an Initial Intermediate during the P450nor Enzymatic Reaction using Time-Resolved XFEL Crystallography and Caged-Substrate", Nature Communications, doi: 10.1038/s41467-017-01702-1
発表者
理化学研究所
放射光科学総合研究センター 城生体金属科学研究室
専任研究員(研究当時) 當舎 武彦(とうしゃ たけひこ)
(現 放射光科学総合研究センター ビームライン基盤研究部 専任研究員)
専任研究員(研究当時) 杉本 宏(すぎもと ひろし)
(現 放射光科学総合研究センター ビームライン基盤研究部 専任研究員)
専任研究員(研究当時) 久保 稔(くぼ みのる)
(現 放射光科学総合研究センター ビームライン研究開発グループ 専任研究員)
主任研究員(研究当時) 城 宜嗣(しろ よしつぐ)
(現 兵庫県立大学大学院生命理学研究科 教授)
高輝度光科学研究センター XFEL利用研究推進室 先端光源利用研究グループ
実験技術開発チーム
チームリーダー 登野 健介(との けんすけ)
お問い合わせ先
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
兵庫県立大学播磨理学キャンパス
経営部総務課 神頭 由紀(かんとう ゆき)
Tel: 0791-58-0101 / Fax: 0791-58-0131
u_hyogo_harima [at] ofc.u-hyogo.ac.jp(※[at]は@に置き換えてください。)
高輝度光科学研究センター
利用推進部 普及情報課
Tel: 0791-58-2785 / Fax: 0791-58-2786
kouhou [at] spring8.or.jp(※[at]は@に置き換えてください。)
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.X線自由電子レーザー(XFEL)
X線自由電子レーザーとは、X線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限はない。また、数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルスを出力する。XFELはX-ray Free Electron Laserの略。 - 2.SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAser の頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が始まっている。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにも関わらず、0.1ナノメートル(100億分の1m)以下という世界最短波長のレーザーの生成能力を有する。 - 3.一酸化窒素還元酵素
一酸化窒素ガス(NO)を亜酸化窒素ガス(N2O)に変換する酵素。窒素は多くの生物の働きで、さまざまな化学形態を取りながら地球上を循環している(窒素循環)。NO→N2O変換はその中の一過程である。N2Oは、フロンに次ぐオゾン層破壊ガスであり、またCO2の300倍の温室効果があるため、一酸化窒素還元酵素の反応機構の解明が待たれている。 - 4.X線結晶構造解析
タンパク質が規則正しく並んだ結晶にX線を照射すると回折光が得られる。その回折光を解析して、タンパク質の構造を解明する実験手法。タンパク質を構成する個々の原子の位置を決定できる。 - 5.ケージドATP
ATP(アデノシン三リン酸)は、全ての生物が生きるためのエネルギー源として生産・利用している化合物であり、生体のエネルギー通貨と呼ばれている。タンパク質に結合することで作用する。ケージドATPは、光照射によってATPを放出するケージド化合物である。本研究成果の技術にケージドATPを利用することで、今後多くのタンパク質の作動原理が解き明かされるであろう。
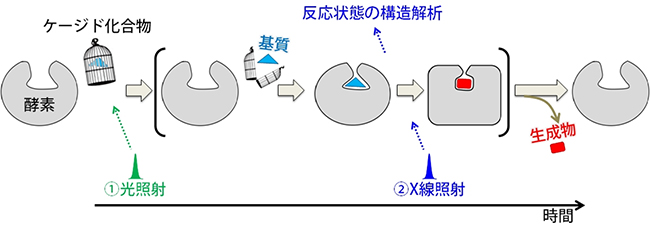
図1 酵素の化学反応を見るための実験スキーム
①ケージド化合物を浸み込ませた酵素の結晶に、光(パルスレーザー)を照射する。すると、ケージド化合物から基質が放出されて、酵素と基質の反応が始まる。
②パルスレーザーはSACLAのX線と同期しているため、任意の時間経過後にSACLAのX線を照射して反応中のX線結晶構造解析を行い、その姿を捉えることができる。
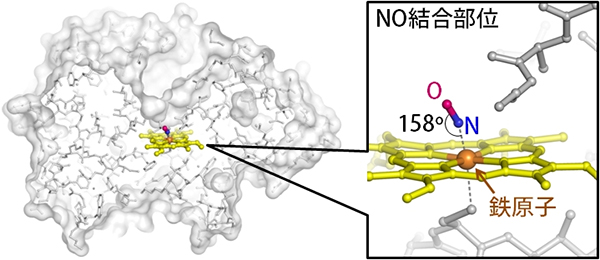
図2 一酸化窒素還元酵素が一酸化窒素ガスを取り込んだ瞬間の構造
一酸化窒素還元酵素は、自身が持つ鉄原子上で一酸化窒素ガス(NO)を亜酸化窒素ガス(N2O)に変換する。反応開始から0.02秒後の状態を解析し、酵素がNOを取り込む様子を可視化した。酵素はNOを少し傾けて(鉄-N-O角158o)安定な捕捉構造をとることが分かった。
