理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの西道隆臣チームリーダー、笹栗弘貴研究員、永田健一研究員らの共同研究チーム※は、近年開発されたゲノム編集技術を改変した「塩基編集技術」を用いると、従来法に比べてマウスに遺伝子変異を高効率に導入でき、しかも同時に複数の変異マウス系統を作製できることを発見しました。
本研究成果は、疾患モデル動物作製に新しい選択肢を提供するだけでなく、疾患の発症メカニズムの解明や、未知の病的変異のスクリーニングなど、生命科学のさまざまな研究分野への貢献が期待できます。
今回、共同研究チームは塩基編集技術を利用して、家族性アルツハイマー病[1]に関連する遺伝子変異をマウスに導入することに成功しました。塩基編集技術は、従来のノックイン技法[2]によるモデルマウスの作製に比べて大幅に変異の導入効率が高く、また複数の異なる変異を持つマウス系統を同時に作製できることが分かりました。さらに、作製した変異マウスはアルツハイマー病患者脳内の病的な状態をよく再現しており、疾患モデル動物作製における塩基編集技術の有用性を示しました。
本研究は、英国のオンライン科学雑誌『Nature Communications』(7月24日:日本時間7月24日)に掲載されました。
※研究チーム
理化学研究所 神経老化制御研究チーム
研究員 笹栗 弘貴(ささぐり ひろき)
研究員(研究当時) 永田 健一(ながた けんいち)
テクニカルスタッフI 関元 みさき(せきもと みさき)
テクニカルスタッフI 藤岡 亮(ふじおか りょう)
テクニカルスタッフI 松葉 由紀夫(まつば ゆきお)
基礎科学特別研究員 橋本 翔子(はしもと しょうこ)
研修生 佐藤 香織(さとう かおり)
チームリーダー 西道 隆臣(さいどう たかおみ)
東京医科歯科大学 医学部 脳神経病態学
教授 横田 隆徳(よこた たかのり)
ハーバード大学 分子細胞生物学部
学生 ディーピカ・クルップ(Deepika Kurup)
※研究支援
本研究は、AMED「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:岡野栄之、宮脇敦史)」、JSPS科学研究費助成事業 基盤研究C「ゲノム編集技術を利用した変異プレセニリンによるアルツハイマー病機序の系統的解析(研究代表者:笹栗弘貴)」による支援を受けて行われました。
背景
近年、ゲノムDNAの配列解析技術は著しく発展し、疾患に関連する遺伝子変異の報告数が大幅に増加しています。例えば、家族性アルツハイマー病の原因として知られるプレセニリン遺伝子[3]の点変異[4]には、200以上もの報告例があります。しかし、遺伝子の特定領域を置換する従来のノックイン技法でモデル動物を作製する場合、一つの点変異を持つモデルマウスですら数年かかることがあります(図1左)。そのため、それぞれの点変異が生体にどのような影響を及ぼし、疾患を引き起こすのかを明らかにするのは困難でした。
1990年代後半以降、ゲノムDNAを構成する塩基の配列を特異的に切断する酵素を用いて、ゲノムDNA上の目的の配列に変異を生じさせる「ゲノム編集技術」が次々と開発されています。しかし、2012年に報告されたゲノム編集技術の代表格である「CRISPR/Cas9[5]」は、塩基配列の切断を伴うため、しばしば意図しない点変異が生じたり、切断の痕跡がゲノムDNAに残ったりするという問題がありました。この問題を解消するため、CRISPR/Cas9をもとに「塩基編集技術」という新しいゲノム編集技術が2016年に開発されました注1, 2)(図1右)。この技術は従来のゲノム編集技術と異なり、ゲノムDNAを切断する頻度を著しく減少させた上で、目的の塩基のみを異なる塩基に置換することにより、点変異を導入できます。
今回、共同研究チームは、2016年にハーバード大学のデビッド・リュー博士らが開発した「Base Editor(BE)注1)」と、同年神戸大学の近藤昭彦博士らが開発した「Target-AID注2)」という2種類の塩基編集ツールを用いて、プレセニリン遺伝子に点変異を持つマウス個体(変異プレセニリンマウス)の作製を試みました。
- 注1) Komor AC, Kim YB, Packer MS, Zuris JA, Liu DR. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424 (2016).
- 注2) Nishida K, et al. Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems. Science (New York, NY) 353, (2016).
研究手法と成果
まず、プレセニリン遺伝子の1,306番目の塩基であるシトシンの、チミンへの置換を試みました。マウス受精卵にBEかTarget-AIDのいずれかとsgRNA (single guide RNA)を注入した後、個体の誕生を待ってゲノムDNAの配列を解析しました(図2左)。シトシンからチミンへの点変異が生じていれば、プレセニリンタンパク質の436番目のアミノ酸がプロリン(P)からセリン(S)に置換されます(P436S)。
解析の結果、BEを使用した群では、シトシンからチミンへの点変異を含め、点変異を持つマウス個体は62.8%でした(図2右)。一方、Target-AIDを使用した群では、点変異の導入効率はBEより低く、シトシンからチミンへの点変異を含め、点変異を持つマウス個体は11.8%でした(図2右)。しかし、BEを使用した群ではTarget-AIDを使用した群と比較して、チミン以外の塩基へ置換されている点変異や、ゲノムDNAの切断の痕跡が高頻度にみられました。つまり、BEは塩基の置換効率に優れるのに対して、Target-AIDは正確性に優れることが分かりました。
次に、さまざまな塩基置換のパターンを示すBEの特徴を利用し、BEを用いて複数の変異マウス系統を同時に作製できるかを検証しました。プレセニリンタンパク質の117番目のアミノ酸であるプロリン(P)がロイシン(L)やセリン(S)になると、家族性アルツハイマー病の発症原因となります。このようなP117L、P117Sの置換には、プレセニリン遺伝子の349番目と350番目の塩基にそれぞれ点変異を導入する必要があるものの、両者は隣接するため同時に標的とすることが可能です。そこで、300個のマウス受精卵にBEおよびsgRNAを注入し、個体の誕生を待ってゲノムDNAの配列を解析した結果、P117L、P117Sを含むさまざまな点変異を持つマウス個体は59.7%で、しかも45.5%は家族性アルツハイマー病の原因として報告されている点変異でした(図3右)。
続いて、BEやTarget-AIDで作製した変異プレセニリンマウスが、アルツハイマー病の特徴を再現できているかを検証するために、アルツハイマー病発症の引き金と考えられている脳内のβアミロイド(Aβ)ペプチド[6]の産生パターンを調べました。アルツハイマー病患者では、健常者で主に認められるAβ40[6]と比較して、凝集しやすいAβ42[6]という長いペプチドが増えていることが知られています。今回作製したP436S変異とP117L変異プレセニリンマウスを調べた結果、どちらもこの特徴を再現してAβ42が増えており、BEやTarget-AIDを用いたモデルマウスの作製方法が有効であることが示されました(図3)。
さらに、今回の方法で作製したマウス個体のうち、これまで家族性アルツハイマー病の原因として報告されていなかった変異(P436L)を持つマウス個体でも、同様の異常なAβ産生パターンが認められることが分かりました。このことから、本研究で用いた手法は新しい病的変異を生体内でスクリーニングする方法としても有効であることが示されました。
今後の期待
今回の研究成果により、塩基編集技術によるモデル動物への遺伝子変異導入が既存の手法に比べ著しく効率が高く、しかも同時に複数の変異系統が作製できることが分かりました。BEをはじめとする塩基編集技術は現在最も注目されている科学技術の一つであり、改良型も次々と開発・報告されています。塩基編集技術を使うことで、病的な点変異がどのようにして疾患を発症させるのか、個体レベルでの理解が今後急速に進んで行くと期待できます。
さらに、塩基編集技術はゼブラフィッシュなど、従来のゲノム編集技術では遺伝子への変異導入が難しかった動物種でも有効であることが示されています。現在、共同研究チームは、さまざまな動物種への適応可能な塩基編集技術の特徴を利用し、新しい非ヒト霊長類のアルツハイマー病モデル作製に取り組んでいます。
本研究で作製した複数のモデルマウス系統は、アルツハイマー病の原因、病気のメカニズムの解明、治療方法の開発につながると期待できます。また、既存のAppノックインマウス注3)など他の遺伝子改変動物と交配することによって、さらに病理学的表現型の強いマウスモデルを作製できる可能性があります。
- 注3) 2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
原論文情報
- Hiroki Sasaguri, Kenichi Nagata, Misaki Sekiguchi, Ryo Fujioka, Yukio Matsuba, Shoko Hashimoto, Kaori Sato, Deepika Kurup, Takanori Yokota, and Takaomi C. Saido, "Introduction of pathogenic mutations into the mouse Psen1 gene by Base Editor and Target-AID", Nature Communications, 10.1038/s41467-018-05262-w
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
研究員 笹栗 弘貴(ささぐり ひろき)
研究員(研究当時) 永田 健一(ながた けんいち)
チームリーダー 西道 隆臣(さいどう たかおみ)
 (左から)笹栗研究員、西道チームリーダー、永田研究員(研究当時)
(左から)笹栗研究員、西道チームリーダー、永田研究員(研究当時)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.家族性アルツハイマー病
アルツハイマー病はドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障をきたすようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうちで最も多いタイプの疾患となっている。家族歴を伴うものを家族性アルツハイマー病であり、ないものを孤発性アルツハイマー病と呼ぶ。 - 2.ノックイン技法
遺伝子組換え法の一つで、標的遺伝子の目的とするDNA領域を置換する方法。その際に、変異を導入することが可能である。トランスジェニックのように過剰発現を行わず、ノックアウト技法のように遺伝子を欠損させることもない。 - 3.プレセニリン遺伝子
プレセニリンという蛋白質をコードする遺伝子。家族性アルツハイマー病の患者の中では、この遺伝子に変異をもつ患者が最も多い。プレセニリンタンパク質は、アミロイド前駆体タンパク質からAβを切り出す作用を有し、アルツハイマー病の発症過程で重要な因子の一つである。 - 4.点変異
一つのDNAの塩基が別の塩基に置き換わった変異のこと。ゲノムDNA配列を構成する四つの塩基、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)のうち三つの組み合わせで一つのアミノ酸をコードするが、点変異によりアミノ酸自体も別のアミノ酸に変わってしまうことがあり、ミスセンス変異と呼ばれる。遺伝性の疾患の多くは、この点変異によるミスセンス変異が原因とされている。 - 5.CRISPR/Cas9
化膿性レンサ球菌( Streptococcus pyogenes)などの細菌が持つ、ウイルスなどの病原体に対する免疫機構。ウイルスDNA配列と相補的な配列を持つRNAにより、Cas9タンパク質が標的部位に運ばれ、標的DNAを切断することでウイルスを排除する。この機構を利用して、標的ゲノムDNAと相補的なsingle-guide RNA(sgRNA)とCas9タンパク質を細胞内に発現させると、標的ゲノムDNAが切断され、その後のDNA修復経路を利用してゲノムDNAにさまざまな編集を加えることが可能となった。CRISPR/Cas9はClustered Regularly Interspaced Short Palindromic Repeats / CRISPR Associated protein 9の略。 - 6.βアミロイド(Aβ)ペプチド、Aβ40、Aβ42
アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。アルツハイマー病で見られるアミロイド斑の構成成分として発見されたことから、Aβの過剰な蓄積がアルツハイマー病発症の引き金と考えられている。Aβ40と Aβ42は、それぞれ40個のアミノ酸と42個のアミノ酸からなる。
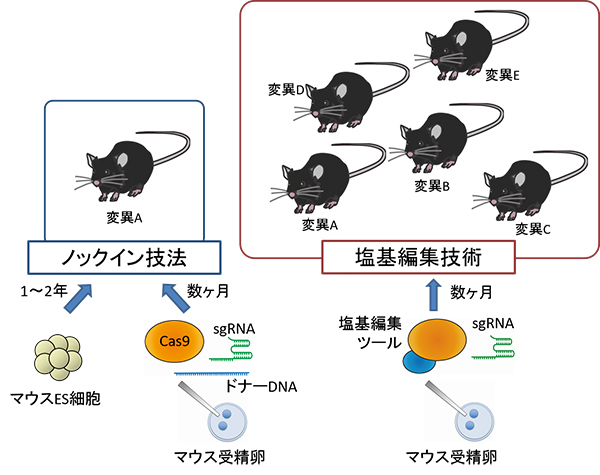
図1 ノックイン技法と塩基編集技術によるモデルマウス作製方法
ノックイン技法ではマウス個体の作製に数年かかることがあるが、塩基編集技術では数か月程度で、しかも複数系統作製できる。
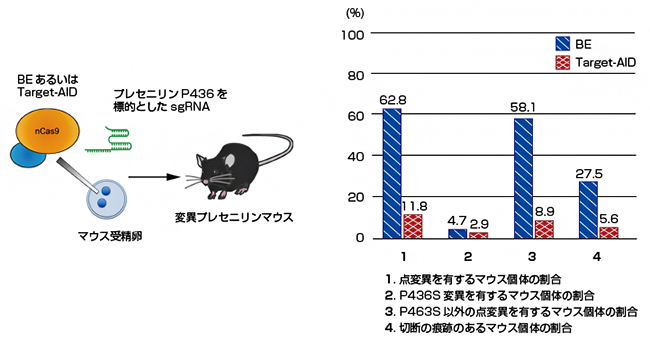
図2 BEとTarget-AIDによる変異プレセニリンマウス(P436S)の作製
- 左) BEあるいはTarget-AIDを、sgRNA(single-guide RNA)と一緒にマウス受精卵にマイクロインジェクションにより注入しマウス個体を作製した。sgRNAは標的のゲノムDNAの配列に相補的な配列を持ったガイド役を担うRNAで、本実験ではプレセニリン遺伝子を標的にしている。
- 右) 作製したマウス個体のゲノムDNAの配列を解析し、点変異の頻度を調べた。その結果、BEでは62.8%、Target-AIDでは11.8%のマウス個体が点変異を持っていた(1)。しかし、BEでは目的のP436S以外の変異を持つマウス個体の頻度が高く(3)、また切断の痕跡を持つマウス個体の頻度もTarget-AIDよりも高い(4)ことが分かった。
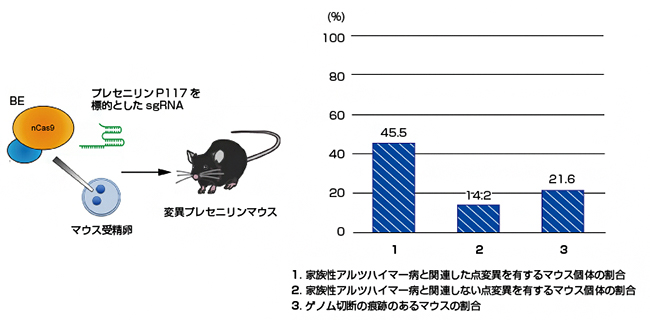
図3 BEによる変異プレセニリンマウス(P117)作製
- 左) BEを、プレセニリンタンパク質の117番目のアミノ酸であるプロリン(P117)を標的としたsgRNAと一緒に、マウス受精卵にマイクロインジェクションにより注入しマウス個体を作製した。
- 右) 作製したマウス個体のゲノムDNAの配列を解析し、点変異の頻度を調べた。その結果、合計で59.7%(45.5+14.2)のマウスが点変異を持っており(1と2)、そのうち45.5%が家族性アルツハイマー病と関連した点変異(T116I、T116N、P117L、P117S、P117A)を持っていた。
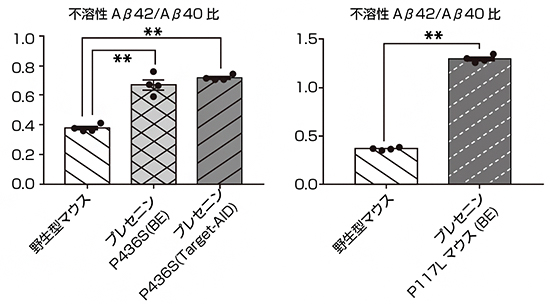
図3 変異プレセニリンマウス(P436SとP117)におけるAβ産生パターン
- 左) BEあるいはTarget-AIDで作製した変異プレセニリンマウス(P436S)の脳組織を用いて、Aβ40、Aβ42を測定した。その結果、アルツハイマー病患者と同様、Aβ42/Aβ40比が増加していた。
- 右) BEで作製した変異プレセニリンマウス(P117L)の脳組織を用いて、Aβ40、Aβ42を測定した。その結果、こちらでもAβ42/Aβ40比が増加していた。
