要旨
理化学研究所(理研)統合生命医科学研究センター ゲノムシーケンス解析研究チームの中川英刀チームリーダー、藤田征志研究員、兵庫医科大学炎症性腸疾患学外科部門の池内浩基教授らの共同研究グループ※は、炎症性腸疾患(IBD)[1]から発生した大腸がん(Colitic cancer[2])の網羅的ゲノム解析を行い、その発がん機構を解明しました。
日本での潰瘍性大腸炎[1]やクローン病[1]を含むIBDの患者数は急激な増加傾向にあり、20万人以上が長期間の治療を受けています注1)。IBDの患者は腸粘膜の長期間にわたる慢性炎症のため、IBDを原因とするがん「Colitic cancer」の発生リスクが非常に高くなり、IBD経過後に厳重な検診が行われています。また、がんや、その前がん病変(dysplasia[3])が見つかった場合、大腸全摘などの手術が行われます。通常の大腸がんの発生メカニズムはこれまで詳しく解明されていますが、Colitic cancerにはそのメカニズムが当てはまらないと考えられており、ゲノム解析による詳細な研究が求められていました。
今回、兵庫医科大学病院のIBD患者に発生した90例のColitic cancerについて網羅的ゲノム解析を行い、その発がん機構を解明しました。通常の大腸発がんにおいてはAPC[4]遺伝子の変異が60~90%と最も多く起こっています。ところが、Colitic cancerではAPCの変異が15%と少なく、TP53やRNF43[4]の遺伝子変異がそれぞれ66%、11%ずつ検出され、通常の大腸がんとは異なる変異でがんが発生していることが分かりました。特に、RNF43の遺伝子変異はIBDの病悩期間(病気で悩む期間)や重症度と相関し、APC遺伝子の変異はIBDの病悩期間や重症度と逆相関していました。RNF43とAPCの変異の有無によってIBDが原因でがんが発生したのか推定できる可能性があります。
今後、ゲノム変異情報を用いて、dysplasiaの検出による早期診断や、Colitic cancerの層別化など、それに基づく治療方針の決定が行われていくものと期待できます。
本研究は、米国の科学雑誌『Oncotarget』掲載に先立ち、オンライン版(12月12日付け:日本時間12月12日)に掲載されました。
注1)難病医学研究財団 難病情報センターのホームページより
平成25年度末の医療受給者証および登録者証交付件数の潰瘍性大腸炎やクローン病の合計数
※共同研究グループ
理化学研究所 統合生命医科学研究センター
ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
研究員 藤田 征志(ふじた まさし)
兵庫医科大学
炎症性腸疾患外科学 外科部門
教授 池内 浩基(いけうち ひろき)
外科学 下部消化管外科
客員教授 松原 長秀(まつばら ながひで)
教授 冨田 尚裕(とみた なおひろ)
病理学 病理診断部門
講師 松田 育雄(まつだ いくお)
教授 廣田 誠一(ひろた せいいち)
背景
大腸および小腸の粘膜に慢性の炎症または潰瘍を引き起こす疾患の総称を炎症性腸疾患(IBD)といいます。潰瘍性大腸炎とクローン病はIBDの代表であり、難病指定を受けています。日本でのIBDの患者数は急激な増加傾向にあり、20万人以上の患者が長期間の治療を受けています。これらの疾患は若年発症であり、免疫調整薬などの治療が長期間行われ、最近は抗体製剤など新しい薬剤の登場により治療法は目覚ましい発展を遂げています。
しかし、IBDの患者の長期経過例をみると、腸粘膜の長期間にわたる慢性炎症のため、がんの発生リスクが非常に高い状況です。これらのIBDを原因とするがんは「Colitic cancer」と呼ばれています。潰瘍性大腸炎の場合、発症後10年で1.6%、20年で8.0%、30年になると18.0%の割合で、大腸がんが発生するという報告があります注2)。しかも、このColitic cancerは、生物学的悪性度が高く予後が不良です。したがって、現在、IBDの長期経過例では内視鏡による厳重ながんの検診が行われています。がんや、前がん病変(dysplasia)が見つかった場合、早期病変であっても浸潤や転移が多いこと、大腸粘膜の他の炎症部位にもがんが発生していること、または、将来発生してくるリスクが高いことから、大腸全摘などの広範囲な手術が行われることが多くなります。
通常の大腸がんの発生メカニズムはこれまで詳しく解明されており、adenoma-carcinoma sequenceと呼ばれる大腸ポリープを介した発がん過程をたどります(図1)。最初にAPC遺伝子に変異が入り、その後にKRAS遺伝子、TP53遺伝子などの変異が起こり、がんが発生するという、多段階発がんが提唱されています。しかし、Colitic cancerについては、その形状や病理学的検討から、この通常の大腸がんの多段階発がん説が当てはまらないと考えられており、ゲノム解析により詳細な研究が求められていました。
注2)Eaden JA, Abrams KR, Mayberry JF. “The risk of colorectal cancer in ulcerative colitis: a meta-analysis.” Gut. 2001;48:526–35.
研究手法と成果
共同研究グループは、兵庫医科大学病院で切除手術を行ったIBD患者90例(潰瘍性大腸炎58例、クローン病32例)に発生したColitic cancerの切除標本からDNAとRNAを抽出し、次世代シークエンサー(NGS)[5]を用いて、全エクソーム[5]、または、43個のがん関連の遺伝子の全エクソンについて変異探索を行いました。また、一部についてRNA解析も行いました。
通常の大腸発がんにおいては、APC遺伝子の変異が60~90%と最も多いことが分かっています。今回の網羅的なゲノム解析の結果、Colitic cancerでは、APC遺伝子変異は15%と少ない一方で、代わりにTP53やRNF43の遺伝子変異がそれぞれ66%、11%ずつ検出されました(図2)。これは、Colitic cancerが通常の大腸がんとは異なる機構で発生していることを示しています。特にRNF43遺伝子は、APC遺伝子と同じくWntシグナル経路[6]で機能しているが、通常の大腸がんで変異は少ないため、IBDからの発がんにおいてより重要な機能を持つものと考えられます。
また、RNF43に関わる遺伝子変異は、IBDの病悩期間(病気で悩む期間)や重症度と相関し、一方でAPC遺伝子の変異は病悩期間や重症度と逆相関していました(図3)。Colitic cancerは、粘液がん(粘液を産生する)などの非典型的な病理像を呈することが多いですが、RNF43遺伝子変異のあるColitic cancerは、粘液がんや低分化型の病理像を示す傾向にありましたが、APC遺伝子変異のあるColitic cancerは、典型的な大腸がんの病理像である高分化型が多い傾向にありました。
クローン病に合併する肛門周囲のがんは日本人・アジア人に多く、粘液がんの病理像を呈することが多いですが、今回の網羅的ゲノム解析では既知のがん関連遺伝子の変異が見つかりませんでした。ゲノムの観点においても、クローン病に合併する肛門周囲のがんは特殊な腫瘍の分類となりました(図2オレンジ枠)。
本研究では、網羅的ゲノム情報を用いてゲノムの視点でのColitic cancerの発がん機構を解明しました。Colitic cancerのゲノム変異パターンは、通常の大腸がんと大きく異なるケースと、類似するケースがあり、その変異遺伝子によって分類できる可能性があります。
今後の期待
IBDと合併して発生した大腸がんであっても、通常の大腸がんと同様の経路で発がんするケースも存在すると考えられています。今回の結果は、APC、RNF43、TP53の遺伝子変異を調べることによって、発生したがんの原因がIBDかどうか、推定できる可能性を示しています。また、Colitic cancerと通常の大腸がんとでは、背景で活性化しているシグナル経路/変異が異なるため、その分子情報、ゲノム情報によってIBDに合併した大腸がんの治療方針が変わってくることも考えられます。
NGSといったDNAシーケンス技術の革新により“ゲノムの病気”ともいえる、がんのさまざまなフェーズでの診断や分類を行う「がんゲノム医療」が進みつつあります。今後、IBDとColitic cancerの分野においても、APC、RNF43、TP53などのゲノム変異情報を用いて、dysplasiaの検出による早期診断や、Colitic cancerの層別化など、それに基づく治療方針の決定が行われていくものと期待できます。
原論文情報
- Masashi Fujita, Nagahide Matsubara, Ikuo Matsuda, Kazuhiro Maejima, Ayako Oosawa, Tomoki Yamano, Akihiro Fujimoto, Mayuko Furuta, Kaoru Nakano, Aya Oku-Sasaki, Hiroko Tanaka, Yuichi Shiraishi, Raúl Nicolás Mateos, Kenta Nakai, Satoru Miyano, Naohiro Tomita, Seiichi Hirota, Hiroki Ikeuchi, and Hidewaki Nakagawa, "Genomic landscape of colitis-associated cancer indicates the impact of chronic inflammation and its stratification by mutations in RNF43 and Wnt signaling", Oncotarget, doi: 10.18632/oncotarget.22867
発表者
理化学研究所
統合生命医科学研究センター ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
研究員 藤田 征志(ふじた まさし)
兵庫医科大学 炎症性腸疾患学 外科部門
教授 池内 浩基(いけうち ひろき)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.炎症性腸疾患(IBD)、潰瘍性大腸炎、クローン病
消化管に炎症を起こす慢性疾患の総称で、主に潰瘍性大腸炎(UC:Ulcerative colitis)、クローン病(CD:Crohn's disease)の2疾患からなる。これらは、自己免疫的な機序によると考えられている慢性炎症性疾患であり、治療はサリチル酸製剤、抗TNF-α抗体、副腎皮質ステロイドなどを用いて免疫抑制を行って寛解に導き、刺激の多い食事を控えて寛解を維持する。IBDはInflammatory Bowel Diseaseの略。 - 2.Colitic cancer
潰瘍性大腸炎(UC)、クローン病(CD)など慢性の炎症性腸疾患(IBD)を母地に発生したがんを指す。小さい早期病変であっても、粘膜下浸潤や転移が起こり、進行がんでは予後が不良である。また、平坦の形で多発性であり、粘液がん(粘液を産出する)や低分化型の病理像を呈する特徴もある。 - 3.dysplasia
Colitic cancerの前がん病変と考えられている。dysplasiaの形態は通常の大腸ポリープと比べて、形態が扁平である、多発傾向がある、周囲に異型度の異なる病変を合併しやすいなどの特徴がある。IBD長期経過例でのサーベイランスでは、内視鏡にてこのdysplasiaの探索を行うが、内視鏡にても検出は容易ではないdysplasiaも多い。 - 4.APC、 RNF43
大腸がん発生の最も早期に起こる変異が APC遺伝子の変異であり、これによりWntシグナルが活性化し、細胞の増殖、極性の変化などが引き起こされる。 RNF43は、Wntシグナルの上流で機能しており、細胞膜のWnt受容体と相互作用することによりWntシグナル伝達を阻害する。 RNF43の遺伝子変異により、 RNF43は機能を喪失し、Wntシグナルが活性化すると考えられている。RNF43の変異を指標とするがんの治療薬の開発も行われている。 - 5.次世代シーケンサー(NGS)、全エクソーム
ヒトゲノムの全配列約30億塩基を1,000米ドル以下のコストで解読すべく、欧米の政府や企業が技術開発を行った結果、より高速高精度の性能を持つシーケンサーが開発された。これを次世代シーケンサーと呼ぶ。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができ、一回の反応で数人分の全ゲノムの配列を解析できる。全ゲノム配列のうち、タンパク質をコードしている部分(約40-50Mb、全ゲノムの1-2%)のみに限定して行うNGS解析をエクソーム解析という。NGSはNext generation sequencerの略。 - 6.Wntシグナル経路
Wntと呼ばれる分泌タンパク質が、細胞に作用することにより活性化される細胞内シグナル伝達機構をWntシグナル経路と呼ぶ。初期発生において形態形成や細胞極性の決定などの重要な生命現象に関係しているが、恒常的に活性化されるとがんが引き起こされると考えられている。
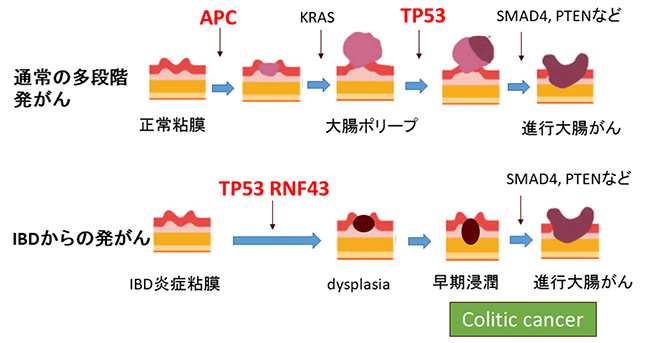
図1 通常型の大腸がんとcolitic cancerの多段階発がん経路
上図:通常のがんでは最初にAPC遺伝子に変異が入り、その後にKRAS遺伝子、TP53遺伝子などの変異が起こり、がんが発生するという多段階発がんが提唱されている。
下図:炎症性腸疾患(IBD)を原因とする「Colitic cancer」については、多段階発がん説が当てはまらないと考えられている。本研究では、発がん機構を解明するためColitic cancerに網羅的なゲノム解析を行った。
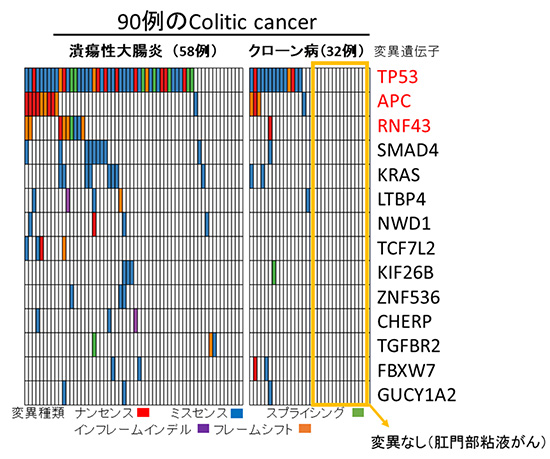
図2 90例のColitic cancerの遺伝子変異
IBD患者90例(潰瘍性大腸炎58例、クローン病32例)に発生したColitic cancerの網羅的なゲノム解析の結果、TP53、APC、RNF43の遺伝子変異が多く見つかった(赤文字)。APCとRNF43は、同じシグナル経路にあり、変異は相互補完的であった。なお、クローン病に合併する肛門周囲の粘液がんは、既知のがん遺伝子の変異は見つからなかった(オレンジ枠内)。
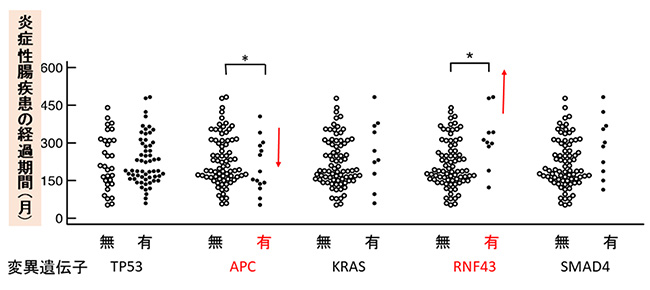
図3 変異遺伝子の有無とIBDの経過期間との関連
RNF43の変異のあるColitic cancerはIBD経過期間が長く(上向きの赤い矢印)、一方でAPCの変異のある症例は、IBD経過期間が短い(下向きの赤い矢印)。*P値<0.05
