2011年9月6日
独立行政法人 理化学研究所
藻類が作り出す代謝物の局在・移動を単一細胞内で初めて確認
-藻類「オーストラリアシャジクモ」の巨大単一細胞を用いてメタボローム解析-
ポイント
- 光や温度の変化により、代謝物が単一細胞内のどこに局在し、どう移動するかを観察
- 安定同位体を用いて、代謝物が細胞内小器官間を移動する様子を直接確認
- 植物を利用した有用物質生産の効率化につながる新知見を提供
要旨
独立行政法人理化学研究所(野依良治理事長)は、20cm以上にもなる巨大な単一細胞である「オーストラリアシャジクモ※1」の節間細胞※1を解析し、アミノ酸や有機酸、糖リン酸などの代謝物※2の局在・移動を初めて確認しました。これは、理研植物科学研究センター(篠崎一雄センター長)メタボローム機能研究グループの斉藤和季グループディレクター、及川彰研究員、国立大学法人神戸大学大学院理学研究科の三村徹郎教授らの成果です。
1つの細胞内には、核やミトコンドリア、葉緑体などの細胞内小器官が存在し、それぞれが特異的な役割を担っています。細胞内の代謝物は、その活性や外部からのストレスに応じて細胞内小器官へ局在・移動し、高度な制御のもと生体を守っていると考えられています。これまで、蛍光タンパク質を用いた解析などにより、代謝物を生合成する際の触媒(代謝酵素)の多くは、細胞内のどの小器官に局在するかが明らかになってきましたが、代謝物自体の細胞内小器官への局在・移動についてはほとんど明らかになっていませんでした。
研究グループは、池や沼に生息する藻類の1つ「オーストラリアシャジクモ」の節間細胞を用いて、単一細胞から単一液胞※3だけを分離し、液胞とそれ以外の部分(サイトプラズム)での代謝物濃度をメタボローム解析※4で網羅的に調べました。その結果、125種類の代謝物を検出し、それらの濃度が、光や温度のストレス条件下で、非同期的に変動する様子を観察しました。これは、代謝物が細胞内小器官の間を活発に移動していること、また、それぞれの代謝物の細胞内の局在が別々に制御されていることを示しています。
今回の手法を応用することで、植物の単一細胞内のどこにどのような代謝物が蓄積されるかの確認が容易になります。その知見をもとに、代謝酵素を適切な場所で発現させることができると、求める代謝物を効率的に得られることになり、植物による物質生産性向上につながる可能性があります。
本研究成果は、米国の科学雑誌『Plant Physiology』(10月号)に掲載されるに先立ち、オンライン版が近日掲載されます。
背景
植物や藻類などは、光合成によって水と二酸化炭素からブドウ糖を作ります。生命維持に必要なアミノ酸や核酸などの一次代謝物や、さまざまな活性を持つフラボノイド類、カロテノイド類などの二次代謝物は、種々の代謝酵素がブドウ糖をもとにして細胞内で生合成します。それぞれの代謝酵素は、その役割に応じて特定の部位(花や根など)や細胞(表皮細胞など)、細胞内小器官(核やミトコンドリア、葉緑体など)に局在しており、例えば、葉緑体に局在する代謝酵素は、光合成によってブドウ糖を作り出すことが知られています。このように、多くの代謝酵素の細胞内の局在については、蛍光タンパク質などを用いた解析により明らかにされてきています。その結果、教科書などの細胞の図には、代謝物が細胞内や細胞間を移動し、代謝酵素によって変換されていく様子が描かれています。一方、代謝物に関しては、「その代謝物を代謝する代謝酵素が○○に存在しているから○○に局在している」と考えられているだけで、直接その局在を確認した例はほとんどありません。これまで、複数の細胞を用いて、密度勾配遠心分離法※5などによって細胞内小器官を分離し、それぞれが含む代謝物量を調べることで代謝物の細胞内局在が報告されてきました。しかし、この方法では、生体全てまたは一部など多細胞の集合が必要で、細胞間や細胞内の代謝物の局在は無視されることがほとんどでした。そのため、「代謝物がどのように生体内で局在しているか」という厳密な細胞内小器官の分離が困難でした。そこで研究グループは、この代謝物の細胞内の局在を、単一細胞内で解明することに挑みました。
研究手法と成果
研究グループは、単一のオーストラリアシャジクモの節間細胞から、細胞内小器官である単一の液胞だけを簡便な手法で分離しました。この細胞は円筒状をしており、両端を切断して傾けると、他の細胞内小器官と比べ粘性の低い液胞内液だけを分離できます(図1)。この手法で得た液胞内液とそれ以外の部分(サイトプラズム)について、キャピラリー電気泳動質量分析装置※6によるメタボローム解析を行いました。その結果、125種類の代謝物を検出・同定し、主に液胞に局在するものとサイトプラズムに局在するものに分類できました(図2)。次に、光や温度の条件を変化させた場合の、それぞれの代謝物の液胞内液およびサイトプラズムでの濃度変動を調べました。その結果、液胞内液とサイトプラズムでの代謝物の濃度変動は、同調しているものもあれば、全く同調していないものもあることを見いだしました(図3)。液胞は、細胞のほとんどの体積を占めることもあり、細胞全体の代謝に影響を与えていることが分かってきていますが、この結果は、細胞内の代謝物濃度が複雑に制御されていることを示しています。さらに、細胞内小器官間を代謝物が直接移動することを確認するため、塩・乾燥ストレスなどを受けた際に細胞内の浸透圧調節の働きをもつ代謝物で、アミノ酸の1つであるプロリンの安定同位体を液胞に注射し、顕微鏡でこの局在の変化を調べました。その結果、24時間後には、液胞に注射したプロリンがサイトプラズムへ移動し、その比率は注射前(通常時)におけるプロリンの液胞とサイトプラズムの比率に近いこと、つまり、細胞がプロリンの濃度比を一定に保つ働きを持っていることが確認できました(図4)。
今後の期待
今回、オーストラリアシャジクモ節間細胞に着目したことで、メタボローム解析を含む代謝物解析の空間分解能を細胞内小器官レベルまで高めることができました。単一細胞内での代謝物濃度の変動は、代謝物が必要に応じて細胞内小器官間をダイナミックに移動している様子を示しており、生物を代謝物レベルから理解する新しい知見を提供します。
また、植物の有用物質のほとんどは液胞に蓄積されることが予想されていますが、有用物質ができるまでの中間体を含めた関連代謝物が、細胞内のどこに局在しているかは分かっていません。実際に植物を用いて有用物質生産を行うときには、どのような条件下でどこにどんな代謝物が局在しているかを確認することが必要で、その知見を利用して代謝酵素を適所で発現させると、より効率的な物質生産が可能になると期待できます。
発表者
理化学研究所
植物科学研究センター
メタボローム機能研究グループ(鶴岡)
研究員 及川 彰(おいかわ あきら)
Tel: 0235-25-3580 / Fax: 0235-25-3580
グループディレクター 斉藤 和季(さいとう かずき)
Tel: 045-503-9488 / Fax: 045-503-9489
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-506-9117 / Fax: 045-503-9113
国立大学法人神戸大学大学院 理学研究科 生物学専攻
生体分子機構講座 細胞機能教育研究分野
教授 三村 徹郎(みむら てつろう)
Tel: 078-803-5708 / Fax: 078-803-5708
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.オーストラリアシャジクモ、節間細胞
オーストラリアシャジクモは、車軸藻綱(Charophyceae)シャジクモ科(Characeae)に属する藻類。1つの細胞が大きいため、原形質流動の観察や細胞膜電位の実験に用いられている。節間細胞は節細胞に挟まれた植物における茎にあたる部分の細胞で、単一で20cm以上にもなる巨大な細胞。 - 2.代謝物
生物が体内で作り出す化合物のこと。アミノ酸や有機酸、核酸などの一次代謝物に加え、植物などは二次代謝物と呼ばれる化合物(フラボノイド類など)を作る。 - 3.液胞
細胞内小器官の1つ。植物細胞ではその体積のほとんどを占めることがある。以前は老廃物の貯蔵庫としての認識が主であったが、最近では独自の代謝系を持つことや、細胞全体の代謝に影響を与える働きなどが確認されつつある。 - 4.メタボローム解析
生体に含まれる代謝物を網羅的に解析する手法。オミックス解析の1つ。キャピラリー電気泳動質量分析装置などが用いられる。 - 5.密度勾配遠心分離法
ショ糖や塩化セシウムなどの物質を、濃度を変化させて試験管などに重層し、その上にサンプルを載せて遠心分離すると、サンプルの比重によって沈む度合いが異なり分離できる。細胞内小器官はそれぞれで比重が異なるため、細胞を密度勾配遠心分離法によって細胞内小器官ごとに分離することが可能である。 - 6.キャピラリー電気泳動質量分析装置
キャピラリー電気泳動は、微細な毛細管(キャピラリー)の中に電解液を満たし、両端に電位差(電圧)を加えて電気泳動することにより、キャピラリー内の代謝物やタンパク質を分離する手法。質量分析装置は、イオン化された物質の微細な重さを測定する装置。これら2つの装置を組み合わせて、キャピラリー電気泳動によって分離された物質の分子量を質量分析装置により測定する。メタボローム解析ではイオン性化合物を対象とした分析に適している。
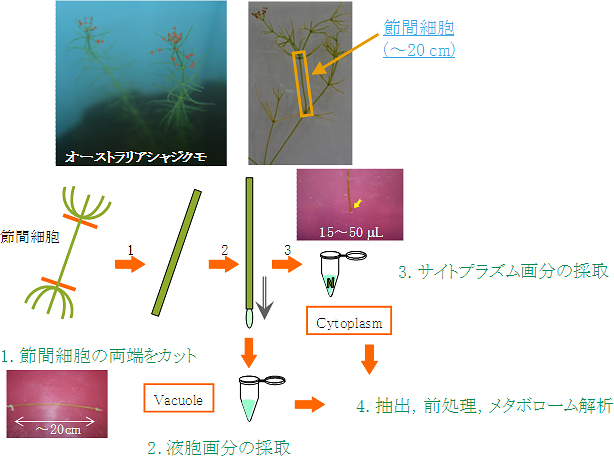
図1 オーストラリアシャジクモ節間細胞から液胞およびサイトプラズムを単離
オーストラリアシャジクモ(左上写真)の節間細胞(右上写真、橙色で囲まれた部分)は、20cm以上にもなる巨大な単一細胞である。この節間細胞の両端を切断し(1)、傾けると液胞内液を容易に単離できる(2)。残った部分はサイトプラズムとして採取し(3)、液胞内液とともにメタボローム解析を行った。
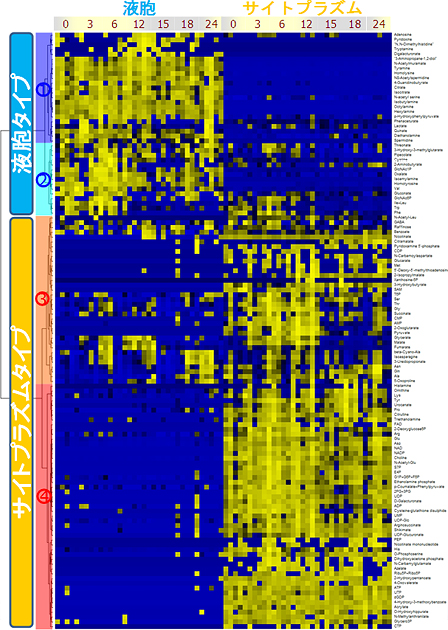
図2 液胞とサイトプラズムでの代謝物濃度
液胞とサイトプラズムにおける代謝物の細胞内の局在と、明暗変化(0~12時;明条件、12~24時;暗条件)による濃度変動を表している。縦軸は各代謝物で、横軸はその濃度を示す。代謝物の種類によって液胞に局在しているもの(液胞タイプ)やサイトプラズムに局在しているもの(サイトプラズムタイプ)に分かれており、それぞれのタイプの中でも、液胞とサイトプラズムの双方で検出されるもの(②、③)やどちらか一方にほとんど局在しているもの(①、④)を確認できた。このように、各代謝物の単一細胞内の局在性を確認することに成功した。
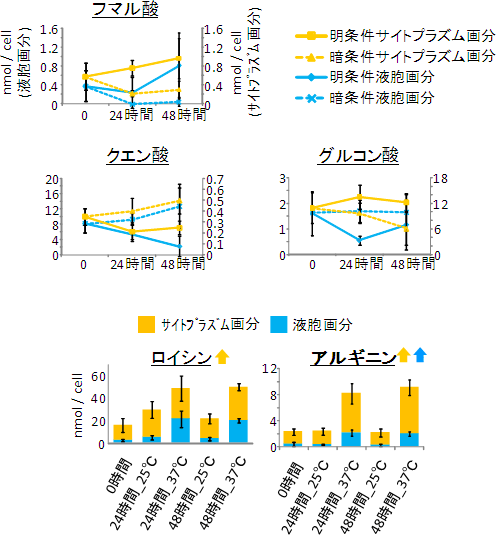
図3 光条件および温度条件の違いによる細胞内代謝物濃度の変動
-
図上:連続して明または暗条件下においた液胞とサイトプラズムの濃度変動。
フマル酸は明条件で濃度が増加(実線)し、暗条件で減少(破線)しているが、クエン酸は逆の変動を示した。グルコン酸はより複雑な変動を示した。このように、代謝物の種類や光条件によって、さまざまな濃度変化が起きていることが分かった。 -
図下:ロイシンとアルギニンの温度条件による濃度変化。
高温条件(37℃)と通常温度条件(25℃)下ではともに濃度が増加する。しかし、ロイシンではサイトプラズムにおける濃度にそれほど変化が無い一方で、アルギニンはサイトプラズムでも液胞でも濃度が増加していた。これらの結果は、外部環境の変化による細胞内代謝物濃度の変動が、代謝物ごとに制御されていることを示している。
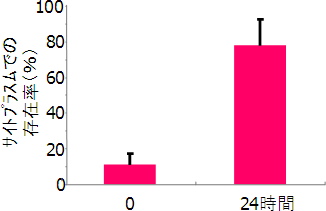
図4 液胞に注射した安定同位体標識プロリンのサイトプラズムへの移行
安定同位体で標識したプロリンを液胞に注射した後、0と24時間後の細胞全体に対するサイトプラズムでの存在比率。24時間後には80%近くの安定同位体標識プロリンをサイトプラズムで検出した。これは液胞からサイトプラズムへ安定同位体標識プロリンが移動したことを示している。また、その比率は注射前(通常時)におけるプロリンの液胞とサイトプラズムの比率に近いことも明らかにした。
