2012年11月8日
独立行政法人理化学研究所
可搬型のマイクロチップで極微量マイクロRNAを高速検出
-がん、アルツハイマー病、糖尿病などの超早期在宅診断に威力-
ポイント
- 持ち運び可能な自律駆動型で、場所を選ばずに診断が可能なマイクロチップを開発
- アトモル未満という極微量マイクロRNAの検出に成功
- 検出時間を従来の数時間から20分に大幅短縮
要旨
理化学研究所(野依良治理事長)は、ポンプや電源などの外部駆動力が不要で、持ち運び可能な自律駆動型マイクロチップを開発し、アトモル(amol;10-18分の1モル)未満の極微量マイクロRNA(miRNA)※1を、0.5マイクロリットル(μl:10-6分の1リットル)のモデル試料からたった20分で検出することに成功しました。これは、理研基幹研究所(玉尾皓平所長)前田バイオ工学研究室の前田瑞夫主任研究員、細川和生専任研究員、新田英之特別研究員らの研究チームによる成果です。
タンパク質に翻訳されず、遺伝子の発現を調節するなどの機能を持つノンコーディングRNA(ncRNA)※2の一種に、短い一本鎖のマイクロRNA(miRNA)があります。miRNAの中には、がん、アルツハイマー病、パーキンソン病、糖尿病などが進行するとともに体液中で増加するものがあります。そのため、ある特定のmiRNAは、これら疾病の超早期診断マーカーとして注目されています。現在は、PCR(ポリメラーゼ連鎖反応法)やシーケンサー、マイクロアレイといった検出法による診断が一般的です。しかし、これらの検出法は、高感度や同時大量処理(ハイスループット)性能では優れていますが、数時間から数十時間の検出時間がかかるうえ、大がかりな装置と高度な操作技術が必要でした。このため、持ち運び可能で自律駆動型かつ短時間で簡単に検出できるmiRNA検出チップが求められていました。
研究チームは、PDMS(ポリジメチルシロキサン)というシリコーンゴムの一種が空気を取り込む性質を持つことを利用し、極微量のmiRNAを短時間で検出できるマイクロチップを考案しました。まず、標的となるmiRNAと結合するDNA断片をガラス基板上に固定化します。その上に、サンプルの流入口3つと流出口1つ、さらに、それらをつなぐ幅100μm、高さ25μmの断面をもつマイクロ流路を刻んだPDMSを載せました。実際に、がん診断マーカーとしてよく知られているmiRNAを合成し、0.5μlの水溶液に0.25amolだけ溶かしたモデル試料で試したところ、わずか20分で検出することに成功しました。開発したマイクロチップは、さまざまな疾病を「その場」で診断できる超早期診断用チップの実現に向けた大きな一歩です。また、在宅診断や発展途上国での診療など、機動性を求められる診断の場でも威力を発揮すると期待できます。
本研究成果は、米国オンライン科学雑誌『PLoS ONE』(11月7日付け:日本時間11月8日)に掲載されます。
背景
18~24塩基程度の短い一本鎖であるマイクロRNA(miRNA)の中には、がん、アルツハイマー病、パーキンソン病、糖尿病などが進行すると、血液や体液中で増加する種類があることが分かってきました。そのため、ある特定の配列を持ったmiRNAが、種々の疾病の超早期診断マーカーとして注目されており、これらマーカーの検出技術が医療機関や研究機関から期待されています。しかし、従来のPCRやシーケンサー、マイクロアレイを用いた検出法では、高感度やハイスループットという面での要求は満たすものの、検出時間が数時間から数十時間かかるうえに、大がかりな装置と高度な操作技術が必要です。このため、短時間で簡単に検出可能なシステムの開発が求められていました。特に、持ち運び可能な自律駆動型が実現すると、在宅診断や発展途上国での診療など、「その場」診断医療が可能になります。
研究チームは、ポンプや電源などの外部駆動力が不要で、極微量のサンプルでも短時間で検出し、あらゆる「場所」で使用できる持ち運び可能なmiRNA検出チップの開発に取り組みました。
研究手法と成果
研究チームは、シリコーンゴムの一種で、生体適合性のよさと加工のしやすさなどから、コンタクトレンズや医用器具、防水剤、潤滑油、耐熱タイルなどに幅広く使用されているポリジメチルシロキサン(PDMS)に着目しました。PDMSは空気を取り込む性質を持っているため、脱気したPDMSが空気を取り込む力をポンプの動力源として利用できます。まず、検出したいmiRNAと特異的に結合するDNA断片をガラス基板上に固定化します。次に、サンプルの流入口を3つ、流出口を1つ、そして幅100μm、高さ25μmの断面をもつマイクロ流路を刻んだPDMSを載せます(図1)。PDMSが空気を取り込む力を利用して、サンプルを流入口からマイクロ流路に供給すると、検出したいmiRNAだけがDNAと相補的に複合体を形成(ハイブリダイゼーション)します。続いて、蛍光物質と、蛍光物質同士をつなぎ合わせる架橋剤を別々の流入口から滴下すると、合流部分で効率良く蛍光物質がつなぎ合わさって蛍光シグナルが増幅し(図2)、これまで研究チームが開発した方法に比べて検出感度が3桁上がりました。実際に、がん診断マーカーとしてよく知られていて、22個の塩基で構成されるmiRNA(miR-21※3)を0.5マイクロリットル(μl)の溶液に0.25アトモル(amol)だけ溶かしたモデル試料で試したところ、わずか20分でmiR-21の検出に成功しました。これらにより、開発した自律駆動型マイクロチップが、極微量のmiRNAを検出できることが分かりました(図3)。
今後の期待
研究チームは、これまで長時間かかっていたmiRNAの検出を、短時間で、外部駆動力が不要なマイクロチップ上で実現しました。この自律駆動型マイクロチップは、在宅診断や発展途上国でも利用可能です。今後、このマイクロチップのさらなる高精度化と測定手順の簡素化、再現性の確認、蛍光物質を観察する蛍光顕微鏡の小型化などが実現すると、さまざまな疾病を、「その場」で、短時間で、超早期に診断できると期待されます。
原論文情報
- Hideyuki Arata, Hiroshi Komatsu, Kazuo Hosokawa, and Mizuo Maeda "Rapid and Sensitive MicroRNA Detection with Laminar Flow-Assisted Dendritic Amplification on Power-Free Microfluidic Chip". PLoS ONE, 2012, doi:10.1371/journal.pone.0048329
発表者
理化学研究所
基幹研究所 前田バイオ工学研究室
主任研究員 前田 瑞夫(まえだ みずお)
専任研究員 細川 和生(ほそかわ かずお)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.マイクロRNA(miRNA)
細胞内に存在する長さ18から24塩基程度の1本鎖RNAをマイクロRNAと呼んでいる。タンパク質へは翻訳されず、他の遺伝子の発現調節などの機能を担っている。 - 2.ノンコーディングRNA(ncRNA)
タンパク質をコードしないRNA(non-coding RNA)。遺伝子発現制御など生物学的に重要な機能を持つncRNAも多く発見され、生物の発生や他の生物学的機能において重要な役割を担っている。 - 3.miR-21
がんの診断マーカーとして最もよく研究されている22個の塩基(UAG CUU AUC AGA CUG AUG UUG A)からなるマイクロRNA。
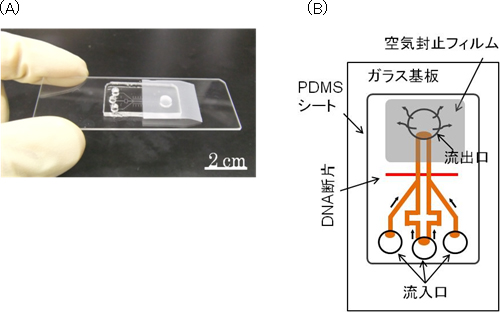
図1 持ち運び可能な自律駆動型マイクロチップ
- (A)
マイクロチップの写真
ガラス基板上にPDMSのチップを載せて、空気封止フィルムで固定するとともに、サンプル流出口を密閉することで、脱気したPDMSが空気を取り込む力を引き出している。 - (B)
模式図
左側の流入口からはmiRNAを含んだサンプルや蛍光物質を、中央の流入口からは架橋剤などを滴下する。右側の流入口からは、サンプルの代わりにmiRNAを含まない参照溶液(コントロール)を滴下して、バックグラウンドを検出する。
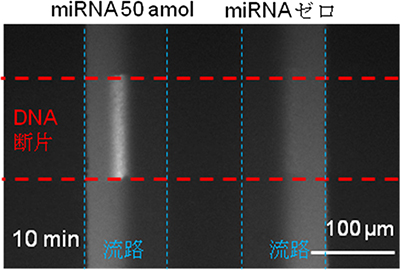
図2 50amolとゼロのときのmiRNAの蛍光シグナル
サンプルを滴下後10分経過時の蛍光顕微鏡で観察した蛍光シグナル。50amolのmiRNAが入ったサンプル(左)では、miRNAとDNA断片が特異的に結合し、さらに、この複合体に蛍光物質と架橋剤が流路中央付近で効率良く反応、白い蛍光シグナルを発した。
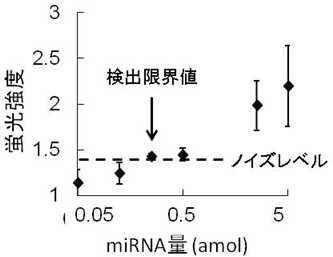
図3 自律駆動型マイクロチップの検出限界値
miRNAの濃度が0.25amlでノイズレベルを超えた(矢印)。
