要旨
理化学研究所(理研)小林脂質生物学研究室のネバル・イルマッツ特別研究員と小林俊秀主任研究員らの研究チームは、高速原子間力顕微鏡[1]を用い、膜孔形成毒素[2]の細胞膜への作用をナノメートルレベル(nm、1nmは10億分の1メートル)かつリアルタイムに可視化することに成功しました。
膜孔形成毒素は細胞膜に孔を開けて傷害を与えるタンパク質毒素の総称で、黄色ブドウ球菌のアルファヘモリジン、レンサ球菌のストレプトリジンO、炭疽菌毒素などがあります。中でもストレプトリジンOなどは脂質ラフト[3]と呼ばれる細胞膜上の脂質ドメインを標的とすることが知られています。脂質ラフトはスフィンゴ脂質とコレステロールに富んだ直径20~100ナノメートルの脂質ドメインです。細胞膜上をラフト(いかだ)のように自由に動き回り、細胞膜における情報伝達、膜輸送、バクテリアや細菌の感染に重要な役割を果たしていると考えられています。脂質ラフトは、膜孔形成毒素の結合部位として知られていますが、脂質ラフトに膜孔形成毒素が結合すると細胞膜にどのような変化が起こるのかは分かっていませんでした。
研究チームはこれまでシマミミズ由来の膜孔形成毒素「ライセニン」が脂質ラフトに結合することを詳細に調べてきました。今回、脂質ラフトを含む生体膜を再現したモデル膜を作製し、ライセニンの作用を高速原子間力顕微鏡により、ナノメートルレベルでリアルタイムに観測しました。その結果、ライセニンは脂質ラフトに結合して集合し、細胞膜に孔を開け、ライセニンと膜孔の複合体を形成した後、時間と共に膜全体を覆うことが分かりました。この結果は、多くの膜孔形成毒素の作用メカニズムを知る上での基礎となるものです。
本研究は、米国の科学雑誌『ACS Nano』に掲載されるのに先立ち、オンライン版(7月29日付け)に掲載されました。
背景
私たちの体を構成する物質の中で水、タンパク質に次いで多いのが脂質です。脂質は、脂肪としてエネルギー源となるだけでなく、細胞膜や細胞内小器官の膜など、生体膜の材料となります。脂質は細胞膜に均一に分布しているのではなく、特定の脂質組成を持つ微小領域(脂質ドメイン)を形成し、機能的な役割を果たしています。
脂質ラフトはスフィンゴミエリン[4]、スフィンゴ糖脂質などのスフィンゴ脂質とコレステロールに富んだ直径20~100ナノメートルの脂質ドメインです。細胞膜上を自由に動き回り、その様子からラフト(いかだ)と名付けられました(図1)。脂質ラフトは比較的“かたい”脂質ドメインであり、柔らかい膜の中に存在することが生物にとって重要で、細胞膜における情報伝達や膜輸送に重要な役割を果たしていると考えられています。また、膜孔形成毒素と呼ばれるタンパク質毒素の結合部位として知られています。膜孔形成毒素は細胞膜に孔を開けて傷害を与えるタンパク質毒素の総称で、黄色ブドウ球菌のアルファヘモリジン、レンサ球菌のストレプトリジンO、炭疽菌毒素などがあります。その中でストレプトリジンOなどは脂質ラフトを標的とすることが知られています。脂質ラフトにおける脂質とタンパク質毒素との相互作用の解明は、毒素の解毒という点からも重要な意味を持っています。
研究チームは、これまで脂質ラフトの主要成分であるスフィンゴミエリンに特異的に結合するシマミミズ由来の膜孔形成毒素「ライセニン」というタンパク質毒素を用いて、脂質ラフトとタンパク質毒素との相互作用を調べてきました。ライセニンの標的細胞への作用は、①脂質ラフトへのライセニン単分子の結合②ライセニンの集合③ライセニンによる脂質ラフトでの孔の形成④細胞膜の変化⑤細胞への障害、といった複数のステップを踏むと考えられますが、この過程は数十ナノメートルの膜ドメインにおいて数秒で起こるため、反応の全容をとらえることは極めて困難でした。
研究手法と成果
今回、研究チームはスフィンゴミエリン、ホスファチジルコリン[5]、コレステロールで形成される平面二分子膜(モデル膜)を作成し、ライセニンの細胞膜への作用を、高速原子間力顕微鏡を用いてナノメートルレベルかつリアルタイムに観察しました。モデル膜は、主にスフィンゴミエリンとコレステロールから成る“かたい”脂質ラフトと、主にホスファチジルコリンから成る“やわらかい”脂質ドメインに分離しています。実験では高速原子間力顕微鏡のステージの上にモデル膜を作成し、ライセニンを加えて、ライセニンと脂質の変化を観察し(図2A)、観察像をもとに三次元画像を構築しました(図2B)。その結果、ライセニンは脂質ラフトに結合して集合し、細胞膜に孔を開け、ライセニンと膜孔の複合体を形成して脂質ラフト上にきれいに配列することが分かりました。
ライセニンは脂質ラフトに特異的に結合するため、ホスファチジルコリンに富んだやわらかい膜には結合しませんが、時間と共にライセニンは膜全体を覆うことも分かりました(図3)。このことはライセニンにより“かたい”脂質ドメインと“やわらかい”脂質ドメインとが併合されたことを示しており、毒素による脂質膜再編成のメカニズムが明らかになりました(図3)。
今後の期待
今回の結果は膜孔形成毒素が単に細胞膜に孔をあけるだけでなく、脂質膜をダイナミックに再編成することを示しています。この結果は膜孔形成毒素の作用メカニズムを知る上での基礎的な情報を与えています。また、今回の結果は高速原子間力顕微鏡が脂質とタンパク質の相互作用の解析に極めて有用であることを示すものです。今後、高速原子間力顕微鏡を用いて多くの脂質とタンパク質の作用機構が解明されることが期待できます。
原論文情報
- Neval Yilmaz and Toshihide Kobayashi, "Visualization of lipid phase mixing induced by a sphingomyelin-binding toxin using high-speed atomic force microscopy", ACS Nano, doi: 10.1021/acsnano.5b01041
発表者
理化学研究所
主任研究員研究室 小林脂質生物学研究室
特別研究員 Neval Yilmaz(ネバル・イルマッツ)
主任研究員 小林 俊秀(こばやし としひで)
 発表者のネバル・イルマッツ(左)と小林 俊秀(右)
発表者のネバル・イルマッツ(左)と小林 俊秀(右)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.高速原子間力顕微鏡
試料と探針の間に働く原子間力を検出して試料の形態を測定する顕微鏡。探針を使ってこの力が一定になるように試料表面をなぞるとナノメートルレベルでの試料の形態を測定することができる。原子間力顕微鏡は水中や大気中での試料の詳細な形状を測定することができるが、測定に時間のかかることが生体試料の観察を難しくしていた。しかし高速原子間力顕微鏡により、リアルタイムで生物試料を観察することが可能になった。 - 2.膜孔形成毒素
細胞に孔を開けて傷害を与えるタンパク質毒素の総称。水溶性のタンパク質で、細胞膜上の標的分子に結合すると集合して膜に孔を形成し、細胞膜に障害を与える。膜孔形成毒素は直径10ナノメートル程度の孔を再現性良く形成することから、この孔にDNAを通過させて塩基配列を読む、という次世代の塩基配列解読の道具としても注目されている。 - 3.脂質ラフト
細胞表面に存在するスフィンゴ脂質とコレステロールに富んだ直径20~100ナノメートルの脂質ドメイン。細胞膜における情報伝達、膜輸送、バクテリアや細菌の感染に重要な役割を果たすと考えられている。 - 4.スフィンゴミエリン
動物細胞膜の主要脂質の1つ。コレステロールとともに脂質ラフトを形成する。 - 5.ホスファチジルコリン
動物細胞膜で最も多い脂質。飽和脂肪酸と不飽和脂肪酸の両方を分子内に含む分子種が多く、スフィンゴミエリンに比べ柔らかい膜を形成する。
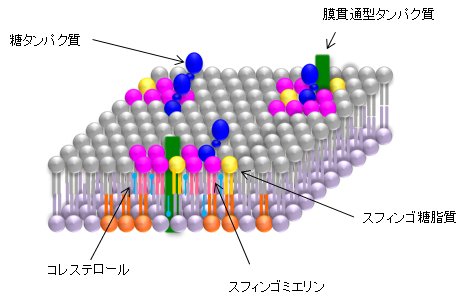
図1 脂質ラフトの模式図
脂質ラフトはスフィンゴミエリン、スフィンゴ糖脂質などのスフィンゴ脂質とコレステロールに富んだ脂質ドメインで特徴的な脂質、タンパク質組成をしている。
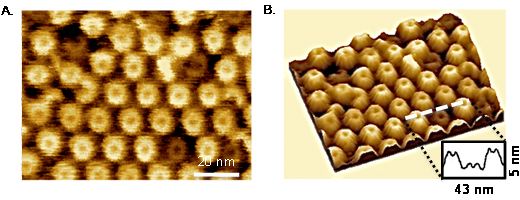
図2 ライセニンと脂質ラフトの結合
- (A) 高速原子間力顕微鏡でのライセニンが結合したモデル膜脂質ラフトの観察像
- (B) 観察像をもとに三次元構築したライセニンが結合したモデル膜表面。ライセニンが形成する膜孔が膜全体を覆っている。
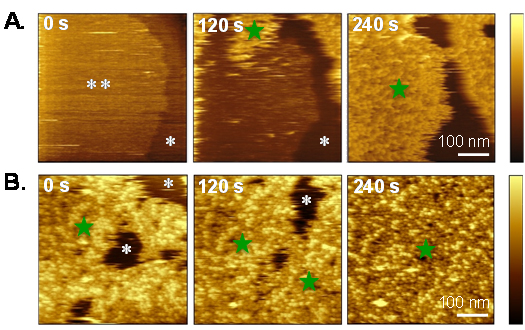
図3 ライセニンによって誘起される膜ドメインの併合
*はホスファチジルコリンに富んだやわらかいドメイン、**はスフィンゴミエリンに富んだかたいドメインを、緑の星印はライセニンを示す。(A)ライセニンはかたいドメインに選択的に結合する。(B)時間と共に*で示したやわらかいドメインが消失し、全体が均一になることが分かる。試料の高さの違いを輝度で表している。時間は測定開始後の時間を表す。右側のバーは輝度のスケールを示し、最も暗いところが相対高さ0、最も明るいところの高さは画像によって異なり(A)では15nm (0s), 20nm (120 s), 28nm (240 s)、(B)では17nm (0s), 14 nm (120s), 10nm (240s)を表す。
