要旨
理化学研究所(理研)小林脂質生物学研究室の小林俊秀主任研究員(研究当時)、稲葉岳彦基礎科学特別研究員(研究当時)、村手源英研究員(研究当時)、岸本拓磨基礎科学特別研究員(研究当時)らの共同研究グループ※は、脂質分解酵素「ホスホリパーゼCβ1(PLCβ1)[1]」のC末端[2]配列に脂質膜[3]をチューブ状に変形する活性があることを発見し、PLCβ1が細胞膜の重要な構造である「カベオラ[4]」形成に関与することを示しました。
脂質膜は、細胞の“形”を作るために重要な構造です。細胞の中と外の境界である細胞膜や細胞内小器官の小胞体、ゴルジ体、核膜などは、脂質膜を基本とする構造からできています。膜構造はさまざまな形をとり、その形がそれぞれの機能を発揮するために重要であることが知られています。多様な形態変化は脂質膜の柔軟な性質に支えられており、脂質膜の形を形成・維持するためには多くのタンパク質が働いていると考えられます。しかし、その全貌は明らかになっていません。
共同研究グループは、今回、未知の脂質膜変形因子の存在を予想し、その探索を目指しました。細胞の膜変形モデルとして人工的に作製したリポソーム[5]を解析対象とし、暗視野顕微鏡[6]を用いてさまざまな組織の抽出液と混合して膜変形を調べました。その結果、マウスの脳抽出液中のPLCβ1がリポソームをチューブ状に変形させることを突き止めました。PLCβ1を細胞に発現させると細胞膜がチューブ状に変形し、反対に発現量を低下させると細胞膜に存在するカベオラの数が減少しました。カベオラは、細胞膜における情報伝達、膜輸送や膜の構造維持に重要な細胞膜の陥入(かんにゅう)構造です。今回の結果は、PLCβ1に脂質膜を変形する活性があること、さらにPLCβ1が細胞膜の構造形成に働くことを示しています。
カベオラには、がん遺伝子として知られる受容体型チロシンキナーゼなどが集まっており、生存シグナル[7]を伝達しています。カベオラは、これらのタンパク質の活性を通じて、細胞シグナル伝達に関わります。そのため、本研究で解明されたカベオラ形成メカニズムは、今後、細胞シグナル伝達の解明、ひいては、がんの抑制メカニズムの解明にも役立つと期待できます。
本研究は、米国科学アカデミー紀要『The Proceedings of the National Academy of Sciences of the United State of America(PNAS)』オンライン版(6月24日付け)に掲載されました。
※共同研究グループ
理化学研究所 小林脂質生物学研究室(全て研究当時)
主任研究員 小林 俊秀(こばやし としひで)(現 フランス国立科学研究センター リサーチディレクター 兼 理研佐甲細胞情報研究室 客員主管研究員)
基礎科学特別研究員 稲葉 岳彦(いなば たけひこ)(現 理研佐甲細胞情報研究室 研究員)
基礎科学特別研究員 岸本 拓磨(きしもと たくま)(現 杏林大学 助教)
研究員 村手 源英(むらて もとひで)(現 理研佐甲細胞情報研究室 研究員)
客員研究員 酒井 祥太(さかい しょうた)
専任研究員 阿部 充宏(あべ みつひろ)
特別研究員 牧野 麻美(まきの あさみ)
協力研究員 富重 斉生(とみしげ なりお)
専任研究員 石塚 玲子(いしつか れいこ)
早稲田大学 理工学部
教授 武岡 真司(たけおか しんじ)
准教授 池田 康夫(いけだ やすお)
修士 田島 拓也(たじま たくや)
背景
脂質膜は、細胞の“形”を作るために重要な構造です。細胞の中と外の境界である細胞膜(図1)や、細胞内小器官の小胞体、ゴルジ体、核膜などは、脂質膜を基本とする構造からできています。膜構造はさまざまな形をとり、その形がそれぞれの機能を発揮するために重要であることが知られています。多様な形態変化は、脂質膜の柔軟な性質に支えられており、脂質膜の形を形成・維持するためには多くのタンパク質が働いていると考えられます。しかし、その全貌は明らかになっていません。
最近、Bin-amphiphysin-Rvs167(BAR)ドメイン[8](領域)という共通の構造を持つ一群の膜変形活性を持つタンパク質が発見されました。しかし、細胞の中には他にも未知の膜変形タンパク質が存在すると考えられます。共同研究グループは、未知の膜変形因子を探すため、新たな解析手法として人工的に作製したリポソームの暗視野顕微鏡観察を利用しようと考えました。
細胞はタンパク質、脂質、糖質など多くの分子から構成される複雑な系です。一方、リポソームは細胞膜の基本構造である脂質二重層で形成され、カプセル状をしており、細胞膜の構造に似ているため細胞の膜変形のモデルとして非常に有用です。リポソームは構成が単純なため、脂質膜の変化を直接調べることができます。脂質膜の厚さは数ナノメートル(nm、1nmは10億分の1メートル)と非常に薄いので、通常の顕微鏡では観察できませんが、光の散乱を利用する暗視野顕微鏡では、染色などの前処理なしでリポソーム変形を観察できます。
研究手法と成果
共同研究グループは膜変形因子を探すために、さまざまな組成の脂質からなるリポソームを作製し、さまざまな組織の抽出液と混合して暗視野顕微鏡で観察しました。その結果、ホスファチジルエタノールアミン(PE)、ホスファチジルコリン(PC)、ホスファチジルセリン(PS)の3種類の脂質を混ぜて作製したリポソームにマウスの脳組織の抽出液を混合すると、チューブ状の膜構造が形成されることが分かりました(図2)。
脳組織の中には多数の分子が存在するため、何が膜変形を担う因子であるかは分かりません。膜変形はPEがない場合は観察されなかったため、PEがある場合とない場合のそれぞれのリポソームに、どのようなタンパク質が結合するか調べました。すると、PEがあるときだけリポソームに結合するタンパク質が一つ見つかりました。これを質量分析[9]で調べたところ、脂質分解酵素「ホスホリパーゼCβ1(PLCβ1)」であることが分かりました。
PLCβ1が膜変形の候補因子と考えて、昆虫細胞(ガ由来の培養細胞)にPLCβ1を発現・精製し、リポソームに作用させました。その結果、マウスの脳抽出液と同様に、チューブ状の膜構造が観察されました。これは、PLCβ1に脂質膜をチューブ状に変形させる活性があること示しています。
PLCβ1は、細胞内の情報伝達に関わるタンパク質です。刺激が入力されると脂質分解活性が上昇し、ホスファチジルイノシトール-4, 5-二リン酸をジアシルグリセロールとイノシトール三リン酸へと分解します。この2分子は細胞内の情報伝達に重要なシグナル分子であり、PLCβ1は細胞内の情報伝達に不可欠です。しかし、これまで脂質膜をチューブ状に変形する性質は知られていませんでした。
PLCβ1には、脂質に結合する部位や脂質分解に関与する部位などがあります。また、他のPLCにない特徴として、C末端に追加配列があります(図3)。今回観察された膜変形がどの部位の働きによるか調べるため、それぞれの部位を大腸菌で作製し、リポソームの変形を調べました。その結果、PLCβ1に特徴的な配列であるC末端の部位(C2-Gαq-Ctail)があると、チューブ状の膜構造形成が起きることが分かりました。
チューブ状の膜構造形成を引き起こすものとして、BARドメインを持つタンパク質があります。BARドメインファミリーはタンパク質を構成するアミノ酸の配列が似ていなくても、立体的な構造が似ることが知られています。PLCβ1の立体構造は明らかになっていませんが、相同タンパク質のPLCβ3のX線構造解析は行われており、そのC末端はBARドメインと似た構造を取ることが分かっています。PLCβ1とPLCβ3のアミノ酸配列は非常によく似ているため、膜変形が観察されたPLCβ1のC末端もBARドメインと似た構造を形成する可能性が高いと予想されました。そのため、PLCβ1のC末端によるチューブ状の膜構造形成は、BARドメインによる膜変形と同じメカニズムで起こると考えられます。
次に、PLCβ1による膜変形はリポソームだけでなく、細胞でも起こるのかを確かめるために、マウスの培養細胞に蛍光タンパク質を融合させたPLCβ1を発現させました。その結果、細胞膜が変形し、細胞の内側に陥入したチューブ状の膜構造が観察されました(図4)。この膜変形は、脂質分解酵素の活性がない変異体のPLCβ1であっても観察されました。このことは、PLCβ1が引き起こす膜変形には脂質分解が不要であることを示しています。
以上の実験から、PLCβ1に脂質膜を変形する機能があることが明らかになりました。これが細胞にとってどのような意味を持つのかを調べるために、RNAi法[10]を使ってマウスの細胞のPLCβ1の発現量を低下させました。電子顕微鏡で観察した結果、細胞膜に存在するカベオラ(細胞膜の一部に高密度に分布する開口部の直径が50~100nmの窪み構造)の数が減少するとともに、カベオラに特徴的な陥入構造の代わりに、逆に細胞膜から外側へ突出している構造が複数観察されました(図5)。これらのことは、細胞膜のカベオラ形成にPLCβ1が関与することを示しています。なお、カベオラは細胞膜における情報伝達、膜輸送や膜の構造維持に重要な構造です。
今後の期待
今回解析に用いた実験系で、PLCβ1にこれまで知られていなかった膜変形活性があることを示しました。リポソームによる単純化したモデル系は、細胞そのものの観察だけでは得られない情報を補完するために有効であることを意味しています。特に、アミノ酸配列だけでは分からない立体構造と膜変形の関係は顕微鏡による直接観察が必須であり、この実験系を用いることで脂質膜と相互作用する未知の因子の発見につながると考えられます。
情報伝達に関与するPLCβ1が、細胞膜の形態形成に直接関与する可能性を示したことは、今後の関連研究に貢献すると期待できます。
また、カベオラには、がん遺伝子として知られる受容体型チロシンキナーゼなどが集まっており、生存シグナルを伝達しています。カベオラは、これらのタンパク質の活性を通じて、細胞シグナル伝達に関わります。そのため、本研究で解明されたカベオラ形成メカニズムは、今後、細胞シグナル伝達の解明、ひいては、がんの抑制メカニズムの解明にも役立つと期待できます。
原論文情報
- Takehiko Inaba, Takuma Kishimoto, Motohide Murate, Takuya Tajima, Shota Sakai, Mitsuhiro Abe, Asami Makino, Nario Tomishige, Reiko Ishitsuka, Yasuo Ikeda, Shinji Takeoka, and Toshihide Kobayashi, "Phospholipase Cβ1 induces membrane tubulation and is involved in caveolae formation", The Proceedings of the National Academy of Sciences of the United State of America (PNAS), doi: 10.1073/pnas.1603513113
発表者
理化学研究所
主任研究員研究室 小林脂質生物学研究室(研究当時)
主任研究員 小林 俊秀(こばやし としひで)
(現 フランス国立科学研究センター リサーチディレクター 兼 理研佐甲細胞情報研究室 客員主管研究員)
研究員 稲葉 岳彦(いなば たけひこ)
客員研究員 岸本 拓磨(きしもと たくま)
研究員 村手 源英(むらて もとひで)
 小林俊秀主任研究員(研究当時、左から2番目)と研究室メンバー
小林俊秀主任研究員(研究当時、左から2番目)と研究室メンバー
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ホスホリパーゼCβ1(PLCβ1)
ホスホリパーゼはリン脂質の加水分解酵素で、脂質分子の構造のうち、切断する部位でいくつかの種類に分類される。本研究で使用したC型のホスホリパーゼCは、脂質頭部のリン酸部位での切断活性を持ち、ホスファチジルイノシトール-4, 5-二リン酸を分解し、ジアシルグリセロールとイノシトール三リン酸を産生する。PLCβ1はそのファミリーの一つであり、Gタンパク質による活性化を受け細胞内の情報伝達に関与する。 - 2.C末端
タンパク質またはポリペプチドは直鎖上の分子であり、その両端はアミノ基(NH2-)のN末端とカルボキシル基(-COOH)のC末端で終端している。 - 3.脂質膜
水溶液中で脂質が集合し自然に形成される膜構造のこと。リン脂質など極性を持つ脂質は、親水性部分が水相側に、疎水性部分は内側に向かって集合して、脂質二重層の膜構造を形成する。細胞の生体膜の基本構造であり、細胞外界との障壁の役割を果たす。生体膜では各種膜タンパク質が埋め込まれており、シグナル伝達や物質輸送などの重要な機能を担う。 - 4.カベオラ
細胞膜の一部に高密度に分布する、開口部の直径が50~100nmの窪み構造のこと。膜タンパク質であるカベオリンで裏打ちされていて、カベオラの形成はカベオリンの発現に依存する。がん遺伝子の産物である受容体型チロシンキナーゼに代表される特定のタンパク質や、コレステロールやスフィンゴミエリンなどの特定の脂質に富み、細胞膜を介した物質の取り込みやシグナル伝達、細胞膜にかかる力の伝達に関与していると考えられている。 - 5.リポソーム
リン脂質は水中において、親水性部分を外側に疎水性部分を内側に向けて集合し脂質二重層の膜構造を形成する。膜構造の端は疎水性部分を露出しないように、閉じた微小なカプセル構造を形成し、これをリポソームと呼ぶ。カプセル構造になることで、外部と仕切られた内水相を持つ。生体膜構造に似ているため、生体膜のモデル系としての利用や薬物輸送システムとして、さまざまな医療分野で実用化されている。 - 6.暗視野顕微鏡
光の散乱現象を利用して観察する光学顕微鏡の一種。通常の顕微鏡では照明光がサンプルを透過して対物レンズを経由して像を得る。これに対し、暗視野顕微鏡では斜めから照明を当てることで、直接対物レンズに光が入らないようにする。サンプルがあるときだけ散乱した光が対物レンズに入り像を作るので、白黒がはっきりしたコントラストの画像が得られる。また、散乱を利用するため、蛍光色素などの染色は不要であり、観察対象のそのままの形を観察できる。一般的な検出限界を超えて、脂質膜のように5nm程度の構造や、直径25nmの微小管1本であっても観察できる。 - 7.生存シグナル
細胞集団は相互に情報伝達を行いながら増殖を行う。細胞増殖に関係する生存シグナルと細胞死に関係するアポトーシスシグナルがあり、両者のバランスで細胞の生死が決定される。組織など、適切な場所に特定の細胞が集合する必要があるときは、不要な細胞は細胞死が誘導され取り除かれる。こういったバランスが崩れて異常な増殖や過剰な細胞死が誘導されるとがん化などさまざまな疾患につながる。 - 8.Bin-amphiphysin-Rvs167(BAR)ドメイン
BARドメインと呼ばれるカーブした構造のタンパク質ドメインのこと。カーブした面には脂質膜結合能力があり、結合した膜を変形し、カーブと同じ曲率に曲げる機能がある。BARドメインが結合すると、脂質膜はチューブ状に変形することが知られている。さまざまなタンパク質がBARドメインを持つことが知られているが、アミノ酸配列に相同性はあまりなく、立体構造と機能で分類される。 - 9.質量分析
原子や分子などを何らかの方法で気体状のイオンにして、そのイオンの質量を分析することにより、原子や分子の種類を推定する分析手法。また、そのイオンの検出量から、原子や分子の含有量を調べることができる。今回利用した手法は、未知のタンパク質サンプルをレーザーでイオン化し、その質量情報からどのようなタンパク質が含まれるか解析した。 - 10.RNAi法
特定の配列を持つRNAを細胞へ導入することで、相補的なmRNAの分解を促進させる方法。結果的に、その目的の遺伝子の機能を抑制することができる。
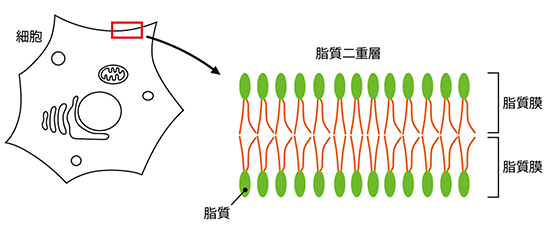
図1 細胞膜の構造
細胞膜の基本構造は脂質膜が重なった脂質二重層である。
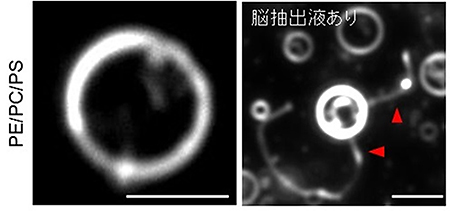
図2 マウスの脳抽出液によるリポソームのチューブ状膜構造形成の暗視野顕微鏡画像
左:通常のリポソーム。白く見えるリングが脂質二重層である。スケールバーは、5マイクロメートル(μm、1μmは1,000分の1mm)。
右:PE、PC、PSの3種類の脂質を混ぜて作製したリポソームにマウスの脳抽出液を作用させた後の様子。赤い矢尻は、新たに形成されたチューブ状の膜構造を指している。白く見えるリングは左画像と同様に、リポソームの脂質二重層である。スケールバーは5μm。
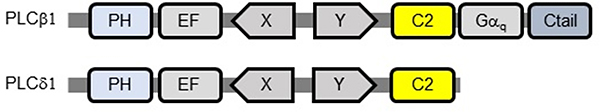
図3 PLCβ1とPCLδ1のC末端部位の比較
PHはPHドメイン(pleckstrin homologyドメイン)、EFはEFハンドモチーフ(タンパク質の二次構造の一種)、X-Yは脂質分解酵素ドメイン、C2はC2ドメイン、GαqはGタンパク質相互作用ドメイン、CtailはC末端配列を示す。PLCδ1と比べると、PLCβ1はC末端に追加のGαq-Ctail構造を持っている。C2-Gαq-Ctailが、チューブ状の膜構造形成に重要であることが分った。
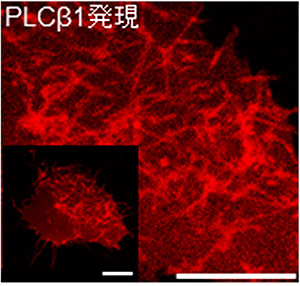
図4 マウス培養細胞におけるPLCβ1によるチューブ状膜形成の蛍光顕微鏡画像
一つの細胞にPLCβ1全長を発現したときの様子。左下は、細胞の全体画像。細胞膜が変形し、細胞の内側に陥入したチューブ状の膜構造(赤く光っている線)が観察できる。スケールバーはどちらも20μm。
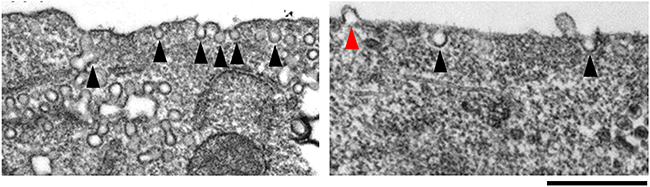
図5 マウス培養細胞におけるPLCβ1の発現阻害の影響を表した電子顕微鏡画像
左:通常の細胞。黒い矢尻がカベオラを指している。
右:PLCβ1の発現を阻害した細胞。黒い矢尻はカベオラを、赤い矢尻は細胞膜の突出を指している。発現量が低下すると、カベオラの数の減少と細胞膜の突出が観察された。スケールバーは500nm。
