要旨
理化学研究所(理研)統合生命医科学研究センター免疫恒常性研究チームの早津徳人研究員(研究当時)、宮尾貴久テクニカルスタッフと堀昌平チームリーダー(研究当時)らの研究チームは、マウスを用いて、転写因子BATFが制御性T細胞(Treg細胞)[1]による免疫抑制に重要な働きをしていることを発見しました。
Treg細胞は免疫応答を抑制する機能を持ち、自己免疫疾患[2]や炎症性疾患、アレルギー疾患などを引き起こす過剰な免疫応答を抑制する役割を担っています。一方、Treg細胞は過剰に働くと、がん細胞に対する免疫応答を抑制してがんの成長を助けてしまうと考えられています。2003年に堀チームリーダーと坂口志文大阪大学特任教授らは、転写因子Foxp3[3]がTreg細胞の発生・分化と機能を制御する“マスター転写因子”[4]として働くことを発見しました注1)。Foxp3遺伝子の変異はヒト自己免疫疾患IPEX症候群[5]の原因となり、IPEXはTreg細胞の異常により引き起こされると考えられています。しかし、Foxp3がTreg細胞の働きを制御するメカニズムには多くの謎が残されていました。
今回、研究チームはヒトIPEX症候群において見つかっているFoxp3変異に着目し、変異を導入した遺伝子改変マウスを作製して変異がFoxp3の機能とTreg細胞に与える影響を調べました。その結果、一つの変異体(384番目のアラニンがスレオニンに置換されたA384T変異体)が、皮膚や肺などの特定の非リンパ組織におけるTreg細胞の機能を選択的に障害することにより、それらの組織に炎症を引き起こすことを明らかにしました。さらに、この組織におけるTreg細胞の機能異常の一因はA384T変異体による転写因子BATFの発現抑制であることが分かりました。
今回の成果は、Tregによる免疫抑制メカニズムの一端を明らかにするものであり、自己免疫疾患、炎症性疾患、アレルギー疾患、がんなどの発症メカニズムの解明と新しい治療法の開発に貢献するものと期待できます。
本研究は、米国の科学雑誌『Immunity』(8月15日号)に掲載されるのに先立ち、オンライン版(8月1日付け:日本時間8月2日)に掲載されます。
注1)Hori S, Nomura T and Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 299: 1057-1061, 2003
背景
免疫系は、細菌、ウイルス、がん細胞などの多様な病原体を排除して身体を守るように高度に進化したシステムです。一方で、免疫応答が過剰になると正常な細胞や組織にも害を及ぼし、さまざまな病気を引き起こします。このため、免疫系が適切に働くためには免疫応答のバランスを保つ仕組みが重要です。
制御性T細胞(Treg細胞)は免疫応答を抑える機能を持ち、自己免疫疾患、炎症性疾患、アレルギー疾患などを引き起こす過剰な免疫応答を抑制しています。逆にTreg細胞が過剰に働くと、がん細胞などの病原体に対する免疫応答を抑制し、がんの成長を助けてしまうと考えられています。
2003年に堀チームリーダーと大阪大学免疫フロンティア研究センターの坂口志文特任教授らは、ヒト自己免疫疾患IPEX症候群の原因遺伝子として同定された転写因子Foxp3がTreg細胞に選択的に発現し、その発生・分化と免疫抑制機能をつかさどる“マスター転写因子”として働くことを明らかにしました。この発見以降、Treg細胞の分化と機能のメカニズムについての研究が世界中で進められ、Foxp3はTreg細胞において300個を超える他の転写因子と複合体を形成してゲノム上数千に及ぶ場所に結合し、Treg細胞の遺伝子発現を制御していることが明らかにされました。しかし、Foxp3の標的遺伝子は多数あるために、どの遺伝子がTregのどのような性質を制御しているのかについては十分理解されていませんでした。
そこで研究チームは、IPEX症候群において見つかっているFoxp3変異の中に、機能的に重要な特定の標的遺伝子の発現に影響を与えてTreg細胞の働きを弱めるものがあるのではないかと考えました。そして、Foxp3のDNA結合を担うフォークヘッドドメインに見つかっている三つのミスセンス変異(I363V[363番目のイソロイシンのヴァリンへの置換]、A384T[384番目のアラニンのスレオニンへの置換]、R397W[397番目のアルギニンのトリプトファンへの置換])に着目し、これらの変異がTreg細胞の遺伝子発現と機能に与える影響を詳しく調べることにしました。
研究手法と成果
研究チームは、I363V、A384T、R397Wの三つの変異を導入した遺伝子改変マウスを作製し、変異がTreg細胞の機能と遺伝子発現に与える影響を調べました。その結果、I363V変異とR397W変異は、Treg細胞に特有の遺伝子の発現を大きく変化させて試験管内でT細胞増殖を抑制する機能を障害する機能欠失型変異であることが分かりました。一方、これらとは異なりA384T変異体は、一部のTreg細胞特有の遺伝子の発現のみを選択的に変化させるものの、試験管内での抑制機能を障害しませんでした。しかし、I363V、R397W変異マウスのみならず、A384T変異マウスも自己免疫疾患を自然発症したことから、A384T変異はTreg細胞の生体内での抑制機能を障害することが分かりました。
次に、A384T変異によりTreg細胞の生体内での抑制機能が障害される原因を明らかにするために、マウスのさまざまな組織でのTreg細胞の割合を調べました。その結果、皮膚や肺といった炎症を起こす非リンパ組織において、Treg細胞の割合が減少し、逆に炎症を起こすヘルパーT細胞[1]の割合が増加していました。一方、リンパ節や脾臓といったリンパ組織[6]では、Treg細胞とヘルパーT細胞のバランスに変化はみられませんでした。Treg細胞は、リンパ節などのリンパ組織を巡回するナイーブ型と、非リンパ組織に局在するエフェクター・メモリー型の2種類に大別され、前者が抗原による刺激を受けて活性化され、後者に機能分化していきます。A384T変異は、ナイーブ型Treg細胞がエフェクター・メモリー型Treg細胞へ分化して、非リンパ組織に集積する能力を障害し、このために組織において免疫応答が抑制できなくなることが分かりました(図1)。
続いて、A384T変異がどの標的遺伝子の発現に影響を与えることにより、エフェクター・メモリー型Treg細胞の機能分化を障害しているのかを調べるために、マイクロアレイ解析[7]により遺伝子発現を、ChIP-seq解析[8]によりFoxp3のゲノム上の結合場所を網羅的に調べました。その結果、Foxp3の標的遺伝子であるBATFという転写因子の発現がA384T Treg細胞で選択的に低下していることを見つけました。BATFの発現低下がA384T Treg細胞の機能障害の原因であるかを明らかにするために、BATF欠損マウスを用いて、そのTreg細胞を詳しく調べました。その結果、BATF欠損Treg細胞は、A384T Treg細胞と類似した遺伝子発現を示し、エフェクター・メモリー型Treg細胞への機能分化と、生体内で免疫応答を抑制する機能が障害されていることが分かりました。さらに、レトロウイルスベクター[9]を用いて、A384T Treg細胞にBATFを強制発現させて発現レベルを上げたところ、エフェクター・メモリー型Treg細胞の分化と組織への集積能力、そして生体内における免疫抑制機能が回復しました。以上の結果から、A384T Treg細胞の機能障害の一因はBATFの発現低下によることが明らかになりました(図1)。
最後に、A384T変異によりBATFなどの特定の標的遺伝子の発現が障害されるメカニズムを調べました。その結果、A384T変異はFoxp3によるDNA認識特異性を拡大させる機能獲得型変異であり、このためにBatf遺伝子のプロモーター[10]により強く結合して転写を抑制していることが明らかになりました(図1)。
今後の期待
本研究により、転写因子BATFがTreg細胞による免疫抑制機能の一端を担う重要な役割を担っていることが明らかになりました。このことは、Treg細胞においてBATFの発現または機能を強化することで、組織における過剰な免疫応答を抑制でき、逆にその発現・機能を阻害することで組織における免疫応答を強化できる可能性を示しており、さまざまな自己免疫疾患、炎症性疾患、アレルギー疾患、さらにはがんの治療法の開発につながることが期待できます。
原論文情報
- Norihito Hayatsu, Takahisa Miyao, Masashi Tachibana, Ryuichi Murakami, Akihiko Kimura, Takako Kato, Eiryo Kawakami, Takaho A. Endo, Ruka Setoguchi, Hiroshi Watarai, Takeshi Nishikawa, Takuwa Yasuda, Hisahiro Yoshida, Shohei Hori, "Analyses of a mutant Foxp3 allele reveal BATF as a critical transcription factor in the differentiation and accumulation of tissue regulatory T cells", Immunity, doi: 10.1016/j.immuni.2017.07.008
発表者
理化学研究所
統合生命医科学研究センター 免疫恒常性研究チーム
チームリーダー(研究当時) 堀 昌平(ほり しょうへい)
(現 客員研究員)
(現 東京大学大学院薬学系研究科 免疫・微生物学教室 教授)
研究員(研究当時) 早津 徳人(はやつ のりひと)
テクニカルスタッフⅠ 宮尾 貴久(みやお たかひさ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.制御性T細胞(Treg細胞)、ヘルパーT細胞
T細胞は、T細胞レセプターと呼ばれるタンパク質を細胞表面に持ち、このレセプターを介して異物を特異的に認識して活性化する。T細胞はその働きから、ウイルス感染細胞やがん細胞などを特異的に殺すキラーT細胞、B細胞やマクロファージ(食細胞)など他の免疫細胞に働きかけてその機能を活性化するヘルパーT細胞に大きく分類されてきた。さらに最近、T細胞には、他の免疫細胞(キラーT細胞、ヘルパーT細胞、B細胞、マクロファージなど)に働きかけて、その活性化を抑制する機能を持つ制御性T細胞(Treg細胞)と呼ばれる新たな集団が存在することが明らかにされた。制御性T細胞はリンパ組織中、T細胞の約5~10%を占め、転写因子Foxp3( [3]参照)の発現により、他のT細胞と区別される。 - 2.自己免疫疾患
何らかの免疫異常によって自分の身体を構成する物質を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の組織を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。IPEX症候群( [5]参照)も自己免疫疾患の一つ。 - 3.Foxp3
ヒトの遺伝性免疫疾患IPEX症候群( [5]参照)の原因遺伝子として、2001年に米国の研究グループにより報告された転写因子。2003年に堀昌平チームリーダーらにより、この転写因子がTreg細胞に発現する選択的なマーカーで、その分化と機能を制御するマスター転写因子( [4]参照)であることが明らかになった。 - 4.マスター転写因子
特定の細胞種に分化するためには、その細胞特有の機能を発現するために必要な一群の遺伝子セットを発現し、その細胞とは無関係な一群の遺伝子セットの発現が抑制されことが必要である。一般に遺伝子の発現は、遺伝子発現制御領域である特定のDNA配列に転写因子と呼ばれるタンパク質が結合することで調節されている。細胞分化に伴ってある特定の転写因子が遺伝子発現制御領域に結合することで、その細胞種特有の遺伝子発現パターンが誘導されるとき、そのような細胞分化の最初のスイッチとして機能する転写因子をマスター転写因子と呼ぶ。 - 5.IPEX症候群
X染色体連鎖型劣性の遺伝様式を示し、変異を受け継いだ男子のみが致死性の自己免疫性・炎症性・アレルギー性免疫疾患を発症する。膵臓、甲状腺、大腸、皮膚などさまざまな臓器に炎症・組織破壊が起こり、患者は通常生後1、2年以内に死亡する。2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームがこの遺伝性免疫疾患の原因遺伝子を同定し、転写因子Foxp3であることを報告した。Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked(X染色体連鎖型免疫調節異常・多発性内分泌障害・腸症)症候群の略。 - 6.リンパ組織
免疫反応の担い手であるリンパ球(T細胞とB細胞)の発生、分化、増殖、そして抗体産生などの機能発現の場となる器官。胸腺、骨髄、リンパ節、脾臓など。 - 7.マイクロアレイ解析
塩基配列が既知の多種類の遺伝子のDNAをプローブとして、プレート上に規則正しく貼付けておく。調べたい細胞からmRNAを採取し、蛍光標識する。これをプレート上に貼付けられたDNAと反応させ、蛍光強度を読み取ることにより、mRNAの発現量を網羅的かつ定量的に調べることができる。 - 8.ChIP-seq解析
クロマチン免疫沈降法と次世代シーケンサーを組み合わせた網羅的解析方法。特定の転写因子などのタンパク質に対する抗体により免疫沈降を行って、そのタンパク質に結合しているDNA断片を回収し、次世代シーケンサーを用いてそのタンパク質がゲノム上どの場所に結合しているかをゲノムワイドかつ網羅的に解析する方法。ChIPは、chromatin immunoprecipitationの略。 - 9.レトロウイルスベクター
ベクターとは遺伝子の「運び屋」のこと。細胞に感染し遺伝子をうまく内部に運び入れてくれるウイルスを利用する場合が多い。1本鎖RNAウイルスであるレトロウイルスを用いたベクターがレトロウイルスベクターで、iPS細胞の作製にも使われている。ウイルスが持つ病原性に関する遺伝子は取り除かれている。 - 10.プロモーター
ある遺伝子が発現し転写される際に、RNAポリメラーゼが結合して転写を始めるためのゲノム上の領域のこと。
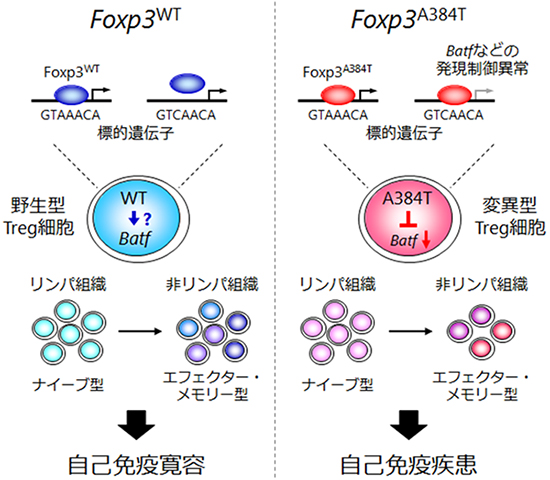
図1 Foxp3A384T変異による自己免疫疾患発症機構
野生型Foxp3(Foxp3WT)はGTAAACAなどのDNA配列に結合するが、Foxp3A384T変異体はそれらに加えて野生型が認識しないGTCAACAなどのDNA配列にも結合できるようになった機能獲得型変異である。このためにA384T変異体はBatfプロモーターに野生型よりも強く結合し、その転写を抑制する。転写因子BATFの発現低下により、A384T変異型Treg細胞は非リンパ組織に局在するエフェクター・メモリー型Treg細胞の分化と組織への集積が障害される。その結果、自己組織に対する免疫応答が抑制できず、自己免疫疾患を発症する。
