研究内容
- 性フェロモン産生の分子メカニズムに関する研究
- 性フェロモン産生に関わる遺伝子解析
- バキュロウイルスによる感染細胞核の改変に関する研究
- キイロショウジョウバエを用いた核小体に局在するGTP結合タンパク質の機能解析
- mRNPの細胞内局在と調節に関する研究
性フェロモン産生の分子メカニズムに関する研究
研究目的
ガ類昆虫におけるフェロモン産生過程(フェロモノジェネシス)は、リポジェネシスやリポリシスに加え、ペプチドホルモンPBANによる細胞内シグナル伝達や脂質の細胞内輸送・放出に伴うメンブレントラフィックなど様々な細胞生化学的に重要な事象および未解明な課題を包含する。したがって、フェロモン産生をキーワードにこれらの課題に取り組むことは、脊椎動物においても明確でない脂質の細胞内輸送機構やリポリシスにおける機能分子の動員機構に関する新知見が期待され、その成果を他の生物にフィードバックすることも可能である。そこで、本研究では、フェロモン腺細胞で繰り広げられるフェロモノジェネシスに関わる様々なイベントの成り立ちを、分子および細胞レベルから詳細に解析し、それらを総合的に理解することで、フェロモン産生に向けた分子メカニズムの全体像を明らかにすることを最終目的とする。
研究成果
(i) カイコガ個体でのRNAi法の確立
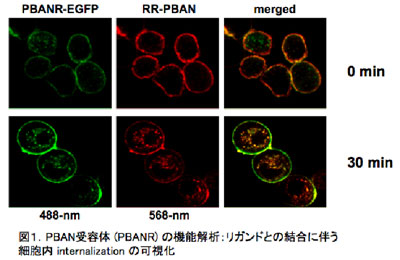 カイコガのフェロモン腺細胞は、羽化前後のフェロモノジェネシスの過程で様々なフェロモン腺特異的遺伝子を発現する。そこで、我々はフェロモン腺特異的遺伝子Bmpgdesat1, pgFAR, PBANR, pgACBPをクローニングし、発現系を用いたfunctional assayから、これらの機能を明らかにした(図1)。しかし、フェロモン産生機構を真に理解するためには、遺伝子機能をheterologousな系で調べるだけでは不十分であり、遺伝子や遺伝子産物がフェロモン腺細胞で実際にどう機能しているのかを明確にすることが必要である。そこで、さらにフェロモン腺特異的遺伝子のin vivoでの役割を実証する系として、純系系統p50カイコガの蛹化直後にフェロモン腺特異的遺伝子の二本鎖RNA (dsRNA)を注射するカイコガ個体でのRNAi法を確立した。この系は、単に特定の遺伝子のフェロモン産生への関与をin vivoで実証するだけでなく、遺伝子ノックダウンの効果とフェロモン前駆体の貯蔵体として機能するフェロモン腺細胞に特徴的な脂肪滴のダイナミクス解析とを組み合わせることで、フェロモン産生過程における機能分子のカスケード、分子間相互作用の解析にも有効なツールとなりうることが実証された [1]。
カイコガのフェロモン腺細胞は、羽化前後のフェロモノジェネシスの過程で様々なフェロモン腺特異的遺伝子を発現する。そこで、我々はフェロモン腺特異的遺伝子Bmpgdesat1, pgFAR, PBANR, pgACBPをクローニングし、発現系を用いたfunctional assayから、これらの機能を明らかにした(図1)。しかし、フェロモン産生機構を真に理解するためには、遺伝子機能をheterologousな系で調べるだけでは不十分であり、遺伝子や遺伝子産物がフェロモン腺細胞で実際にどう機能しているのかを明確にすることが必要である。そこで、さらにフェロモン腺特異的遺伝子のin vivoでの役割を実証する系として、純系系統p50カイコガの蛹化直後にフェロモン腺特異的遺伝子の二本鎖RNA (dsRNA)を注射するカイコガ個体でのRNAi法を確立した。この系は、単に特定の遺伝子のフェロモン産生への関与をin vivoで実証するだけでなく、遺伝子ノックダウンの効果とフェロモン前駆体の貯蔵体として機能するフェロモン腺細胞に特徴的な脂肪滴のダイナミクス解析とを組み合わせることで、フェロモン産生過程における機能分子のカスケード、分子間相互作用の解析にも有効なツールとなりうることが実証された [1]。
(ii) PBANシグナリングのカスケードの解明:受容体からチャネルまで
PBANシグナリングに関わるCa2+チャネル分子の実体およびPBAN刺激がいかなる分子を介していかにチャネルに伝達されるのかといった細胞内シグナル伝達カスケードを解明する目的で、ボンビコール産生細胞における蛍光Ca2+イメージングを試みた。その結果、PBAN刺激後、数秒以内にCa2+の急激な細胞内動員が引き起こされることが示され、PBAN刺激に伴う細胞外Ca2+の動 員を直接証明することに成功した。これまで知られている細胞膜表面のCa2+チャネルには、電位作動性チャネル(VOC)と受容体活性化チャネル(RACC)があり、後者はさらに、ストア作動性チャネル(SOC)と受容体作動性チャネル(ROC)に分けられる。このうち、SOCはホスファチジルイノシトール (4,5)-ビスリン酸からPLCの作用で切り出されたイノシトール1,4,5-トリリン酸 (IP3)が小胞体Ca2+ストアの放出を促し、小胞体Ca2+が枯渇することで活性化されるが、タプシガーギン(Tg)で人為的に小胞体Ca2+ストアを枯渇させることでも、SOCが活性化されることが知られている。そこで、ボンビコール産生細胞をTgで処理すると、PBAN処理と同様、Ca2+動員とともに脂肪滴の崩壊、ボンビコール産生が促される一方、PBAN処理に伴う応答はいずれも、SOCs特異的阻害剤(2-APBなど)により抑制された。さらに、イノシトールリサイクリングを塩化リチウムで止める方法でボンビコール産生細胞におけるIP3量を測定すると、PBANを処理した場合のみ、経時的にIP3量が増加することがわかった。以上の結果は、PBAN刺激がPBANRで受容されたのち、Gq→PLC→IP3→小胞体Ca2+ストアの枯渇というカノニカル経路でSOCのCa2+チャネルに伝達されることを示唆している。そこで、PBANRからSOC開口までのカスケードの実証に向け、関与が予想される機能分子遺伝子群を包括的にクローニングし、RNAiによりフェロモン産生への関与を逐一検証することで、PBANシグナリングのカスケードにシグナル分子としてBmGq, BmPLCβ1, BmIP3R, BmSTIM1, BmOrai1, BmPLCΓが関与することを実証した[2]。
(iii) カイコガ性フェロモン産生に関わるその他の機能分子
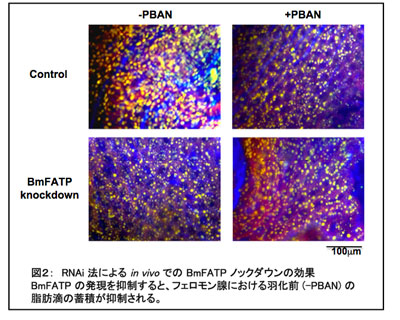 PBAN刺激により活性化されるボンビコール生合成過程は、ボンビコール前駆体の貯蔵体である脂肪滴のリポリシスおよび切り出されたボンビコール前駆体を還元してボンビコールに変換する過程である。そこで、PBAN刺激が機能分子のリン酸化を介してこれらの過程を活性化するのかどうかを検証する目的で、PBAN刺激に伴ってリン酸化されるタンパク質の検索を行った結果、少なくとも5種類のタンパク質がPBAN刺激に伴ってリン酸化され、そのうちのひとつは脂肪滴表面に局在するタンパク質で、リン酸化されることで脂肪滴のリポリシスを促進することが明らかとなった。これとは別に、フェロモン腺選択的に発現するfatty acid transport protein (BmFATP)をRNAiによりノックダウンすると、羽化前における脂肪滴の蓄積が顕著に抑制されることが示された。さらに、詳細な解析を行い、BmFATPの発現をノックダウンすると脂肪滴トリアシルグリセロールの合成が阻害され、BODIPY 500/510 C1, C12 (Molecular Probes # D3823)を用いた長鎖脂肪酸の取り込み実験やトリチウム標識したパルミチン酸、オレイン酸を用いた脂肪酸アシル-CoA合成酵素fatty acyl-CoA synthetase (ACS)活性を調べることで、BmFATPが細胞外からの必須脂肪酸の取り込みとその脂肪酸アシル-CoAへの変換を促進することで脂肪滴の蓄積に関わっていることが明らかとなった(図2)[3]。
PBAN刺激により活性化されるボンビコール生合成過程は、ボンビコール前駆体の貯蔵体である脂肪滴のリポリシスおよび切り出されたボンビコール前駆体を還元してボンビコールに変換する過程である。そこで、PBAN刺激が機能分子のリン酸化を介してこれらの過程を活性化するのかどうかを検証する目的で、PBAN刺激に伴ってリン酸化されるタンパク質の検索を行った結果、少なくとも5種類のタンパク質がPBAN刺激に伴ってリン酸化され、そのうちのひとつは脂肪滴表面に局在するタンパク質で、リン酸化されることで脂肪滴のリポリシスを促進することが明らかとなった。これとは別に、フェロモン腺選択的に発現するfatty acid transport protein (BmFATP)をRNAiによりノックダウンすると、羽化前における脂肪滴の蓄積が顕著に抑制されることが示された。さらに、詳細な解析を行い、BmFATPの発現をノックダウンすると脂肪滴トリアシルグリセロールの合成が阻害され、BODIPY 500/510 C1, C12 (Molecular Probes # D3823)を用いた長鎖脂肪酸の取り込み実験やトリチウム標識したパルミチン酸、オレイン酸を用いた脂肪酸アシル-CoA合成酵素fatty acyl-CoA synthetase (ACS)活性を調べることで、BmFATPが細胞外からの必須脂肪酸の取り込みとその脂肪酸アシル-CoAへの変換を促進することで脂肪滴の蓄積に関わっていることが明らかとなった(図2)[3]。
参考文献
[1] Ohnishi A., Hull J. J., and Matsumoto S., Proc. Natl. Acad. Sci. USA., 103, 4398-4403 (2006).
[2] Hull J. J., Lee J. M., Kajigaya R., and Matsumoto S., J. Biol. Chem., 284, 31200-31213 (2009).
[3] Ohnishi A., Hashimoto K., Imai K., and Matsumoto S., J. Biol. Chem., 284, 5128-5136 (2009).
性フェロモン産生に関わる遺伝子解析
研究目的
ガ類昆虫は複数からなる脂質化合物をブレンドし、その割合を厳密に規定することにより種固有の性フェロモンを作り出している。その性フェロモン産生系においてはリ ポジェネシスやリポリシス、脂質の細胞内への取り込みや細胞内輸送、細胞 外への放出など、未解明な点の多い脂質生物学の重要課題を数多く含むことから、これに関わる機能分子の解明を目的としてカイコガ (Bombyx mori)ESTデータベースを解析した。その結果、これまでにフェロモ ン腺由来の312個の独立ESTクローンを見出し、さらに脂肪酸不飽和化酵素 (Desat1)およびアシル基還元酵素(pgFAR)がフェロモン成分の生合成、およびフェロモンブレンドの成分比決定において重要な役割を担っていることを明らかにした。一方、上記2酵素遺伝子を除くほとんどのESTクローンに ついては機能不明であり、また性フェロモン産生との関連性もあきらかでは ない。そこで本研究では、トランスジェニック系を利用したカイコガフェロモン腺での遺伝子解析系の構築、およびその系を利用したフェロモン産生関連遺伝子の機能解析への応用を目的とした。
研究成果
1) 性フェロモン産生関連遺伝子の選抜
性フェロモン産生に関わる遺伝子は、desatやpgFARのようにフェロモン腺で組織特異的に発現している可能性が高いと考えられる。カイコガのEST データベースでは(Silkbase: http://silkbase.ab.a.u-tokyo.ac.jp/cgi-bin/index.cgi)では、19種類の様々な組織に由来するcDNAライブラリー別にESTクローンが登録されており、フェロモン腺由来の独立クローンは312個あった。そこで、①全cDNAライブラリーに対してフェロモン腺cDNAライブラリーに由来するESTクローン数が60%以上占めるもの、および②相同性検索結果からフェロモン産生に関与している可能性の高いESTクローンの計88選択し、RT-PCRによる組織特異的発現解析を行った。その結果、 フェロモン腺で発現が確認された遺伝子は67クローンあり、そのうちフェ ロモン腺で特異的あるいは優先的に発現していた遺伝子は25クローンであることが分かった。さらに、時期特異的発現解析を行った結果、desat1やpgFARと同様に羽化直前に転写レベルが上昇するクローンが14個あることが分かった。これらのORF 全長の配列を決定し、改めてBLAST解析を行った結果、フェロモン前駆体脂肪酸をトリアシルグリセロールから遊離させると予想される3種類のリパーゼや、フェロモンあるいはその前駆体の輸送に関わると予想されるケモセンサリープロテイン、フェロモン前駆体脂肪酸の脂肪滴での貯蔵や分解に関与すると予想されるLSDP(Lipid storage droplet protein)などが明らかとなった。
2)フェロモン腺特異的遺伝子解析系に適した遺伝子プロモーターのスクリーニング
 desat1、pgFAR、pgACBPの3種類の遺伝子はいずれもカイコガのフェロモン腺において組織特異的に発現する。したがって、これらの遺伝子プロモーターとトランスジェニック系を利用することにより、カイコガ個体におけるフェロモン腺特異的な遺伝子解析系(例えば、標的遺伝子をGFP融合タンパク質としてフェロモン腺特異的に発現させる実験系や、フェロモン腺特異的に標的遺伝子 をノックダウンする実験系など)が実現可能となる。そこで、カイコガゲノムライブラリーから得たカイコガフェロモン腺特異的遺伝子desat1、pgFAR、pgACBPのそれぞれの上流領域と、GFPレポーター遺伝子、およびSV40ターミネーター からなる3種類の遺伝子発現カセットを作製した。さらにトランスポゾンpiggyBacを利用し、これらを各々ゲノムに持つトランスジェニックカイコガを作成した結果、3種類のうち、desat1プロモーターでGFPをドライブした場合でのみ、成虫雌のフェロモン腺で組織特異的なGFPの発現を確認した。すなわち、このdesat1プロモーターを含むDNA配列を利用することにより、カイコガ個体でのフェロモン腺特異的な遺伝子解析系が行えることが明らかとなった。
desat1、pgFAR、pgACBPの3種類の遺伝子はいずれもカイコガのフェロモン腺において組織特異的に発現する。したがって、これらの遺伝子プロモーターとトランスジェニック系を利用することにより、カイコガ個体におけるフェロモン腺特異的な遺伝子解析系(例えば、標的遺伝子をGFP融合タンパク質としてフェロモン腺特異的に発現させる実験系や、フェロモン腺特異的に標的遺伝子 をノックダウンする実験系など)が実現可能となる。そこで、カイコガゲノムライブラリーから得たカイコガフェロモン腺特異的遺伝子desat1、pgFAR、pgACBPのそれぞれの上流領域と、GFPレポーター遺伝子、およびSV40ターミネーター からなる3種類の遺伝子発現カセットを作製した。さらにトランスポゾンpiggyBacを利用し、これらを各々ゲノムに持つトランスジェニックカイコガを作成した結果、3種類のうち、desat1プロモーターでGFPをドライブした場合でのみ、成虫雌のフェロモン腺で組織特異的なGFPの発現を確認した。すなわち、このdesat1プロモーターを含むDNA配列を利用することにより、カイコガ個体でのフェロモン腺特異的な遺伝子解析系が行えることが明らかとなった。
3) カイコガLSDPホモログのフェロモン腺細胞内での局在
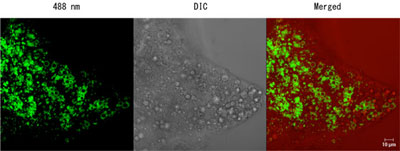 カイコガのフェロモン腺細胞では、脂肪細胞と同様に脂肪滴が無数に存在し、その構成成分であるトリアシルグリセロール中にはエネルギー源となる人工飼料(クワの葉や大豆など)由来のオレイン酸やリノレン酸の他に、性フェロモン成分の前駆体脂肪酸が多く含まれていることが分かっている。また、羽化直後に食道下神経節から体液中に放出されるフェロモン生合成活性化神経ペプチド(PBAN)がフェロモン腺細胞表面に存在するPBAN受容体を刺激すると、脂肪滴が分解され、トリアシルグリセロールから前駆体脂肪酸から切り出されるが、そのメカニズムの詳細は不明である。そこで手始めとして、他の動物で脂肪滴表面に局在することが知られているLSDPのカイコガホモログをGFP融合蛋白質としてトランスジェニックカイコガで発現させた。その結果、カイコガフェロモン腺細胞においてLSDPが脂肪滴表面に局在することが明らかとなった。また、PBAN刺激前に比べ、PBAN刺激後の方がより多くのLSDPが局在する傾向が見られた。
カイコガのフェロモン腺細胞では、脂肪細胞と同様に脂肪滴が無数に存在し、その構成成分であるトリアシルグリセロール中にはエネルギー源となる人工飼料(クワの葉や大豆など)由来のオレイン酸やリノレン酸の他に、性フェロモン成分の前駆体脂肪酸が多く含まれていることが分かっている。また、羽化直後に食道下神経節から体液中に放出されるフェロモン生合成活性化神経ペプチド(PBAN)がフェロモン腺細胞表面に存在するPBAN受容体を刺激すると、脂肪滴が分解され、トリアシルグリセロールから前駆体脂肪酸から切り出されるが、そのメカニズムの詳細は不明である。そこで手始めとして、他の動物で脂肪滴表面に局在することが知られているLSDPのカイコガホモログをGFP融合蛋白質としてトランスジェニックカイコガで発現させた。その結果、カイコガフェロモン腺細胞においてLSDPが脂肪滴表面に局在することが明らかとなった。また、PBAN刺激前に比べ、PBAN刺激後の方がより多くのLSDPが局在する傾向が見られた。
参考文献
[1] Matsumoto S., Hull J. J., Ohnishi A., Moto K., and Fonagy A. (2007) Molecular mechanisms underlying sex pheromone production in the silkmoth, Bombyx mori: characterization of the molecular components involved in bombykol biosynthesis. J Insect Physiol. 53, 752-759.
バキュロウイルスによる感染細胞核の改変に関する研究
研究目的
近年、細胞核には多種多様な核ドメインが存在し、それらが細胞核機能と密接に関連していることが明らかになりつつある。細胞核には細胞質のような脂質膜で囲まれた細胞内小器官は存在せず、核ドメインは常に集合と離散を繰り返す分子集合体として存在する。その構造と機能の解明は、遺伝子の転写、複製、損傷修復、組換えといった基本的な生命活動を支える核内環境の理解に必須であるが、その多くが未解明のままである。一方、昆虫ウイルスであるバキュロウイルスはその増殖過程の大半が細胞核で進行する。現在、私達はバキュロウイルス(BmNPV)の全136遺伝子の細胞内局在解析プロジェクトを進行中であるが、これまでに解析した多くのウイルスタンパク質は、新たな核ドメインを形成し、それぞれの核ドメインでDNA複製、転写、ウイルス粒子形成、核内ウイルス膜合成等の様々な機能に関与していることが示唆されている。本研究は、バキュロウイルスが誘起する細胞核ドメインの構造と機能を精査し、正常細胞に存在する核ドメインの形成、維持機構解明の端緒とすると共に、ウイルス感染により既存の細胞核構造がどのように改変されるのかを解明することを目的とした。
研究成果
1)3種のvirogenic stroma構成因子IE1/LEF3/P143の相互作用による核内構造体形成
以前からバキュロウイルス感染細胞の電子顕微鏡観察により、タンパク質の殻であるウイルスキャプシドはvirogenic stromaと呼ばれる電子密度の高い領域で形成され、その周囲でウイルス膜が合成されることが明らかにされていた。私たちはライブイメージング観察によって、ウイルスDNAの合成領域であるIE1局在領域がvirogenic stromaであることを示し、更に、感染初期のIE1の点状分布にはウイルスDNA複製開始点であるhrが必要なことを明らかにして、それらの結果を基に、細胞内に進入してきたウイルスゲノム上のhrと最初期に発現したIE1とが結合することによってvirogenic stromaの形成が開始されるというモデルを提案してきた[1]。そこで次に、IE1点状分布後の更なるvirogenic stroma形成過程を明らかにするため、ウイルスDNA複製因子の一つ、LEF3がIE1点状構造に局在するためのウイルス因子を探索した。その結果、LEF3は、IE1及び他のウイルスDNA複製因子P143と協調して、hrに依存した新規の核内構造体(IE1/LEF3/P143構造体)を非感染細胞内に形成することが明らかになった[2]。この結果はIE1/LEF3/P143構造体がvirogenic stroma の構造基盤であることを示唆し、また、IE1/LEF3/P143のどのタンパク質が欠けても構造は形成されないことから3種間の相互作用が構造体形成に大変重要であることが分かった。
2)ウイルスが生成する核内構造体と宿主クロマチンの相互排除
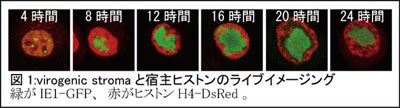 次に、virogenic stromaのようなウイルスが誘起する核内構造体が形成された際、もともと存在していた宿主細胞の核内構造がどのように変化するのかを調べるため、細胞核の主要な構成成分であるクロマチンの動態を、蛍光タンパク質を融合したヒストンH4のライブイメージング観察によって解析した[3]。その結果、ウイルスDNA合成が開始する感染後8時間以降、IE1構造体すなわちvirogenic stromaの拡大に伴いクロマチンがvirogenic stromaに排除されて次第に核周縁部に移動させられ、感染後16時間には核全体がvirogenic stromaで満たされたような状態となることが分かった(図1)。感染16時間以降はvirogenic stromaとクロマチンの間に間隙が形成され始め、何か別の構造体の存在が示唆された。virogenic stromaの周囲ではウイルス膜合成が進行することから、3種のウイルス膜タンパク質P91、 ODV-E25及びP74の局在を調べたところ、いずれの膜タンパク質も感染後16時間ぐらいからvirogenic stromaとクロマチンの間隙に局在することが明らかとなり、virogenic stromaの周縁部、peristromal regionもvirogenic stroma同様クロマチン排除能を有し、明確な輪郭をもった核内構造体であることが判明した。クロマチン、virogenic stroma、peristromal regionはそれぞれ互いに密着していながら決して重なりあうことがないことから、それぞれの構造維持にこの相互排除機構が重要な役割を果たしている可能性が考えられた。
次に、virogenic stromaのようなウイルスが誘起する核内構造体が形成された際、もともと存在していた宿主細胞の核内構造がどのように変化するのかを調べるため、細胞核の主要な構成成分であるクロマチンの動態を、蛍光タンパク質を融合したヒストンH4のライブイメージング観察によって解析した[3]。その結果、ウイルスDNA合成が開始する感染後8時間以降、IE1構造体すなわちvirogenic stromaの拡大に伴いクロマチンがvirogenic stromaに排除されて次第に核周縁部に移動させられ、感染後16時間には核全体がvirogenic stromaで満たされたような状態となることが分かった(図1)。感染16時間以降はvirogenic stromaとクロマチンの間に間隙が形成され始め、何か別の構造体の存在が示唆された。virogenic stromaの周囲ではウイルス膜合成が進行することから、3種のウイルス膜タンパク質P91、 ODV-E25及びP74の局在を調べたところ、いずれの膜タンパク質も感染後16時間ぐらいからvirogenic stromaとクロマチンの間隙に局在することが明らかとなり、virogenic stromaの周縁部、peristromal regionもvirogenic stroma同様クロマチン排除能を有し、明確な輪郭をもった核内構造体であることが判明した。クロマチン、virogenic stroma、peristromal regionはそれぞれ互いに密着していながら決して重なりあうことがないことから、それぞれの構造維持にこの相互排除機構が重要な役割を果たしている可能性が考えられた。
3)宿主クロマチンとの相互排除に基づく核内構造体形成機構モデル
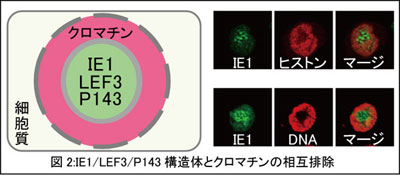 virogenic stromaがクロマチン排除能を有することが明らかとなったことから、その構造基盤であるIE1/LEF3/P143構造体と宿主クロマチンとの関係について次に 解析を行った。その結果、IE1/LEF3/P143構造体にもクロマチン排除能があることが分かった[3]。IE1/LEF3/P143構造体の内部は更なる微細な構造体が認められ、IE1/LEF3/P143構造体はそれら微細構造体の集合体のように観察された(図2)。 これまでに提案されている核内構造体形成に関する仮説は哺乳類細胞に存在するPML bodyと呼ばれる構造体の形成に関するもので、 PML bodyの主要な構成成分であるPMLタンパク質がSUMO分子を介してネットワーク構造を形成するというモデルである。タンパク質ネットワーク構造で形成された核内構造体は比較的小さな硬い構造が形成可能で、例えば、バキュロウイルスのIE1点状構造もIE1が形成するネットワーク構造が基盤となっているのかもしれない。一方、IE1/LEF3/P143構造体の形成は微細構造体が集まって見えることから、小さな構造体がクロマチン排除能によって集合して一つの比較的大きな構造体を形成していると考えることができる。核内はもともとクロマチンで満たされており、クロマチン排除能を持った分子集団は、水の中の油のように自然に集まって一つの領域、構造体を形成できる可能性がある。したがって、virogenic stroma、peristromal regionあるいは核小体のような比較的大きな核内構造体はクロマチンとの相互排除機構を利用して、柔軟で且つ動的なタンパク質集合体を形成している可能性がある。
virogenic stromaがクロマチン排除能を有することが明らかとなったことから、その構造基盤であるIE1/LEF3/P143構造体と宿主クロマチンとの関係について次に 解析を行った。その結果、IE1/LEF3/P143構造体にもクロマチン排除能があることが分かった[3]。IE1/LEF3/P143構造体の内部は更なる微細な構造体が認められ、IE1/LEF3/P143構造体はそれら微細構造体の集合体のように観察された(図2)。 これまでに提案されている核内構造体形成に関する仮説は哺乳類細胞に存在するPML bodyと呼ばれる構造体の形成に関するもので、 PML bodyの主要な構成成分であるPMLタンパク質がSUMO分子を介してネットワーク構造を形成するというモデルである。タンパク質ネットワーク構造で形成された核内構造体は比較的小さな硬い構造が形成可能で、例えば、バキュロウイルスのIE1点状構造もIE1が形成するネットワーク構造が基盤となっているのかもしれない。一方、IE1/LEF3/P143構造体の形成は微細構造体が集まって見えることから、小さな構造体がクロマチン排除能によって集合して一つの比較的大きな構造体を形成していると考えることができる。核内はもともとクロマチンで満たされており、クロマチン排除能を持った分子集団は、水の中の油のように自然に集まって一つの領域、構造体を形成できる可能性がある。したがって、virogenic stroma、peristromal regionあるいは核小体のような比較的大きな核内構造体はクロマチンとの相互排除機構を利用して、柔軟で且つ動的なタンパク質集合体を形成している可能性がある。
参考文献
[1] Nagamine, T., Kawasaki, Y., Iizuka, T. & Matsumoto, S., J. Virol. 79, 39-46 (2005).
[2] Nagamine, T., Kawasaki, Y. & Matsumoto, S., Virology 352, 400-407 (2006).
[3] Nagamine, T., Kawasaki, Y., Abe, A. & Matsumoto, S., J. Virol. 82, 6409-6418 (2008).
キイロショウジョウバエを用いた核小体に局在するGTP結合タンパク質の機能解析
研究目的
生物学において古くから核小体の機能に関して解析が行われているが、未だ謎が多く残されている。核小体がリボソームの産生工場であることが発見されて以来、長らくその機能解明が停滞していたものの、近年の解析で細胞分裂や細胞死などに重要な役割を演じていることが明らかになりつつある。当研究室ではショウジョウバエの複眼および翅に異常が見られる変異株より、原因遺伝子としてdngbp1遺伝子を同定した。これまでにDNGBP1タンパク質は核小体に局在するタンパク質であり、個体レベルでも細胞レベルでも生存に必須であることを明らかにし、dngbp1の機能を欠失した変異細胞は速やかに細胞死により組織から排除されることを明らかにした。DNGBP1と最も相同性が高いタンパク質であるヒトNucleostemin (NS)は、p53と直接結合しカスパーゼ依存的に細胞死を制御することが報告され、近年ではp53以外にもさまざまな複合体形成因子が同定されつつある。当該研究担当者は、これまでの研究データによりdngbp1機能欠失による細胞死が哺乳動物の機構と異なる可能性が強いと考えられるデータを得ており、本研究ではdngbp1遺伝子変異による細胞死機構が、哺乳動物と同等の機構により細胞死が制御されているかの検証を行い、Nucleostemin ファミリータンパク質において、キイロショウジョウバエと哺乳動物では制御機構が異なることを明確に示すことを目的としている。また、その細胞死機構の同定を行う事を目的としている。
研究成果
1)dngbp1欠失による細胞死はp53およびカスパーゼ非依存的である。
キイロショウジョウバエではDmp53が活性化された際には致死遺伝子であるreaper(rpr)の転写が行われ、更に下流においてカスパーゼの活性化によりアポトーシスが起こることが明らかにされている。Dmp53による転写調節領域を含むrprプロモーター下流にlacZ遺伝子を持つキイロショウジョウバエをレポーターとして、キイロショウジョウバエ個体内でdngbp1機能欠損組織でのrpr遺伝子の発現を解析した結果、転写亢進は観察されなかった。同組織においてカスパーゼの活性化状態を特異的に認識可能な抗体を用いてカスパーゼの活性化を観察したが、rprと同様に活性化を確認できなかった。更にDNGBP1とDmp53との複合体形成を、免疫沈降法を用いwestern blotting法により検討したが共沈は認められなかった。以上の結果からdngbp1機能欠損による細胞死はp53非依存的、カスパーゼ非依存的であることが示唆された。
2)NS複合体と同様な複合体は観察されない。
ヒトNSではHuman double minute 2(HDM2)およびProtein phosphatase 2A(PP2A) Bサブユニットと複合体を形成することが報告されている。キイロショウジョウバエではHDM2に対する相同タンパク質は見つかっていないので、PP2A, Bサブユニットの相同タンパク質もしくはCサブユニットの相同タンパク質とDNGBP1タンパク質とが複合体を形成するか検証した。キイロショウジョウバエではBサブユニットにPP2A-B’とWiderborstの2種類が属し、CサブユニットにMicrotubule starが属している。これらのタンパク質とDNGBP1とが複合体を形成しているかを、免疫沈降法およびwestern blotting法により検討したが、共沈は認められなかった。以上の結果からDNGBP1とPP2A関連タンパク質群とは複合体を形成しないと示唆され、哺乳動物とキイロショウジョウバエとでは異なる制御機構が存在すると示唆された。
3)Autophagy非依存的な細胞死
キイロショウジョウバエではRNAi法を個体レベルに応用したInverted Repeat(IR)系統がさまざまな解析に利用可能となっている。IR系統では目的遺伝子の遺伝子断片を回帰文(IR)形式で過剰発現することにより、それらの遺伝子を特異的に抑制可能な系統となっている。dngbp1機能欠損によるカスパーゼ非依存的な細胞死を同定すべく、autophagyの関与を検討するために、autophagyに関連する遺伝子のIR系統を入手し、検討を行った。今回Akt1,Atg3,Atg5,Atg7,Atg12を特異的に抑制可能な系統を入手し、キイロショウジョウバエにおいて相互作用を検証する際に用いられる遺伝的相互作用を指標として検証を行った。dngbp1機能欠損により複眼に表現型を顕現させられる系をバックグラウンドとし、autophagy関連遺伝子を更に抑制させ、表現型の変化を観察したが、相互作用を示す結果は得られなかった。これらの結果からdngbp1機能欠損による細胞死にはautophagyは関与していないことが示唆された。
4)Junキナーゼシグナル伝達機構の関与
次ぎにカスパーゼ非依存的な細胞死にJunキナーゼシグナル伝達機構の関与を検討した。キイロショウジョウバエではJunキナーゼの活性化の際にpuckered(puc)遺伝子の発現が亢進する。pucプロモーター下流にlacZ遺伝子が導入された系統がJunキナーゼの活性化を観察可能なマーカーとして利用されている。dngbp1変異組織内でpucの活性化を観察した結果、dngbp1変異とリンクして誘導されていることが観察された。更にJunキナーゼの活性化状態であるリン酸化状態を特異的に認識する抗体を用い、蛍光免疫組織染色法により、同じ領域でJunキナーゼが活性化されていることも観察された。更に高塩濃度のストレス環境でdngbp1抑制個体の致死率の上昇が観察された。
スパーゼ非依存的な細胞死にJunキナーゼシグナル伝達機構の活性化が必須条件となっているかを調べるために、Junキナーゼシグナル伝達経路を強制的に不活性化させられる系統との遺伝的相互作用を検討した。その結果、dngbp1変異による細胞死の表現型をなんら抑圧できず、必須条件ではないことが示された。以上の結果はdngbp1は少なくとも個体レベルでの役割としてストレス防御に携わることが示唆された。しかし、dngbp1機能欠損による細胞死においてJunキナーゼシグナル伝達経路は細胞死のトリガーとして必須ではないことが示唆された。
参考文献
[1] Matsuo E., Matsumoto S., and Tsuneizumi K.: “Drosophila Nucleostemin 2 is essential for early eye development and cell survival”., Biosci. Biotechnol. Biochem., 74, 2120-2123 (2010).
mRNPの細胞内局在と調節に関する研究
研究目的
高等真核細胞の遺伝子発現においてはDNAの遺伝情報がmRNAに転写された後の制御が、これまで考えられていたよりも重要であることが明らかになってきた。mRNAの翻訳や安定性の調節には、そのmRNAの配列(シスエレメント)およびmRNAに結合している蛋白質(トランス因子)が重要な役割を担っている。mRNA-蛋白質複合体を一般にmRNPとよぶが、細胞内でのmRNAは裸の状態でなく、つねにmRNP構造をとっている。つまり、あるmRNAにどのような蛋白質が結合してmRNPを構成するか、を明らかにすることでmRNAの活性調節機構にせまることができると考えられる。一方で最近、mRNPを構成する蛋白質の多くが、細胞質で顆粒状の構造に局在することが観察されている。本研究では、これまでに我々が同定および生化学的に解析してきたいくつかのmRNP構成因子をプローブあるいはマーカーとして用いて、mRNPの細胞内局在の変化と、それに伴って翻訳や安定性がどのように制御されるかを明らかにすることを目的とした。
研究成果
(i) アフリカツメガエル卵毋細胞のmRNP構成因子の同定
アフリカツメガエル卵毋細胞の貯蔵mRNPを構成する主要な蛋白質であるYボックス蛋白質FRGY2は、結合するmRNAの翻訳抑制に関与することが知られている。われわれは、卵毋細胞にFLAG-FRGY2を発現させ、抗FLAG抗体で免疫沈降を行ってmRNP構成因子の同定を行った。胚特異的poly(A)結合蛋白質、DEAD-box ATPaseであるXp54、eIF4E輸送因子4E-T等これまでmRNP因子として知られているもののほか、xRAP55とP100を同定した[1]。
(ii) xRAP55の解析
xRAP55の解析を進めるため、cDNAクローニングを行い、抗体を作製した。xRAP55はサンショウウオで報告されているRAP55と高い相同性を示し、N末にSm-likeドメイン、C末にRGG配列を複数持つRNA結合蛋白質である。xRAP55は細胞質に局在した。この蛋白質は卵母細胞の成長と共に蓄積し、初期発生を通じて存在する。またUVクロスリンクによりRNAと直接結合すること、密度勾配遠心ではmRNP画分に存在することから、xRAP55はmRNP構成因子であると考えられた。卵毋細胞内でこの蛋白質がmRNPの取り込まれるために必要な領域を同定するため、mRNAをマイクロインジェクションすることで欠失変異体を発現させた。その結果、C末のRGGドメインが必要十分であることが明らかになった。次に、xRAP55の機能解析を行った。xRAP55は無細胞翻訳系での翻訳を抑制した。一方、卵母細胞にxRAP55を高発現しても全体としては蛋白質合成に影響は見られなかった。そこでタグをつけたレポーターmRNAと、そのタグに結合する蛋白質と融合させたxRAP55を卵毋細胞に発現させたところ、そのレポーターmRNAの翻訳を抑制した。我々の実験結果は、xRAP55が 卵母細胞でのmRNPの構成因子として母性mRNAの翻訳抑制に深く関わっていることを示唆するものである[1]。
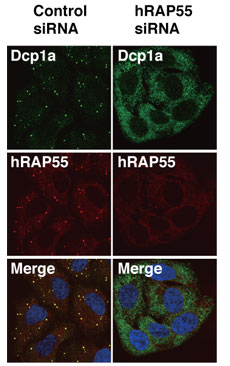
(iii) RAP55の局在RAP55蛋白質の、ヒト培養細胞での局在を検討した。抗RAP55抗体で免疫染色を行うと、細胞質全体に局在する他、細胞質に一つの細胞あたり数個の点状に強い局在が見られた。RAP55はこれらの点状構造において、mRNAの分解に関わる脱キャップ酵素Dcp1aや他のmRNP構成因子RCK、翻訳開始因子eIF4Eなどと共局在を示した。これより、これらの構造はプロセシングボディ(P-body)と呼ばれる、mRNP顆粒であることがわかった。また、RAP55は細胞に高温ストレスを与えたときなどに細胞質に形成されるストレス顆粒にも局在した。ストレス顆粒は、ストレスを受けた細胞において多くのmRNAが一時的に翻訳抑制されてたまっている場、と考えられている。つまりこれらの知見は、カエル卵毋細胞や無細胞系でRAP55が翻訳を抑制するというこれまでの結果を支持するものである。small interfering RNAによってRAP55蛋白質のノックダウンをおこなうとDcp1aなどで観察できるP-bodyが消失することから、RAP55はP-body形成に必須であると考えられた(図)。 RAP55蛋白質の、P-body局在や翻訳抑制に重要なドメイン構造の同定をおこなった。RAP55はN-末端にSm-likeドメインとセリンとスレオニンに富んだドメインを持ち、C末にRGG配列に富んだドメインとFDFドメインを持つ。Sm-likeドメインとFDFドメインはRAP55を含む蛋白質ファミリーに保存された領域である。カエル卵毋細胞での翻訳抑制にはN末領域が必要十分であった。また、P-bodyへの局在にはN末のSm-likeドメインおよびC末領域が重要であることがわかった[1]。 |
 |
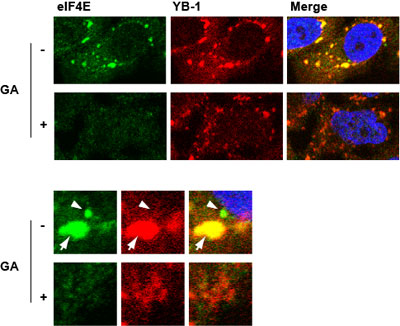
(iv) 分子シャペロンHsp90のmRNP顆粒形成への関与mRNP構成因子の免疫染色を行うと、多くの因子が細胞質で顆粒状に観察される [2]。これらのmRNP顆粒は、複数のmRNPがその構成因子同士の親和性によって集合したaggregateと考えられる。分子シャペロンHsp90が顆粒形成に関わっている可能性を検討したところ、Hsp90阻害剤のゲルダナマイシン(GA)処理によって、P-bodyが顕著に減少することがわかった。一方、細胞にストレスを与えた場合に出現するストレス顆粒についてみると、形成はおきるが、サイズや細胞質での分布及びその構成因子に影響があることを見出した(図、矢じりがP-body、矢印はストレス顆粒)。更に、翻訳開始因子eIF4E、eIF4G や4E-Tが Hsp90のクライアントである可能性が示唆された [3]。 |
 |
参考文献
[1] K. J. Tanaka, K. Ogawa, M. Takagi, N. Imamoto, K. Matsumoto, and M. Tsujimoto, J. Biol. Chem. 281, 40096-40106 (2006).
[2] H. Kawahara, T. Imai, H. Imataka, M. Tsujimoto, K. Matsumoto, and H. Okano, J. Cell Biol. 181, 639-653 (2008).
[3] Y. Suzuki, M. Minami, M. Suzuki, K. Abe, S. Zenno, M. Tsujimoto, K. Matsumoto, and Y. Minami, J. Biol. Chem. 284, 35597-35604 (2009).



