要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター生体機能評価研究チームの尾上浩隆チームリーダー、宿里充穂客員研究員(研究当時、現 昭和薬科大学助教)、標識化学研究チームの土居久志チームリーダー、馬渡彩リサーチアソシエイトらの研究チームは、神経炎症に関わる酵素COX-1[1]を高感度で検出するPETプローブ[2]を開発し、アルツハイマー型認知症モデルマウスの神経変性の進行にCOX-1が関与する様子を可視化することに成功しました。
神経変性疾患[3]の1つであるアルツハイマー型認知症では、神経炎症が発症のプロセスに強く関与すると考えられています。また、一部の非ステロイド系抗炎症薬[4]がアルツハイマー型認知症の予防や治療に効果を示す可能性が、動物モデルや臨床研究で報告されています。これらの抗炎症薬は、発熱や炎症の原因となる酵素シクロオキシゲナーゼ(Cyclooxygenase、COX)の働きを抑える作用があります。しかし、アルツハイマー型認知症とCOXの関係はまだ十分に分かっていません。COXには、正常時にも一定量発現しているCOX-1と、免疫反応や炎症刺激によって誘導されるCOX-2の2つのタイプがあります。これまで研究チームは、COX-1に対して強い阻害効果を示す非ステロイド系抗炎症薬ケトプロフェン(KTP)[5]を基にしたPETプローブの(RS)-11C-KTPメチルエステル((RS)-11C-KTP-Me)を開発し、急性の脳内炎症を生じたラットで、脳内のミクログリア[6]に存在するCOX-1が炎症に関係していることを明らかにしてきました。
今回研究チームは、アルツハイマー型認知症をはじめとする神経変性疾患の脳で生じる、より微細なCOX-1の変化を検出するために、検出感度が高いPETプローブである「(S)-11C-KTP-Me」を開発し、アルツハイマー型認知症モデルマウスでの加齢に伴う症状の進行とCOX-1の変化の関係を調べました。オートラジオグラフィー[7]により脳内でのシグナルを詳しく検証した結果、16~24カ月齢で(S)-11C-KTP-Meの有意な脳内シグナルの集積がみられ、この変化は、組織病理学的所見で確認されたAβ(アミロイドベータ)プラーク[8]の増加、およびミクログリア活性化の増大と一致していました。この集積は特に大脳皮質や海馬で著しく、この領域では大規模でより強いAβプラークの存在と、その周りを、COX-1を発現する活性化ミクログリアが取り囲んでいる像が観察されました。
今回アルツハイマー型認知症モデルマウスの神経炎症にCOX-1が関与していることを明らかにしたことで、今後COX-1のPETイメージング技術がヒトのアルツハイマー型認知症における脳内炎症の病態、進行度を評価するための新たなバイオマーカー[9]として活用することが期待できます。
本研究は、文部科学省委託事業『分子イメージング研究戦略推進プログラム』、『分子イメージング研究プログラム』、『再生医療ネットワークプログラム』により実施されました。
成果は、米国の科学雑誌『The Journal of Nuclear Medicine』(2月号)に掲載されました。
背景
アルツハイマー型認知症やパーキンソン病などの神経変性疾患は、患者数が増加の一途をたどっており、その予防、診断、治療法の開発が急務となっています。神経変性疾患の多くは、脳内の炎症が原因で起こっていることが報告されており、アルツハイマー型認知症でも、脳内炎症が発症のプロセスに強く関与すると考えられています。近年、一部の非ステロイド系抗炎症薬にアルツハイマー型認知症の予防や治療効果があることが報告されています。しかし、この抗炎症薬のターゲットであるシクロオキシゲナーゼ(Cyclooxygenase、COX)と神経変性疾患の関係はまだ十分にわかっておらず、その効果については議論が続いています。
COXは、炎症原因物質であるプロスタグランジンの生成酵素として、炎症の発現、調節に重要な役割を担っています。このCOXには恒常的に細胞内に発現しているCOX-1と、サイトカインなどの刺激によって発現が誘導されるCOX-2の2つのタイプが存在し、これまで免疫反応や炎症には誘導型のCOX-2が重要と言われてきました。一方で、研究チームはCOX-1に対して強い阻害効果を示す薬剤ケトプロフェン(KTP)の誘導体を炭素の放射性同位体(炭素11:11C)で標識したPETプローブの(RS)-11C-KTPメチルエステル((RS)-11C-KTP-Me)を開発し、生体内において実際に脳で起こっている炎症には、ミクログリアに存在するCOX-1が重要であることを明らかにしました注1)。そこで本研究では、アルツハイマー型認知症のモデルマウスにおいて、加齢による症状の進行とCOX-1の変化の関係を調べました。
注1)2011年6月17日プレスリリース「脳内炎症の発症の仕組みを解く酵素COX-1のライブイメージングに成功」
研究手法と成果
脳内炎症は、ウイルス感染などが引き金となる場合は急性の免疫反応の1つとして生じます。しかし、神経変性疾患の脳で起こる炎症は、Aβタンパク質などの異常な蓄積による微細な変化が原因だと考えられます。この微細な変化を検出するために、研究チームはまず、従来のラセミ体[10](RS体、等量の光学異性体[10]を含む)よりも3倍程度COX-1に対する阻害活性が高いS体を用いた(S)-11C-KTP-Meを開発しました。炎症を引き起こす薬剤リポポリサッカライド(LPS)をラットの脳の線条体[11]に局所注入した脳内炎症モデルで検討した結果、(S)-11C-KTP-Meは(RS)-11C-KTP-Meと比べて、より多く炎症部位に集積することがPET撮像により確認できました(図1)。
次に、Aβプラーク形成の進行とCOX-1の発現の変化を明らかにするために、アミロイド前駆体タンパク質(APP)が過剰発現するトランスジェニックマウス[12](APP-Tg)を用いて、(S)-11C-KTP-Meのシグナルの変化を観察しました。このマウスは、アルツハイマー型認知症の疾患モデルです。さまざまな月齢のマウスに(S)-11C-KTP-Meを注入した後、脳を取り出し、オートラジオグラフィー実験で詳しく観察を行った結果、16~24カ月齢にかけて大脳皮質や海馬など脳内のさまざまな領域で(S)-11C-KTP-Meの集積の増加が認められました(図2)。また、免疫組織化学的実験の結果、同時期にAβプラークの形成が著しく進行し、大きく強く染色されるAβプラークの周りを、COX-1を発現する活性化ミクログリアが取り囲んでいる様子が観察されました(図3)。
今後の期待
今回、COX-1に対して選択的かつ高感度のPETプローブ、(S)-11C-KTP-Meによって、活性化ミクログリアに発現するCOX-1がAβプラーク形成の進行と密接に関係していることが明らかになりました。最近、モデルマウスを用いた実験で、COX-1選択的な阻害剤の投与が脳内炎症を抑制し、Aβプラークの蓄積を抑えるとともに、認知機能の障害も改善させることも報告されています注2)。
今後、アルツハイマー型認知症における脳内炎症のPET診断に、(S)-11C-KTP-Meを応用することや、脳内炎症のバイオマーカーとしてCOX-1を用いる治療薬の開発の可能性が期待できます。
注2)Choi SH, Aid S, Caracciolo L, et al. Cyclooxygenase-1 inhibition reduces amyloid pathology and improves memory deficits in a mouse model of Alzheimer's disease. J. Neurochem. 2013;124:59-68.
原論文情報
- Miho Shukuri, Aya Mawatari, Masahiro Ohno, Masaaki Suzuki, Hisashi Doi, Yasuyoshi Watanabe, & Hirotaka Onoe, "Detection of cyclooxygenase-1 in activated microglia during amyloid plaque progression: PET studies in Alzheimer’s disease model mice", The Journal of Nuclear Medicine, doi: 10.2967/jnumed.115.166116
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング機能研究グループ 生体機能評価研究チーム
チームリーダー 尾上 浩隆(おのえ ひろたか)
客員研究員(研究当時) 宿里 充穂(しゅくり みほ)
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング化学研究グループ 標識化学研究チーム
チームリーダー 土居 久志(どい ひさし)
リサーチアソシエイト 馬渡 彩(まわたり あや)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.COX-1
アラキドン酸からプロスタグランジンを生成する酵素。プロスタグランジンは、発熱や炎症、痛みの原因となることから、COXの働きがこれらの症状を調節していると考えられている。主にCOX-1とCOX-2の2つのアイソザイム(生体内で同じ反応を触媒するが、化学構造が異なる酵素)が知られている。COX-1は全身の組織に広く存在することから恒常型、COX-2は炎症に伴って発現することから誘導型と称されることが多い。脳内ではCOX-1、COX-2がともに発現しているが、活性化したミクログリアはCOX-1のみを発現しCOX-2を発現していないことが確認されている。 - 2.PETプローブ
陽電子放射断層画像法(Positron Emission Tomography;PET)は、ごく微量の放射線を出す放射性核種を薬などの分子に組み込み、そこから出る放射線を測定することでその分子の体内分布を見る方法。PETで用いる陽電子を放出する11Cや18Fなどを組み込んだ薬剤をPETプローブという。生体内に投与して生じる対消滅ガンマ線を計測することで、PETプローブの分布や動きを生体外から定量的に捉えることができる。 - 3.神経変性疾患
神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。アルツハイマー型認知症やパーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。 - 4.非ステロイド性抗炎症薬
NSAIDsとも呼ばれる。解熱、鎮痛、抗炎症効果を示すステロイド以外の薬剤を示し、一般医薬品として広く知られているアスピリンやイブプロフェン、インドメタシン、ジクロフェナクなどが代表的。これらの薬理作用は、COX阻害に基づくことが明らかとなっており、COX-1、COX-2に対する阻害活性が異なるさまざまな薬剤が存在する。疫学調査では、NSAIDsを常用している患者には、アルツハイマー病やパーキンソン病のリスクが低いことが報告されるなど、炎症以外に神経変性疾患との関わりについても注目されている。 - 5.ケトプロフェン
非ステロイド性抗炎症薬の1種。内服薬や軟膏として用いられている。不斉炭素原子を持つため鏡像異性体(光学異性体)が存在するが、医薬品としてはラセミ体([10]を参照)で使用されている。研究チームが先行研究で使用した( RS)-11C-ケトプロフェンメチルエステル(( RS)-11C-KTP-Me)も、ラセミ体をもとにしたPETプローブである。 - 6.ミクログリア
脳や脊髄など、中枢神経系に存在する神経細胞以外の部分(グリア)を構成する細胞の1種。中枢神経系における免疫担当細胞であると考えられ、神経細胞の損傷、細菌や毒素などの外部刺激を素早く探知して活性化されることが知られている。活性化ミクログリアは、障害細胞の除去を行う貪食作用を示すが、その効果は神経に対して善玉にも悪玉にも働く場合がある。 - 7.オートラジオグラフィー
放射線を出す物質の分布や量を画像化する手法の1つ。PETプローブに用いた放射性同位体が減衰する前に組織切片を作製し、放射線で感光するフィルムに密着させることで、PETプローブの組織内の蓄積を詳細に観察することができる。 - 8.Aβプラーク
Aβ(アミロイドベータ)は、40~43個のアミノ酸が連なってできたペプチド(タンパク質断片)である。アミロイド前駆体タンパク質(APP)が、βセクレターゼやγセクレターゼと呼ばれる酵素によって切断されることで生じる。アルツハイマー病では、脳内のAβが凝集して線維状(Aβプラーク)になり、脳に沈着することが良く知られている。 - 9.バイオマーカー
病気の状態や変化、または治療の効果を客観的・定量的に判定するための指標。コレステロール値や血圧などの数値情報のほか、PET画像をイメージング・バイオマーカーとして用いることもある。 - 10.光学異性体、ラセミ体
立体化学において、不斉炭素原子を持つため、互いに鏡像の関係にあり、重ね合わせることのできない構造を光学異性体、または鏡像異性体という。密度、沸点、融点などの物理的性質や分子の対称性に無関係な化学的性質は同じである。旋光性を持ち、 S体と R体のように記述される。ラセミ体( RS体)は光学異性体を等量含み、全体として旋光性を示さない物質のことである。 - 11.線条体
大脳基底核の主要構成要素の1つで、被殻と尾状核から成る。神経回路における大脳皮質からの入力を担い、運動機能、学習や記憶などさまざまな機能に関与する。 - 12.トランスジェニックマウス
遺伝子操作により、目的の分子の発現を人為的に制御したマウスの総称。
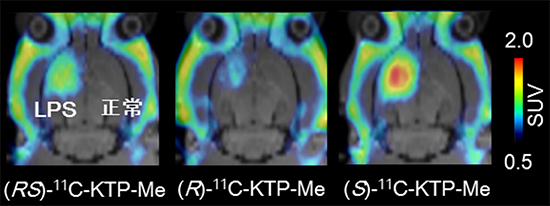
図1 LPS脳内注入ラットにおける11C-KTP-Meの光学異性体のPETイメージング
炎症を引き起こす薬剤ポポリサッカライド(LPS)をラットの脳の線条体に局所注入し、PETプローブ11C-KTP-Meのラセミ体(RS体)と光学異性体(R体とS体)のPETイメージングを比較した。脳の解剖的な位置を示すため、磁気共鳴画像(MRI)を重ねて表示している。眼球の位置の水平断層図で、上が前側、下が後側を示す。(S)-11C-KTP-Meによるイメージング(右写真)は、RS体(左写真)やR体(中央写真)の11C-KTP-Meによるイメージングと比べて、LPS誘発の脳内炎症に高い集積を示した。また、光学異性体S体の炎症への集積の強さは、in vitroで評価したCOXに対する阻害活性の強さとよく一致していた。
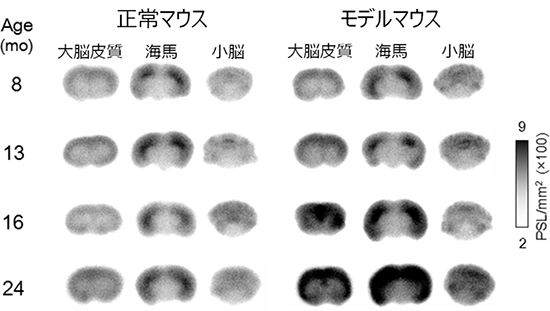
図2 アルツハイマー型認知症モデルマウスの脳におけるオートラジオグラフィー像
正常マウス脳とアルツハイマー型認知症モデルマウス(APP-Tg)脳へのPETプローブ(S)-11C-KTP-Meの集積の様子。各個体の写真はそれぞれ、左から大脳皮質、海馬、小脳の位置の垂直断層像を示す。APP-Tgは、16~24カ月齢にかけて、大脳皮質や海馬で有意な増加(黒く見える部分)を示した。
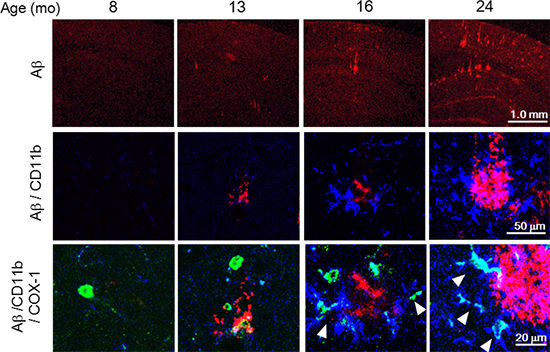
図3 アルツハイマー型認知症モデルマウス脳におけるAβプラーク形成と活性化ミクログリア
アルツハイマー型認知症モデルマウス脳の海馬に生じたAβプラーク形成と、COX-1を発現する活性化ミクログリアの継時変化を示す。
上段:Aβプラークの蓄積(赤)は、16カ月齢で顕著になり、加齢に伴い増加し、大きな凝集体が現れる。
中段:CD11b(ミクログリアのマーカータンパク質)が陽性の活性化ミクログリア(青)は、Aβの凝集体(赤)を取り囲むように存在するようになり、どちらも加齢に伴い増加する。
下段:中段の画像を拡大してみると、活性化ミクログリア(青)がCOX-1(緑)を共発現している(△で指している部分)。COX-1は、加齢によるAβプラークの形成に伴って増加していることが分かる。
