要旨
理化学研究所(理研)脳科学総合研究センター神経グリア回路研究チームの平瀬肇チームリーダー、大江祐樹研究員らの共同研究グループ※は、マウス脳内のグリコーゲン[1]を正確に可視化する新しい手法を開発し、加齢に伴う脳グリコーゲンの分布変化の可視化に成功しました。
グリコーゲンは、肝臓や筋肉で合成され蓄えられているエネルギーのもととなる多糖[2]で、脳にも貯蔵されていることが知られています。最近では、グリコーゲンは通常時における脳活動のエネルギー源としてだけでなく、記憶の定着という重要な脳活動にも関わることが明らかになってきました。しかし、脳グリコーゲンは微量で分解されやすく、従来の方法では脳グリコーゲンを保存したまま可視化できないため、正確な脳内分布は明らかになっていませんでした。
共同研究グループは、マイクロ波[3]照射装置を使った特殊な固定法により生体内のグリコーゲンを保存し、さらに抗グリコーゲン抗体による免疫組織染色法[4]を用いることで、ミクロレベルからマクロレベルの脳グリコーゲンの分布を可視化することに成功しました。その結果、グリコーゲンは脳の海馬、線条体、大脳皮質浅層、小脳分子層に多く存在し、主にグリア細胞[5]の一種であるアストロサイト[6]に局在することが分かりました。また、アストロサイト内では、細胞体よりもシナプスや血管と接する突起にグリコーゲンが多く蓄積されていました。さらに、若いマウスと老齢のマウスではグリコーゲンの分布が異なることが明らかになりました。
脳グリコーゲンは、記憶の定着などに重要な役割を果たすことが示されており、本成果は、記憶などのプロセスにおける神経細胞とグリア細胞の相互作用の研究に貢献すると考えられます。また、糖疾患と認知症の関連が近年指摘されていますが、今後、加齢に伴う脳グリコーゲンの分布変化とアルツハイマー病に代表される認知症との関連を調べることにより、認知症の発症メカニズムの解明に役立つと期待できます。
本研究は、文部科学省新学術領域研究「グリアアセンブリによる脳機能発現の制御と病態」とHFSP研究グラントの支援により行われました。
本成果は、米国の科学雑誌『GLIA』オンライン版(6月29日付け)に掲載されました。
※共同研究チームグループ
理化学研究所 脳科学総合研究センター 神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
研究員 大江 祐樹(おおえ ゆうき)
徳島大学 医歯薬学研究部
教授 馬場 麻人(ばば おと)
神戸大学 農学部
教授 芦田 均(あしだ ひとし)
京都大学 医学部
助教 中村 公一(なかむら こういち)
背景
グリコーゲンは、肝臓や筋肉で合成され蓄えられているエネルギーのもととなる多糖で、脳にも貯蔵されていることが知られています。最近では、グリコーゲンは通常時における脳活動のエネルギー源としてだけでなく、記憶の定着という重要な脳活動にも関わることが明らかになってきました。
しかし、脳グリコーゲンの詳細な分布は細胞レベルでも組織レベルでも明らかになっていません。その理由は、肝臓や筋肉のグリコーゲンに比べて脳グリコーゲンは微量しか存在せず、標本を作製する段階でグリコーゲンが分解されてしまうからです。
これまでグリコーゲンの可視化方法として、電子顕微鏡法とPAS染色[7]と呼ばれる化学染色法などが用いられてきました。しかし、電子顕微鏡は1マイクロメートル(μm、1μmは1,000分の1mm)以下のミクロな構造の観察には適していますが、より広い領域をカバーするマクロレベルの観察には膨大な時間がかかるという問題があります。PAS染色は、光学顕微鏡を用いたマクロレベルの観察は可能ですが、グリコーゲン以外の多糖類や糖鎖なども染色してしまうという欠点がありました。また、組織固定液[8]の潅流(かんりゅう)[9]による化学固定法では標本を作製する段階で、グリコーゲンがエネルギー源として消費されてしまい、微量しか存在しない脳グリコーゲンの分布を調べるのは困難でした。
そこで共同研究グループは、従来の固定法とは全く異なる手法で脳グリコーゲンを保存する技術を開発することにしました。
研究手法と成果
共同研究グループは、マウスの脳にマイクロ波を照射することにより、グリコーゲン分解酵素(グリコーゲンの末端を切断しグルコースを生み出す酵素)を含む脳の酵素活性を瞬時に不活化させ、生体脳のグリコーゲンを保存するという特殊な固定法を用いました。さらに、この固定法と抗グリコーゲン抗体による免疫組織染色法を組み合わせることで、細胞内の微小な構造(ミクロレベル)から脳全体の大きな構造(マクロレベル)までの観察が可能になりました。この方法を用いると、グリコーゲンのみを可視化できるという大きなメリットがあります。
共同研究グループはまず、マウス脳全体のグリコーゲンを観察し、各脳領域単位でグリコーゲン量を相対比較しました。その結果、記憶やシナプス可塑性[10]と強い関連がある海馬、大脳皮質第一層、線条体、小脳分子層にグリコーゲンが多く存在することが分かりました(図1)。
次に、マウスの脳を用いて、グリコーゲンを蓄積している細胞の種類を特定しました。脳には神経細胞の他にグリア細胞と呼ばれる支持細胞が存在しますが、このグリア細胞の一種であるアストロサイトがグリコーゲンを貯蔵していました。この結果は、従来の電子顕微鏡観察による報告と合致しました。アストロサイトは細胞体の他に極めて細い突起構造を持ちますが、グリコーゲンのほとんどはこの突起構造に局在していました(図2)。アストロサイトの突起構造は神経細胞のシナプスを密に取り囲んでいるため、グリコーゲンとシナプス機能との関連が考えられます。
海馬と線条体を観察したところ、グリコーゲンを多く貯蔵しているアストロサイトと、貯蔵していないアストロサイトが存在することが分かりました。アストロサイトは、お互いが重ならないように配置していることが知られていますが、グリコーゲンは、免疫組織染色法により濃く染色される細胞と、ほとんど染色されない細胞が隣り合い、モザイク状に分布していることが明らかになりました。
最後に、マウスを用いて脳グリコーゲンと年齢の関係を調べました。年齢とともに代謝機能が低下することは知られていますが、脳グリコーゲンと加齢との関係は明らかになっていませんでした。マウスの寿命は約2年ですが、1年齢、1.5年齢、2年齢の老齢マウスと若齢マウス(2~3月齢)を比較したところ、脳のグリコーゲン分布は加齢によって大きく変化することが分かりました。まず、グリコーゲンの中でも特に分子量が大きいグリコーゲンを選択的に可視化しました。その結果、若齢マウスではモザイク状の分布を示していたグリコーゲンが、1年齢ではそのモザイク状の分布がかなり薄くなり、1.5、2年齢ではほぼ完全に消失したことが分かりました(図3)。
また、分子量に関係なくすべてのグリコーゲン量を測定したところ、若齢マウスと老齢マウスではほとんど差がなかったことから、分子量が大きいグリコーゲンが加齢によって消失することが分かりました。さらに、老齢マウスでは分解されずに蓄積している異常なグリコーゲンが多数観察されました。
今後の期待
本研究では、新しい手法によって正確な脳グリコーゲンの分布を明らかにし、グリコーゲンが特にシナプス可塑性、記憶の定着に関係している脳領域や細胞内構造に局在していることを示しました。これは今後、神経とグリア細胞の相互作用を研究する上で重要な基礎的な知見だと考えられます。
また本研究では、加齢によるグリコーゲンの貯蔵の変化を可視化することに成功しましたが、加齢は認知機能とも深く関わっています。特にアルツハイマー病は近年第三の糖尿病とも呼ばれており、脳の糖疾患という考え方が脚光を浴びています。多糖であるグリコーゲンは糖疾患(糖尿病に代表される糖代謝の異常によって生じる疾患)との関連も深く、今後は、アルツハイマー病をはじめとする脳疾患との関連についても研究を進めていく予定です。
原論文情報
- Yuki Oe, Otto Baba, Hitoshi Ashida, Kouichi C. Nakamura, Hajime Hirase, "Glycogen distribution in the microwave-fixed mouse brain reveals heterogeneous astrocytic patterns", GLIA, doi: 10.1002/glia.23020
発表者
理化学研究所
脳科学総合研究センター 神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
研究員 大江 祐樹(おおえ ゆうき)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.グリコーゲン
グルコース(ブドウ糖)が重合した多糖で、枝分かれが非常に多い構造の高分子。肝臓と骨格筋で主に合成され、エネルギーの貯蔵物質として知られる。脳では記憶が固定されるときにグルコースに分解され、さらに乳酸に変換されて神経細胞へ送られると考えられている。 - 2.多糖
グルコースが数珠状に多数つながったエネルギー貯蔵物質の総称。分解されることにより、再度グルコースとなりエネルギーとして利用される。動物におけるグリコーゲン、植物におけるデンプンなどが有名である。 - 3.マイクロ波
家庭で使用される電子レンジもマイクロ波を用いて食品を温めているが、本研究では家庭用の約10倍の出力の高マイクロ波を瞬間的(1秒)に脳に照射している。瞬間的照射により脳の温度が瞬時に85℃に達し、グリコーゲンを分解する酵素が失活する。 - 4.免疫組織染色法
抗体を用いて、抗原を可視化する組織染色法。本研究で使用した抗グリコーゲン抗体は、抗原がグリコーゲンであるため、組織中のグリコーゲンを選択的に可視化する。 - 5.グリア細胞
神経膠(しんけいこう)細胞とも呼ばれる。脳内の神経細胞を除いた多くの細胞の総称で、アストロサイト、ミクログリア、オリゴデンドロサイトなどがある。 - 6.アストロサイト
脳細胞の中のグリア細胞の一種で、主に神経細胞を支える機能を担っている。代謝以外にも、神経伝達物質の回収、脳の掃除など神経細胞が正常に機能できるように脳内環境を整えている。 - 7.PAS染色法
組織学や病理学においてグリコーゲンを染色するために用いられる染色法。グルコース残基を選択的に酸化して染色する。ただし、グルコース残基はグリコーゲン以外の多糖や糖鎖にも存在するため、グリコーゲンのみを選択的に染色することはできない。 - 8.固定液
細胞・組織を劣化から防ぎ、物理的強度を持たせた上で、保存を可能にするために使用される溶液。脳標本ではタンパク質を架橋する場合、アルデヒド系の試薬が用いられることが多い。 - 9.潅流(かんりゅう)
麻酔下の動物の血管系に固定液を直接流し込み、脳を含むさまざまな組織を固定する方法。脳のような厚みのある組織では、浸潤固定法より効率の高い組織固定が行える。 - 10.シナプス可塑性
シナプスは、神経細胞同士が情報を伝達するための接続部。シナプスの反応性が増すことで記憶や学習が起きると考えられている。アストロサイトはこのシナプスを密に囲い、エネルギー供給、イオンバランス維持、余分な物質の除去を行っている。シナプス伝達の効率は一定ではなく入力の強度により変化することをシナプス可塑性と呼ぶ。
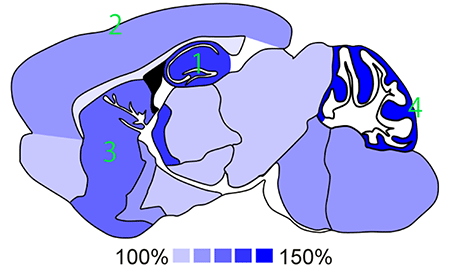
図1 マウス脳グリコーゲンの矢状断面図
濃い青がより多くのグリコーゲンが存在することを示している。海馬(1)と小脳分子層(4)にグリコーゲンが最も多く存在し、次に線条体(3)と大脳皮質(2)が多い。
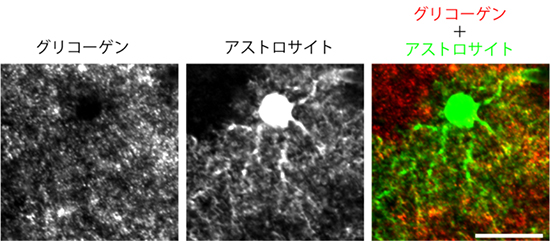
図2 マウス脳のグリコーゲンとアストロサイトの光学顕微鏡写真
左:白い部分がグリコーゲンを示している。
中央:白い部分がアストロサイトを示している。大きく丸い部分が細胞体、その周りに星状に突起が出ている。
右:ニつの写真を疑似カラーで重ね合わせたもの。アストロサイトの特に突起構造にグリコーゲンが豊富に存在していることが分かる。スケールバーは20μm。
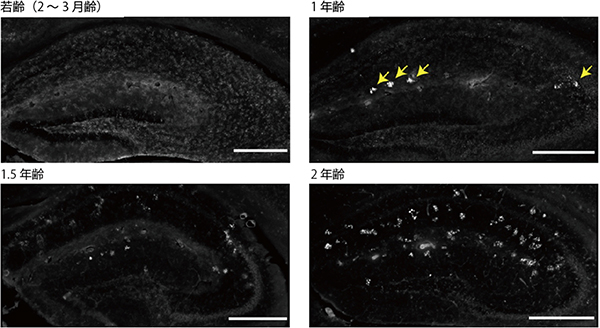
図3 海馬における若齢マウスと老齢マウスのグリコーゲン
若齢マウスで観察されたモザイク状に分布したグリコーゲンが、老齢マウス(1年齢、1.5年齢、2年齢)では薄くなるかまたは消失していた。また、1年齢マウス脳の黄色矢印で示した白い部分は、分解されない異常グリコーゲンを示している。異常グリコーゲンは加齢とともに増加していくことが分かる。スケールバーは500μm。
