要旨
理化学研究所(理研)グローバル研究クラスタ疾患糖鎖研究チームの木塚康彦客員研究員、谷口直之チームリーダーらの国際共同研究チーム※は、「6-アルキニルフコース」という化合物が、細胞が作る糖鎖[1]の合成を阻害することを発見しました。
糖鎖は体の中でさまざまな役割を果たしており、糖鎖の構造や量の変化が、がん、糖尿病、アルツハイマー病などの疾患の原因の一つとなることが分かっています。フコース糖鎖(フコシル化糖鎖)[2]と呼ばれる糖鎖は、免疫機能や肺機能に重要であるのに加え、肺がん、肝がん、膵臓がんなどの多くのがんで発現が上昇します。実際に、フコース糖鎖の量の増加を指標にしたAFP-L3、CA19-9といったバイオマーカー[3]が、がんの診断に用いられています。さらにフコース糖鎖の量の増加が一部のがんの悪性化(浸潤、転移など)を引き起こすことも分かってきており、フコース糖鎖の合成阻害剤は、がんの悪性化を抑える治療候補物質の一つと考えられます。しかし、フコース糖鎖の合成を特異的に阻害する化合物は、これまでほとんど開発されていませんでした。
今回、国際共同研究チームは、「6-アルキニルフコース」と呼ばれる化合物が、細胞内でのフコース糖鎖の合成を強く阻害することを見いだしました。この化合物は、フコース糖鎖の構成成分であるフコース[4]と類似した構造をしています。6-アルキニルフコースを細胞に添加すると、フコース糖鎖の合成に関わる酵素の一つを選択的に阻害することで、細胞の持つフコース糖鎖の量を大きく減少させることが分かりました。また、その阻害効果は既存のフコース糖鎖合成阻害剤よりもはるかに強いことが分かりました。さらに、肝がん細胞にこの化合物を添加すると、がん細胞の浸潤が抑えられたことから、この化合物はがんの悪性化を抑える作用を持つ可能性があることも分かりました。
6-アルキニルフコースは今後、フコース糖鎖の役割を調べる基礎的な研究に加え、がん治療などへの応用が期待できます。また、フコース糖鎖を持たない強力な抗体医薬品[5]の製造などへの応用の可能性も考えられます。
本研究は、米国の科学雑誌『Cell Chemical Biology』(12月21日号)に掲載されるのに先立ち、オンライン版(10月12日付け:日本時間10月13日)に掲載されます。
本研究は、日本医療研究開発機構(AMED)「糖鎖利用による革新的創薬技術開発事業」の研究課題「糖鎖の超高感度検出を目的とした新規糖アナログの開発(研究開発代表者:木塚康彦)」の支援を受けて行われました。
※国際共同研究チーム
理化学研究所 グローバル研究クラスタ
システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
客員研究員 木塚 康彦(きづか やすひこ)
チームリーダー 谷口 直之(たにぐち なおゆき)
広島大学大学院 先端物質科学研究科
准教授 中の 三弥子(なかの みやこ)
藤田保健衛生大学 研究支援推進センター
講師 中嶋 和紀(なかじま かずき)
台湾中央研究院 ゲノム研究センター
上席研究員 チーフゥイ ウォン(Chi-Huey Wong)
背景
単糖が鎖状、もしくは分岐状につながってタンパク質などに結合したものを糖鎖と呼びます。糖鎖の付加はタンパク質が受ける修飾の中で最も量が多く、哺乳動物に存在する半数以上のタンパク質には糖鎖が結合しています。このように糖鎖が結合したタンパク質は、糖タンパク質と呼ばれています。糖鎖には多くの種類があります。その構造は多様で、私たちの体の中でさまざまな役割を果たしています。そして、がん、糖尿病、アルツハイマー病など多くの疾患において、糖鎖の構造や量の変化が発症や悪化に関わることが分かっています。このように疾患に伴って特定の糖鎖が変化することから、疾患を診断するためのバイオマーカーとして糖鎖を利用する試みが進んでいます。特にがんでは、AFP-L3、CA19-9といった糖鎖の変化を指標とした診断マーカーがすでに臨床の現場で使われています。
AFP-L3、CA19-9はフコース糖鎖(フコシル化糖鎖)の一種です。フコース糖鎖はがんで量が増加する糖鎖の一つとして知られ、診断に用いられるだけでなく、糖鎖が疾患の発症や進行に関わる場合では、その糖鎖を標的とした治療が有効であると考えられます。実際、フコース糖鎖の増加は、肺がんや肝がんなどの発症や悪性化(浸潤、転移など)に関わることが分かってきています。このことから、フコース糖鎖の発現や機能を抑えることができれば、これらのがんに有効な治療の選択肢の一つになりうると考えられます。ところがこれまで、フコース糖鎖の合成を阻害する薬剤はほとんど開発されていませんでした。
今回、国際共同研究チームはフコースと形がよく似た化合物の6-アルキニルフコースに着目しました。このように糖と構造がよく似た物質のことを糖のアナログ[6]と呼びますが、糖のアナログの中には、糖鎖の合成を阻害する作用を持つものがあることが知られていたからです。
研究手法と成果
国際共同研究チームはまず、6-アルキニルフコースをさまざまな動物細胞に添加し、細胞の持つ糖鎖の量がどのように変化するのかを調べました。Hela細胞(ヒト子宮頸がん細胞)を用いて、レクチン[7]と呼ばれる特定の糖鎖と結合するタンパク質で染色したところ、多くの糖鎖の量は変化しませんでしたが、フコース糖鎖の量が大きく減少していることが分かりました(図1左)。この作用は、6-アルキニルフコースと構造が非常によく似た、7-アルキニルフコースではみられませんでした。また、HEK293細胞(ヒト胎児腎細胞)を用いて、質量分析(MS)[8]によって、細胞の持つ糖鎖の構造をより詳しく分析しました。その結果、6-アルキニルフコースの添加によってフコース糖鎖がほぼ消失し、代わりにフコースを持たない糖鎖の量が増えていました(図1右)。これらのことから、6-アルキニルフコースには選択的にフコース糖鎖の合成を阻害する作用があることが分かりました。
次に、マウス線維芽細胞を用いて、6-アルキニルフコースの持つ糖鎖の合成阻害作用の強さを調べました。現在最もよく用いられるフコース糖鎖の合成阻害剤の一つである、2-フルオロフコースとその作用の強さを比較しました。その結果、6-アルキニルフコースの方がはるかに低い濃度で阻害効果を示しました(図2)。このことから、6-アルキニルフコースは既存の阻害剤よりも強力なフコース糖鎖合成阻害剤であることが分かりました。
続いて、6-アルキニルフコースがなぜフコース糖鎖の合成を阻害するのか、その仕組みを調べました。フコース糖鎖の中にあるフコースは、GDP-フコースと呼ばれる物質からフコース転移酵素によって作られます。そして、GDP-フコースは、グルコースを出発材料とし、細胞の中でいくつかの酵素の作用によって作られます(図3上段)。6-アルキニルフコースの添加によってフコース糖鎖が減少したことから、6-アルキニルフコースはフコース転移酵素やGDP-フコースの合成酵素の働きを抑えている可能性が考えられました。
そこで、まずマウス線維芽細胞を用いて、細胞内のGDP-フコースの量を調べたところ、6-アルキニルフコースによって大きく減少することが分かりました(図3下段左)。このことから、GDP-フコースを合成する酵素が標的となっていると考えられました。そこで、これらの酵素に対する作用を調べたところ、6-アルキニルフコースは、FXと呼ばれる酵素を特異的に阻害していることが分かりました(図3下段右)。また、FXに対する阻害作用やGDP-フコース量の減少は、6-アルキニルフコースと構造が類似した7-アルキニルフコースや6-アジドフコースなどの添加ではみられませんでした。これらのことから、6-アルキニルフコースはFXの働きを抑えることでGDP-フコースの量を減少させ、これによってフコース糖鎖の量が減少するという仕組みが分かりました。
最後に医療への応用を目指し、ヒトのがん細胞に対する6-アルキニルフコースの作用を調べました。上述のように、フコース糖鎖は肝がんや肺がんでその量が増加し、悪性化と深い関係にあることが分かっています。そこで、肝がん細胞に6-アルキニルフコースを添加し、その増殖と、悪性化の指標の一つである浸潤能に対する作用を調べました。その結果、6-アルキニルフコースは、肝がん細胞の増殖には影響を与えませんでしたが、浸潤能を抑えることが分かりました(図4)。このことから、6-アルキニルフコースによってフコース糖鎖の合成を阻害することで、がんの悪性化を抑えられる可能性があることが示されました。
今後の期待
本研究により、既存のものよりも強い作用を持つフコース糖鎖の合成阻害剤が見いだされ、その作用の仕組みが分かりました。フコース糖鎖の合成阻害剤はこれまでほとんど開発されていないことから、6-アルキニルフコースは今後、フコース糖鎖の役割を調べる基礎的な研究に加え、がん治療などへの応用が期待できます。
また、フコース糖鎖はがんやリウマチの治療に広く用いられている抗体医薬品にも結合しており、抗体医薬品のフコース糖鎖を除くとその効力が50倍に上昇すること注1)が知られています。このことから、6-アルキニルフコースは、フコース糖鎖を持たない強力な抗体医薬品の製造などへの応用も期待できます。
注1)Shields, R.L.; Lai, J.; Keck, R.; O'Connell, L.Y.; Hong, K.; Meng, Y.G.; Weikert, S.H.; Presta, L.G. “Lack of fucose on human igg1 n-linked oligosaccharide improves binding to human fcgamma riii and antibody-dependent cellular toxicity.” J Biol Chem2002, 277, 26733-26740.
Shinkawa, T.; Nakamura, K.; Yamane, N.; Shoji-Hosaka, E.; Kanda, Y.; Sakurada, M.; Uchida, K.; Anazawa, H.; Satoh, M.; Yamasaki, M., et al. “The absence of fucose but not the presence of galactose or bisecting n-acetylglucosamine of human igg1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity.” J Biol Chem2003, 278, 3466-3473.
原論文情報
- Yasuhiko Kizuka, Miyako Nakano, Yoshiki Yamaguchi, Kazuki Nakajima, Ritsuko Oka, Keiko Sato, Chien-Tai Ren, Tsui-Ling Hsu, Chi-Huey Wong, Naoyuki Taniguchi, "An Alkynyl-fucose Halts Hepatoma Cell Migration and Invasion by Inhibiting GDP-Fucose Synthesizing Enzyme FX (TSTA3)", Cell Chemical Biology, doi: 10.1016/j.chembiol.2017.08.023
発表者
理化学研究所
グローバル研究クラスタ システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
客員研究員 木塚 康彦(きづか やすひこ)
チームリーダー 谷口 直之(たにぐち なおゆき)
 木塚 康彦
木塚 康彦
 谷口 直之
谷口 直之
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.糖鎖
グルコース(ブドウ糖)などの糖が鎖状につながった物質。遊離の状態で存在するものもあれば、タンパク質や脂質に結合した状態のものもある。 - 2.フコース糖鎖(フコシル化糖鎖)
フコースと呼ばれる糖を構成成分の一つに持つ糖鎖。がんなどで血中や細胞中での量が増え、がんの増殖、転移に関わることが知られている。また、炎症や慢性閉塞性肺疾患の発症にも深く関わっている。 - 3.バイオマーカー
体液中などにおける存在量が疾患の有無や進行度の指標となるような生体物質。糖鎖も、がんなどのバイオマーカーとして用いられる。 - 4.フコース
糖鎖を構成する糖の一種。哺乳類では、フコースを含めて10種類程度の糖から糖鎖は構成される。 - 5.抗体医薬品
疾患に特異的な分子と結合する抗体を薬として用いること。それを投与することによって病気の原因となる細胞や物質を除去する。タンパク質性の医薬品であるため高価であり、現在、医薬品の売り上げの大部分を占めている。フコース糖鎖を持っており、糖鎖中のフコースを除去することによって効果が著しく高まることが知られている。 - 6.アナログ
性質や構造の骨格は元になる化合物と同一であるが、一部の構造が別の原子や官能基に置換された化合物。類似体や類縁体とも呼ばれる。 - 7.レクチン
糖もしくは糖鎖と結合する性質を持つタンパク質。植物や動物の体内に存在している。 - 8.質量分析(MS)
分子をイオン化し、質量によって分離することで分子の質量を知る分析法。目的とする分子をさらに断片化させた質量も得ることができ、これらの情報から、含まれる分子の構造や種類の同定にも用いられる。MSとはMass Spectrometryの略。
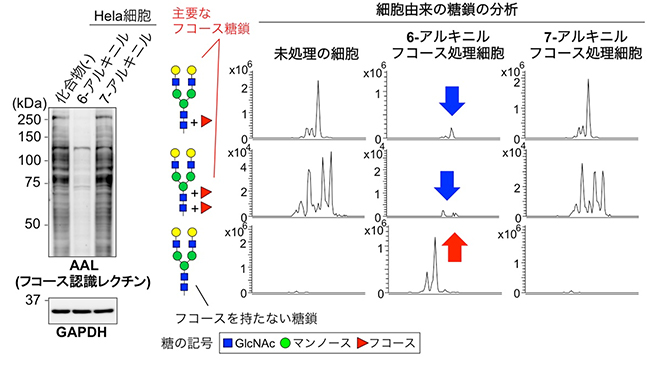
図1 6-アルキニルフコースの添加によるフコース糖鎖の減少
左:Hela細胞(ヒト子宮頸がん細胞)を6-アルキニルフコースもしくは7-アルキニルフコースで処理し、細胞中のタンパク質をAALレクチン(フコース糖鎖と結合するタンパク質)で染色した。GAPDHはサンプル間で同量のタンパク質を使用したことを示すための図。6-アルキニルフコース処理の場合は染色がほとんどみられず、フコース糖鎖の量が大きく減少したことがわかる。
右:質量分析(MS)による特定の糖鎖の分析。各グラフの縦軸はシグナルの強さ(量に相当)、横軸は保持時間(親水性の違いに相当)を示す。HEK293細胞(ヒト胎児腎細胞)を6-アルキニルフコースもしくは7-アルキニルフコースで処理し、モデルとなる糖タンパク質を精製し、糖鎖を質量分析(MS)で解析した。上段と中段は二つの主要なフコース糖鎖を、下段はフコースを持たない糖鎖のシグナルを示す。6-アルキニルフコースの添加によってフコース糖鎖がほぼ消失し(青矢印)、代わりにフコースを持たない糖鎖の量が増えた(赤矢印)。
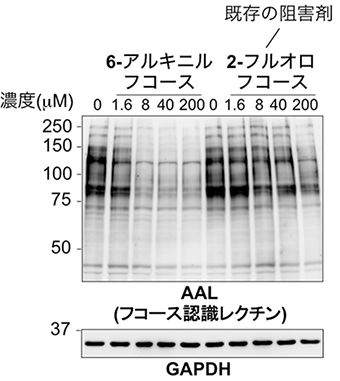
図2 6-アルキニルフコースの阻害作用の強さ
マウス線維芽細胞を6-アルキニルフコース、もしくは既存のフコース糖鎖合成阻害剤である2-フルオロフコースで処理し、細胞のタンパク質の糖鎖をAALレクチン(フコース糖鎖と結合する)により染色した。GAPDHはサンプル間で同量のタンパク質を使用したことを示すための図。6-アルキニルフコースの方が、はるかに低い濃度で阻害効果を示したことが分かる。
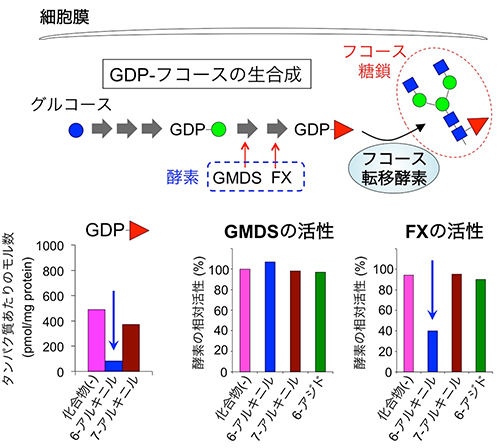
図3 6-アルキニルフコースの阻害の仕組み
上段:細胞中でのフコース糖鎖の合成経路。フコース糖鎖中のフコースは、GDP-フコース(赤三角)という物質から作られる(右側)。GDP-フコースは、グルコース(青丸)を原料とし、GDP-マンノース(緑丸)を経由して、GMDSとFXという二つの合成酵素の作用により作られる。
下段:左はマウス線維芽細胞を6-アルキニルフコースもしくは7-アルキニルフコースで処理した後、細胞中のGDP-フコースの量(細胞中のタンパク質あたりのモル数)を測定したもの。中と右は、GMDSおよびFXのin vitro(試験管内)における活性測定。6-アルキニルフコースは、FXの酵素活性を直接阻害することが分かった。
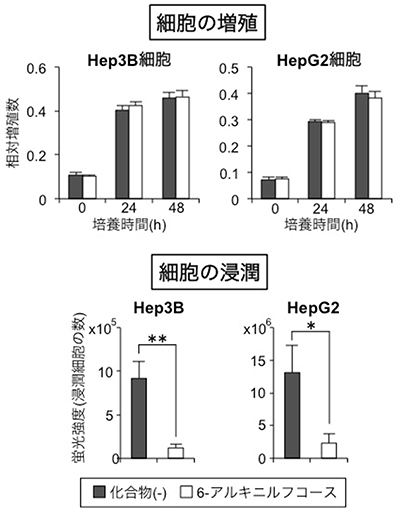
図4 6-アルキニルフコースによる肝がん細胞の浸潤抑制
ヒト肝がん細胞株であるHep3BおよびHepG2細胞を6-アルキニルフコースで処理し、細胞の増殖(上)と浸潤を(下)それぞれ調べた。6-アルキニルフコースは増殖には影響を与えないが、浸潤を有意に低下させた。
