要旨
理化学研究所(理研)環境資源科学研究センター植物免疫研究グループのジュリアニ・K・イシダ特別研究員(研究当時)、若竹崇雅研修生、吉田聡子上級研究員(研究当時)、白須賢グループディレクターらの国際共同研究グループ※は、寄生植物が寄生を開始する際に形成する侵入器官の発生に、局所的なオーキシン生合成が重要であることを発見しました。
ハマウツボ科に属するストライガなどの寄生植物は、ソルガム[1]やトウモロコシなどの主要な穀物の根に寄生し、収穫量を大幅に減少させてしまうため、アフリカを中心に深刻な問題となっています。ハマウツボ科の寄生植物は根に「吸器」と呼ばれる侵入器官を発達させ、宿主植物の根に侵入して水分や栄養を奪います。しかし、この寄生植物に特徴的な器官である吸器の発生メカニズムは、ほとんど分かっていませんでした。
国際共同研究グループは、吸器の発生に関わる遺伝子を探すために、ストライガと同じハマウツボ科に属するコシオガマ[2]という日本に自生する寄生植物を、モデル植物として確立しました。そして、次世代シーケンサー[3]を用いた網羅的な解析から、吸器発生初期に発現が変動する遺伝子を多数同定しました。同定された遺伝子群の中に、植物ホルモンの一種であるオーキシン[4]の関連遺伝子が多数見出されたことに着目し、オーキシン生合成の鍵酵素[5]YUCCAをコードする「YUC3遺伝子」の解析を進めました。まず、YUC3の発現は吸器発生部位の表皮で特異的に上昇すること、そして、YUC3の発現の上昇に伴い、内生のオーキシン量が上昇することが分かりました。また、吸器発生過程でのオーキシン応答部位を解析すると、発生初期でYUC3の発現パターンと重なることが分かりました。YUC3の発現を減少させると、形成される吸器の数が減少しました。反対に、YUC3の発現を表皮で特異的に誘導すると、吸器様の構造を形成する様子が観察されました。以上の結果から、YUC3を介した吸器発生部位での局所的なオーキシンの生合成が、吸器発生において重要な過程であることが明らかになりました。
本研究から、寄生への最初のステップである吸器の発生メカニズムの一端がみえてきました。今後、さらに発生メカニズムの解明が進めば、寄生植物による農業被害防止への応用が期待できます。
本研究は、米国の科学雑誌『The Plant Cell』掲載に先立ち、オンライン版(7月6日付け:日本時間7月7日)に掲載される予定です。
※国際共同研究グループ
理化学研究所 環境資源科学研究センター
植物免疫研究グループ
特別研究員 (研究当時)ジュリアニ・K・イシダ(Juliane K. Ishida)(現 サンパウロ大学研究員)
研修生 若竹 崇雅(わかたけ たかのり)(東京大学大学院生)
上級研究員 (研究当時) 吉田 聡子 (よしだ さとこ)(現 奈良先端科学技術大学院大学特任准教授)
グループディレクター 白須 賢(しらす けん)
生産機能研究グループ
テクニカルスタッフⅡ 竹林 裕美子(たけばやし ゆみこ)
客員主幹研究員 笠原 博幸(かさはら ひろゆき)
ペンシルバニア州立大学
バイオインフォマティクスプログラマー エリック・ワフラ(Eric Wafula)
教授 クロード・W・デパンフィリス(Claude W. dePamphilis)
東京大学大学院 農学生命科学研究科
教授 難波 成任(なんば しげとう)
背景
ストライガなどのハマウツボ科の寄生植物は、ソルガムやトウモロコシなどの主要な穀物に寄生し、その収量を大幅に減少させるため、アフリカを中心に深刻な問題となっています。現在、有効な防除手段はなく、被害は拡大する一方です。ハマウツボ科の寄生植物は、根に「吸器」と呼ばれる侵入器官を形成し、この器官を介して宿主植物の根に付着、侵入します。そして自身の組織を宿主植物の水や養分の通り道である維管束に接続することで、水分や栄養を奪います(図1)。吸器の発生は寄生への最初のステップですが、吸器の発生がどのように制御されているのかは明らかになっていませんでした。
研究手法と成果
国際共同研究グループは吸器の発生メカニズムを解明するために、ハマウツボ科に属する寄生植物の中で、日本に自生するが農業的には問題となっていない野草のコシオガマをモデル植物として確立し、研究を進めました。
まず、コシオガマの根と吸器のトランスクリプトーム[6]を次世代シーケンサーで解析し、得られた断片的なDNA配列をコンピュータ上で再構成することで、根と吸器で発現している遺伝子配列を決定しました。この遺伝子配列をもとにして、吸器発生の初期にどのような遺伝子の発現が変動しているかを調べるために、カスタムマイクロアレイ解析[7]を行いました。その結果、2,6-dimethoxy-1,4-benzoquinone(DMBQ)に応答して発現が変動する遺伝子群を同定しました。DMBQは、植物細胞壁由来と考えられているキノン類の化学物質で、ハマウツボ科の寄生植物において吸器発生の初期過程を誘導することが知られています。次に、国際共同研究グループは、植物ホルモンの一種で植物の器官発生において重要な役割を担っているオーキシンの関連遺伝子の発現が多数上昇していることを見出しました。そこで、関連遺伝子の一つであり、オーキシンの主要生合成経路で働く酵素YUCCAをコードする「YUC3遺伝子」に着目し解析を進めました。
代表的なモデル植物であるシロイヌナズナでは、YUCCAファミリーの遺伝子は11個存在し、オーキシン生合成の主要経路に関わることが示されています注1)。今回のトランスクリプトーム解析からは四つのコシオガマYUC遺伝子を同定していましたが、吸器の発生時に特異的に発現が上昇する遺伝子はYUC3だけであることを確認しました。コシオガマの根でYUC3を過剰発現させると、多数の側根が誘導され、オーキシンの内生量も上昇しました。このことから、シロイヌナズナと同様に、コシオガマのYUC3がオーキシンの生合成に関わることを示すデータが得られました。DMBQ処理や宿主植物の根で誘導されるYUC3の発現パターンを解析すると、吸器発生部位の表皮に特異的であることが分かりました。
続いて、DR5オーキシン応答性レポーター[8]を用いてライブイメージング[9]を行い、吸器発生過程でのオーキシン応答を時空間的に解析しました。その結果、吸器発生初期に、オーキシン応答の極大点が新たに表皮で確立されること、この極大点を頂端として、吸器が宿主植物の根へ向かって発達する様子が観察されました(図2)。吸器発生初期のオーキシン応答パターンは、YUC3の発現パターンとよく一致していました。
さらに、YUC3が吸器発生に必要であるか、およびYUC3の発現が吸器発生に十分であるかを検証しました。YUC3の発現をRNAi法[10]で抑制すると、宿主植物によって誘導される吸器の数が減少することが分かりました。反対に、宿主植物からの吸器誘導物質がない状態で、YUC3の発現を表皮で特異的に誘導すると、表皮付近で細胞分裂が起こり、吸器様の構造を形成する様子が観察されました。この構造は、DMBQによって誘導される吸器の構造と類似していました。したがって、コシオガマのYUC3は吸器発生過程で機能し、表皮での発現は吸器発生初期のプロセスを誘導するのに十分であることが示されました。
以上の結果から、コシオガマのYUC3を介したオーキシンの局所的な生合成が、吸器発生初期の重要なステップであることが明らかになりました(図3)。
注1)2011年10月25日プレスリリース「ついに植物ホルモン「オーキシン」生合成の主経路を解明」
今後の期待
寄生植物による農業被害に対する効率的な対策は、いまだに開発されていません。今回の研究から、寄生への最初のステップである吸器の発生メカニズムの一端がみえてきました。今後、さらに発生メカニズムの解明が進めば、寄生植物対策への応用が期待できます。
原論文情報
- Juliane K. Ishida*, Takanori Wakatake*, Satoko Yoshida, Yumiko Takebayashi, Hiroyuki Kasahara, Eric Wafula, Claude W. dePamphilis, Shigetou Namba, Ken Shirasu (*co-first authors), "Local auxin biosynthesis mediated by a YUCCA flavin monooxygenase regulates the haustorium development in the parasitic plant Phtheirospermum japonicum", The Plant Cell, doi: 10.1105/tpc.16.00310
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
特別研究員(研究当時) ジュリアニ・K・イシダ(Juliane K. Ishida)
(現 サンパウロ大学 研究員)
研修生 若竹 崇雅(わかたけ たかのり)
(東京大学大学院生)
上級研究員(研究当時) 吉田 聡子(よしだ さとこ)
(現 奈良先端科学技術大学院大学 特任准教授)
グループディレクター 白須 賢(しらす けん)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ソルガム
熱帯アフリカ原産のイネ科の一年草。生産面積ではコムギ、イネ、トウモロコシ、オオムギに次いで世界第5位である。乾燥に強く、熱帯では主食として用いられる。 - 2.コシオガマ
学名: Phtheirospermum japonicum。ハマウツボ科に属する条件的寄生植物。自分でも光合成をするが、他の植物の根が近づいてくると寄生を開始する。実験室環境下でもよく育ち、自家受粉をするため、モデル生物として適している。 - 3.次世代シーケンサー
細かく断片化された大量のDNAを同時並行的に解析し、塩基配列を高速に決定することができる解析装置。 - 4.オーキシン
植物ホルモンの一種で、器官発生、細胞分化など植物の発生において重要な役割を持つことが知られている。 - 5.鍵酵素
ある物質が複数の酵素によって段階的に合成されるとき、その一連の反応の中で最も速度の遅い反応を触媒する酵素。律速酵素ともいう。 - 6.トランスクリプトーム
ある状況下における、転写産物の全体像。ここではmRNAを対象にして解析をしている。 - 7.マイクロアレイ解析
一本鎖DNA断片を基板上に高密度に並べ、そこへサンプルから抽出したmRNAをもとに合成した相補鎖RNAを結合させ、その結合量から遺伝子の発現量を検出するトランスクリプトーム解析の方法。今回は、デ・ノボ・アセンブリで得られたコシオガマの遺伝子配列をもとに一本鎖DNA断片をデザインした。 - 8.DR5オーキシン応答性レポーター
オーキシンに応答して発現するDR5プロモーターを利用したレポーター。さまざまな植物のオーキシン応答を観察するのによく用いられている。 - 9.ライブイメージング
生きた細胞や組織で、タンパク質の局在や遺伝子の発現パターンなどを観察する手法。 - 10.RNAi法
二本鎖RNAによって相同配列を持つmRNAが破壊される現象を利用した、遺伝子発現抑制方法。今回は、YUC3特異的な配列を持つ二本鎖RNAを植物細胞に作らせ、YUC3の発現を抑制した。
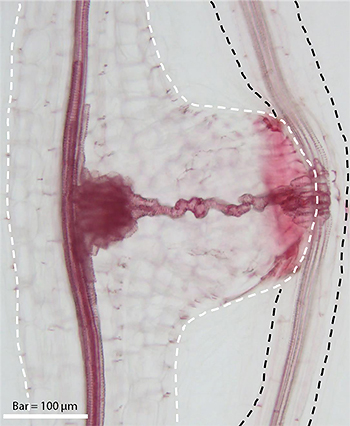
図1 寄生植物コシオガマの吸器
シロイヌナズナの根(右:黒い破線)に道管(根から水と養分を運ぶ管)を接続する寄生植物コシオガマの吸器(左:白い破線)。サフラニン染色で道管が赤く染まって見える。
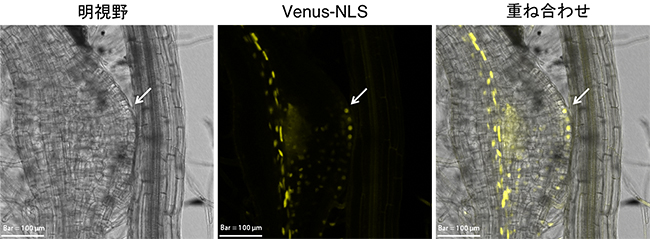
図2 吸器発生時のDR5オーキシン応答性レポーターの発現パターン
DR5オーキシン応答性レポーターを用いて、コシオガマ根でのオーキシン応答を可視化した共焦点顕微鏡画像。一般に、根では維管束と根端で強いオーキシン応答がみられるが、これに加えて矢印で示した吸器頂端でオーキシン応答がみられる。
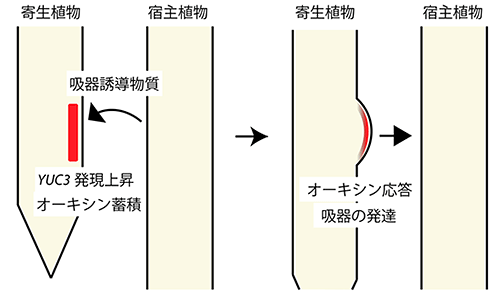
図3 YUC3を介した吸器発生メカニズム
宿主植物との相互作用から吸器誘導物質を感知した寄生植物は、表皮でYUC3遺伝子の発現を上昇させ、局所的なオーキシンの生合成を開始する。表皮付近で新たに確立されたオーキシン応答の極大点を頂端とし、吸器は宿主植物の方向へと向かって発達を始める。
