2009年4月21日
独立行政法人 理化学研究所
針状とは異質なヌードル状の低毒性インスリンアミロイド線維を発見
-アルツハイマー病などの一因とされるアミロイドの毒性の謎解明へ光明-
ポイント
- インスリンの還元剤処理が「ヌードル状」インスリンアミロイド線維を生み出す
- さまざまな病因の「ニードル(針)状」インスリンアミロイド繊維とは内部構造も異なる
- ニードル状の毒性は高いが、ヌードル状の毒性は極めて低いことを発見
要旨
独立行政法人理化学研究所(野依良治理事長)は、さまざまな疾病の原因とされているアミロイド線維※1のうち、柔軟で「ヌードル状」構造を持つインスリン※2アミロイド線維を見つけ、毒性の高い「ニードル(針)状」アミロイド線維に比べ、細胞毒性が非常に低いことを世界で初めて発見しました。これは、理研基幹研究所(玉尾皓平所長)前田バイオ工学研究室の座古保専任研究員、迫野昌文基礎特別科学研究員(現さきがけ専任研究員)と前田瑞夫主任研究員らによる成果です。
タンパク質が規則的に自己集合して生じるニードル状のアミロイド線維は、細胞毒性が高く、アルツハイマー病などさまざまな疾病の一因と考えられています。この毒性の由来については、生化学的性質や物理化学的性質などの側面から研究がなされてきましたが、諸説紛紛としていました。アミロイド線維の研究においては、インスリンが古くから代表的なモデルタンパク質の一つとして使われてきました。インスリンは、糖尿病治療で用いられる炭水化物代謝を制御するタンパク質ホルモンの一つで、A鎖とB鎖の2つのペプチド※3が2つのジスルフィド結合※4によってつながっています。このインスリンが酸性・高温条件下にさらされると、ニードル状のアミロイド線維を作り、高い毒性を示すことが知られています。
研究グループは、ウシ由来のインスリンを、還元剤の一つであるTCEP(Tris (2-carboxyethyl) phosphine)を加えて酸性・高温条件の下で恒温静置すると、これまで知られていたニードル状のアミロイド線維とは異なり、柔軟な構造を持つヌードル状のアミロイド線維が生成することを発見しました。新しく発見したヌードル状アミロイド線維は、内部のβシート※5の積層構造がニードル状アミロイド繊維とは異なり、さらに細胞毒性がほとんどないことが分かりました。つまり、同じアミノ酸配列を持つタンパク質が自己集合した結果、構造の異なる2つのアミロイド線維が生成し、細胞毒性が異なることを世界で初めて明らかにしました。これまで謎であった毒性の由来を解く手がかりになると考えられます。
本研究成果は、米国の科学雑誌『Biophysical Journal』(4月21日号)に掲載されます。
背景
タンパク質が、規則的に自己集合して生じるアミロイド線維は、細胞毒性が高く、さまざまな疾病の一因と考えられています。例えば、β-アミロイドタンパク質やβ2ミクログロブリンは、体内での濃度が上昇するなどの理由で自己集合し、アミロイド線維として脳内や全身に沈着すると、それぞれアルツハイマー病、透析アミロイドーシスなどの疾病の原因になると考えられています。ほかにも、さまざまなタンパク質がニードル(針)状のアミロイド線維をつくり、いずれにも共通して、βシートが線維の長軸に垂直方向に積層した「クロスβ構造」を有することが知られています。これらのアミロイド線維は、細胞死を引き起こす細胞毒性が高いことから、これまで多くの研究がなされてきましたが、なぜ毒性を有するかについては諸説紛紛でした。
インスリンは、糖尿病治療で用いられる炭水化物代謝を制御するタンパク質ホルモンの一つで、A鎖とB鎖2つのペプチドが、2つのジスルフィド結合によってつながっています(図1)。これまでにインスリンは、酸性や高温という構造を不安定化させる環境条件下で、ニードル状のアミロイド線維を作ることが知られており、アミロイド線維研究の代表的モデルタンパク質の一つとされてきました。
研究手法と成果
研究グループは、ウシ由来のインスリンを、還元剤の一つであるTCEP(Tris (2-carboxyethyl) phosphine)を加えて酸性・高温条件下でインキュベートすると、これまで知られていたニードル状のアミロイド線維とはまったく異なり、柔軟な構造を持つヌードル状のアミロイド線維が生成することを発見しました(図2)。ニードル状とヌードル状という外見の異なる2つのアミロイド線維について、内部構造や細胞毒性などを詳細に調べて比較しました。
(1)内部構造を蛍光観察
これまで知られているアミロイド線維は、共通して、βシートが積層したクロスβ構造を形成することが知られています。そこで、積層βシートに結合すると強い蛍光シグナルを出す色素「チオフラビンT(ThT)※6」との結合を調べました。その結果、ニードル状のインスリンアミロイド線維がThTと結合して強いシグナルを出すのに対し、ヌードル状のインスリンアミロイド線維はThTとの結合が弱く、シグナルも弱いことが分かりました(図3)。つまり、ニードル状とヌードル状では内部構造に差異があることが示唆されました。
(2)内部構造を分光観察
アミロイド線維内の2次構造をCDスペクトル※7とFTIR※8の2つの分光学的手法により調べました。その結果、ニードル状とヌードル状のインスリンアミロイドは、両方ともβシートを多く含有することが分かりました(図4)。このため、(1)の結果と考え合わせると、2種のインスリンアミロイドは、βシートの積層の様式の異なることが推測できます。また、FTIRでは、ヌードル状のインスリンアミロイドだけで波数1,700cm-1付近にピークを観察しました(図4B)。このピークは、逆平行βシート※5が存在することを意味しており、ここでもβシートの積層様式の異なることが示されました。
(3)細胞毒性の評価
2種のインスリンアミロイドの細胞毒性をMTT法※9によって評価しました。ニードル状のインスリンアミロイドは、投与濃度を上げるほど生存率が下がるので、細胞毒性を有することが分かるのに対し、ヌードル状のインスリンアミロイドは、投与濃度を上げても細胞の生存率は下がらず、細胞毒性の極めて低いことが分かりました(図5)。
今後の期待
今回の成果は、同じアミノ酸配列を持つタンパク質が自己集合した結果、構造の異なる2つのアミロイド線維が生成し、それらの細胞毒性が異なることを世界で初めて明らかにしたものです。これまで謎だった、細胞毒性の由来を解く手がかりになると考えられます。すなわち、これら2種のアミロイドの細胞毒性の差の理由を明らかにすることで、アミロイド線維の毒性の謎に迫ることができると期待できます。
発表者
理化学研究所
基幹研究所 前田バイオ工学研究室
専任研究員 座古 保(ざこ たもつ)
Tel: 048-467-9312 / Fax: 048-462-4658
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.アミロイド線維
特殊な構造的性質を示すタンパク質の線維性集合体。一般には「ニードル(針)状」の構造をもち、内部はβシート構造が積層していると考えられている。タンパク質を熱や酸性溶液中などの変性条件下におくと形成することが多い。病人患部に共通して見られることから、疾病の原因ではないかとされている。興味深いことに、βシートをほとんど持たないタンパク質もアミロイド線維を形成されることが分かっている。 - 2.インスリン
膵臓(すいぞう)から分泌されるペプチドホルモンの一つ。体内では主として炭水化物の代謝を調節しており、血糖値の恒常性維持に重要である。糖尿病患者治療に用いられる。 - 3.ペプチド
複数個のアミノ酸が脱水結合してつながったもの。 - 4.ジスルフィド結合
2つのチオール(-SH)基間にできる共有結合。タンパク質中ではチオール基を有するアミノ酸であるシステイン(Cys)残基間で形成される。タンパク質の高次構造形成にも重要だとされている。 - 5.βシート、逆平行βシート
βシートはタンパク質の2次構造の一つで、隣り合った伸び切ったペプチド間が主鎖同士の水素結合により平面構造を形成している。隣り合うペプチドの向きにより、平行βシートと逆平行βシートがある。 - 6.チオフラビンT(ThT)
アミロイド検出に使われる色素。450nmの光で励起すると、積層βシート間に結合している場合は強い蛍光を発する。一般にアミロイドは積層βシートを持っているので、アミロイドに結合すると強い蛍光を発すると考えられている。 - 7.CDスペクトル
円偏光2色性スペクトル。タンパク質の2次構造や3次構造評価に用いられる。 - 8.FTIR
フーリエ変換型赤外分光法。測定対象に赤外線を照射し、透過光および反射光の干渉パターンをフーリエ変換してスペクトルを得ることで、対象物の分子構造や状態を知ることができる。タンパク質サンプルでは、αヘリックス、βシートの有無を評価することができる。 - 9.MTT法
MTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド)を用いた細胞の生死判定法。MTTは黄色であるが、細胞が生きていればミトコンドリアでの還元反応によりMTTは還元され、紫色のフォルマザンに変わる。生じたフォルマザン量を550nmの吸光度により定量し、細胞の生存率を決定する。細胞毒性の評価によく用いられる。

図1 インスリンの構造
A鎖とB鎖2つのペプチドが2つのジスルフィド結合によって結合している。そのほか、A鎖内にもジスルフィド結合がある。
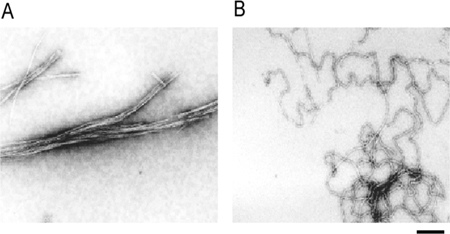
図2 インスリンの2種のアミロイド線維
A:還元剤未処理のインスリンアミロイド線維(ニードル型)
B:TCEP存在下でインキュベートして生成したインスリンアミロイド線維(ヌードル型)。スケールバー: 200nm
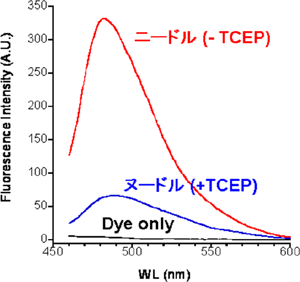
図3 チオフラビンT(ThT)蛍光
ThTは、積層βシートに結合して強い蛍光を発する色素とされている。ニードル状のアミロイド線維は強いThT蛍光を示すが、ヌードル状のアミロイド線維では弱い。
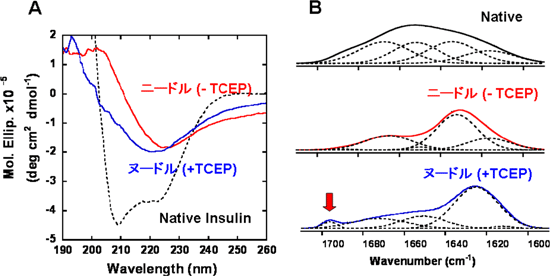
図4 インスリンアミロイドの2次構造評価
CDスペクトル
天然のインスリンがαヘリックス構造をとっているのに対し、ニードル状、ヌードル状のインスリンアミロイドはどちらもβシート構造を有する。
FTIRスペクトル
ここでもアミロイドのβシート構造転移が確認できる。ヌードル状のインスリンアミロイドだけに波数1,700cm-1付近にピークを観察した(矢印)。
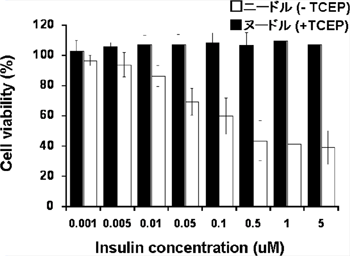
図5 細胞毒性
MTT法によって評価した。縦軸は細胞の生存率を示し、値が低いほど毒性が高いことを意味する。ニードル状のインスリンアミロイドは投与濃度を上げるほど生存率が下がるのに対し、ヌードル状のインスリンアミロイドは投与濃度を上げても細胞は死ななかった。
