要旨
理化学研究所(理研)環境資源科学研究センター細胞機能研究チームの池内桃子基礎科学特別研究員、岩瀬哲研究員、杉本慶子チームリーダーらの研究チームは、植物が分化全能性[1]の発揮を抑えることで細胞が分化を完了した状態を維持していることを明らかにしました。
多細胞生物の体が構築される過程では、分化全能性を持った受精卵が細胞分裂と細胞分化を繰り返し、最終的に特殊な構造と生理機能を持ったさまざまな細胞となります。秩序立った多細胞の体を維持するためには、分化が完了した細胞をその状態に留めておかなくてはいけません。一方、植物は分化が完了した細胞であっても単離・培養することで分化全能性を発揮し個体を再生します。しかし、植物細胞の分化全能性が通常の個体発生や分化の過程でどのように抑制されているのかは分かっていませんでした。
研究チームは、シロイヌナズナ[2]の「PRC2(Polycomb repressive complex 2)[3]」というタンパク質複合体の機能が欠損したPRC2変異体では、根毛細胞が細胞分裂を開始し、不定形の細胞塊であるカルス[4]と不定胚[5]を形成することを発見しました。不定胚の形成は分化全能性発揮の1つの指標です。さらに、このPRC2変異体の根毛細胞では、核内倍加[6]を経て、一度正常に分化した根毛細胞がカルス化と不定胚形成をしていることを明らかにしました。
PRC2はヒストン[7]H3タンパク質を構成するアミノ酸のうち27番目のリジンをメチル化することで、クロマチン構造[8]を閉じた状態に変化させ、ゲノムの特定領域での遺伝子発現を抑えます。研究チームは、シロイヌナズナの根のゲノム上で、どの遺伝子がPRC2によって発現を抑えられているかを網羅的に調べました。その結果、研究チームが以前発見した脱分化促進因子の「WIND3注1)」[9]や胚発生制御因子の「LEC2」などの遺伝子発現が抑えられていることを見いだしました。また、WIND3遺伝子やLEC2遺伝子を強制的に発現させることで、PRC2の機能が正常に働いている植物でも根毛細胞からカルスを誘導できることも分かりました。
今回、植物が通常の発生・成長の過程で、細胞分化が完了した後に分化全能性を抑制する分子メカニズムがあることを示しました。そして、この分子メカニズムはヒストンの化学修飾による脱分化促進因子の遺伝子発現抑制であることを明らかにしました。今後、効率の良い組織培養[10]による植物の量産などへの活用が期待できます。
本研究は、国立研究開発法人農業・食品産業技術総合研究機構生物系特定産業技術研究支援センターのイノベーション創出基礎的研究推進事業、農林水産省の農林水産業・食品産業科学技術研究推進事業、日本学術振興会の科学研究費助成事業の支援を受けて実施されました。成果は英国の科学雑誌『Nature Plants』に掲載されるのに先立ち、オンライン版(6月29日付け:日本時間6月30日)に掲載されます。
- 注1) 2011年3月11日プレス発表「植物細胞の脱分化を促進するスイッチ因子を発見」
背景
多細胞生物の体が構築される過程では、分化全能性を持った受精卵が細胞分裂と細胞分化を繰り返し、最終的に特殊な構造と生理機能を持ったさまざまな細胞となります。秩序立った多細胞の体を維持するためには、分化が完了した細胞をその状態に留めておかなくてはいけません。
一方、植物が高い再生能力を有していることは古くから知られています。挿し木などで行われている組織レベルの話だけでなく、分化が完了した1つの細胞からでも個体を再生させることができます。これは植物細胞が分化全能性を持っていることを示しており、1950年代末から1970年代の多くの研究から導かれました。現在でも、優良品種の量産や品種改良などは、この能力に基づいた技術で行われ、種苗・育種産業の基盤となっています。他生物との比較から、植物細胞の分化全能性はしばしば植物を特徴づける性質と考えられていますが、一方で、植物は通常の発生や分化の過程で不必要な分化全能性の発揮を抑えなくてはなりません。しかし、それがどのようなメカニズムでなされているのか、これまで分かっていませんでした。
研究手法と成果
研究チームは、植物細胞の脱分化(分化した細胞が、より未分化な状態に戻ること)の分子メカニズムを解明するため、遺伝子の機能獲得や機能欠損によってカルス化するシロイヌナズナ変異体の解析を進めています。その過程で、高等真核生物に広く保存された「PRC2(Polycomb repressive complex 2)」というタンパク質複合体の機能が欠損したPRC2変異体で、根毛細胞をはじめとするさまざまな細胞が時間の経過とともに至る所でカルス化し、さらにその一部が不定胚を形成すること発見しました(図1)。不定胚の形成は分化全能性発揮の1つの指標です。
根毛細胞は、根の表皮細胞の一部が伸長成長によって外に張り出し巨大化した1個の細胞です。シロイヌナズナの根毛細胞は、細胞の分裂を経ずにDNA複製のみが進行する核内倍加という特殊な細胞周期によって核の中のDNA量が増加し、水分や無機塩類を土壌中から吸収する高度に機能化した最終分化細胞です。研究チームは、「PRC2変異体では、最終分化細胞の分化状態の維持ができずにカルス化や不定胚の形成が起きている」という仮説を立て、この現象とその原因について詳細に調べました。
まず、根毛細胞のカルス化が、本当にPRC2の機能欠損によって起きるのかを調べました。PRC2は、大きく分類すると4つのタンパク質サブユニットからできています。研究チームはそのうち3つのサブユニットに関して、それぞれの機能が欠損した変異体を用いて、形質を観察しました。その結果、どのサブユニットの変異体でも根毛細胞がカルス化しました。これはカルス化が、PRC2の機能の消失によって起きていることを示しています。また、プロモーターリポーター解析[11]から、PRC2を構成するタンパク質は、根で発現していることを確認しました。
長く伸びた根毛細胞がカルス化する過程には、細胞分裂しながら伸長するか、または一旦は核内倍加・細胞伸長を完了した後に分裂するかの2つの可能性が予想できます。DAPI染色[12]や蛍光タンパク質を用いて根毛細胞の核や細胞膜を可視化したところ、初めはPRC2変異体でも野生株と同様に、1つの根毛細胞に1つの大きな核が形成されていました。このことは、PRC2変異体の根毛細胞が、核内倍加した後に分裂していることを示唆します。
そこで、核内倍加した後に分裂していることをさらに確かめるため、核内倍加の度合いや、核の大きさ、染色体中心の大きさを指標として細胞分裂開始前の根毛細胞について調べました。細胞分裂が盛んな根の分裂組織と根毛細胞を、野生株とPRC2変異体で比較したところ、どの指標においても、PRC2変異体は野生株と同程度の値を示しました。すなわち、分裂組織ではどちらも同程度の小さな核を持ち、根毛細胞ではどちらも同程度の大きな核を持っていました。これはPRC2変異体の根毛細胞は、野生株と同様に正常な細胞分化を行っていること意味します。その後、時間の経過とともにPRC2変異体のみが細胞分裂して多細胞化している(図1中上)ことから、PRC2変異体の根毛細胞は一度伸長し、巨大な1つの細胞になってから、つまり核内倍加後に分裂していることを確認できました。また、根毛細胞だけでなく大きな核を持つ皮層細胞が分裂する様子も動画で捉えることに成功しました。
高等真核細胞では、PRC2がヒストンH3タンパク質を構成するアミノ酸のうち27番目のリジンにメチル基を付加することで、クロマチン構造が閉じられる状態を作ることが知られています。メチル化されたヒストンはゲノムの特定の領域に結合し、その領域にある遺伝子発現を抑えます。クロマチン免疫沈降法[13]を用いて、シロイヌナズナのゲノム上で、どこの領域の遺伝子がPRC2によって発現を抑えられているかを網羅的に調べました。その結果、研究チームがこれまで明らかにした植物細胞の脱分化因子の1つ「WIND3」や、不定胚形成を促進させる「LEC2」などの遺伝子発現が抑えられていることが分かりました。実際、PRC2変異体の根ではこれらの遺伝子発現が上昇していました。また、WIND3やLEC2を過剰に発現させることで、根毛細胞を分裂させカルスを形成させることに成功しました。さらに、PRC2変異体の中でこれらの遺伝子の働きを抑えると、根毛細胞の多細胞化も抑えられました。
これらの解析から、根毛細胞などの一度分化した植物細胞には、細胞が脱分化しないように抑えるメカニズムがあり、それがヒストンのメチル化を介したクロマチン構造の制御によって行われていることが分かりました(図2)。これは、植物が通常の発生・成長の過程、特に細胞分化が完了した後でも分化状態を維持するメカニズムがあることを示した上に、そのメカニズムの一端を細胞・分子レベルで明らかにしたと言えます。
今後の期待
LEC2やWIND3遺伝子の過剰発現によって引き起こされる根毛細胞のカルス化の頻度は、PRC2変異体よりも低いことや、これらの因子の発現抑制による多細胞化の抑制も完全でないことから、PRC変異体で観察さる根毛細胞の脱分化には、他にもさまざまな因子が関与していることが予想されます。今後、それらの因子を探索することで、植物細胞がPRC2を通してどのように分化状態を維持するのか、その分子メカニズムの詳細が明らかになると期待できます。同時に、植物の新規脱分化誘導因子の発見も期待できます。
また今回の研究で、ヒストン修飾因子の制御によって、分化した植物細胞の脱分化が誘導できることが示されました。これまで脱分化や再分化が困難であった植物種において、クロマチン状態を操作することで、効率的な脱分化・再分化技術の開発が可能になるかもしれません。
原論文情報
- Momoko Ikeuchi, Akira Iwase, Bart Rymen, Hirofumi Harashima, Michitaro Shibata, Mariko Ohnuma, Christian Breuer, Ana Karina Morao, Miguel de Lucas, Lieven De Veylder Justin Goodrich, Siobhan M. Brady, Francois Roudier and Keiko Sugimoto, "PRC2 represses dedifferentiation of mature somatic cells in Arabidopsis", Nature Plants, doi: 10.1038/NPLANTS.2015.89
発表者
理化学研究所
環境資源科学研究センター 細胞機能研究チーム
チームリーダー 杉本 慶子(すぎもと けいこ)
基礎科学特別研究員 池内 桃子(いけうち ももこ)
研究員 岩瀬 哲(いわせ あきら)
 発表者の岩瀬 哲(左)、杉本慶子(中央)、池内桃子(右)
発表者の岩瀬 哲(左)、杉本慶子(中央)、池内桃子(右)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.分化全能性
1つの細胞が個体を構成する全ての細胞種に分化できる潜在能力のこと。受精卵は分化全能性を有している。植物細胞では、葉肉細胞のプロトプラストや花粉の細胞からカルス化を経て個体を再生できることから、分化を完了した細胞においても分化全能性を発揮できる。 - 2.シロイヌナズナ
アブラナ科の植物。植物のモデル生物(普遍的な生命現象の解明に用いられる代表的な生物)の1つ。2000年に植物として初めて全ゲノムが解読された。 - 3.PRC2 (Polycomb repressive complex 2)
タンパク質複合体の1つ。ヒストンH3を構成するアミノ酸のうち27番目のリジン残基をトリメチル化する機能を持つ。ショウジョウバエで発見されたが、高等真核生物が広く持っている。細胞分化においてさまざまな機能を持つことが明らかになっている。 - 4.カルス
植物が傷口に作る不定形の細胞塊。癒傷(ゆしょう)組織とも言う。現在では、植物の組織培養で形成される不定形の細胞塊のことを広く示す。カルスが形成されることをカルス化という。 - 5.不定胚
受精卵からではなく、体細胞から生じる胚。通常の受精卵と同様な形態的変化の過程をとることが知られている。組織培養条件下では、単離した1つの体細胞から不定胚を経由し、完全な植物体を作ることから、不定胚形成は分化全能性発揮の1つの指標となる。 - 6.核内倍加
細胞の分裂を経ずにDNA複製のみが進行すること。1つの細胞中の核内DNA量が増加する現象。真核生物に広く見られる現象で、特に植物では頻繁に起きる。核内倍加を経た細胞では、多くの場合細胞の巨大化が起きる。また、近年では核内倍加を止める機構も明らかにされている注2,3,4)。
- 注2) 2007年12月4日プレス発表「DNAの量によって植物の大きさが決まる新たな仕組みを解明」
- 注3) 2009年8月11日プレス発表「細胞分裂の調節に必須の新しい「HPY2」遺伝子を発見」
- 注4) 2009年9月1日プレス発表「植物細胞の大きさを調節する新たな遺伝子「GTL1」を発見」
- 7.ヒストン
DNAを巻きつけて核の中に収納するタンパク質。コアヒストンとしては、H2A、H2B、H3、H4の4種類がある。H2AとH2B、H3とH4が結合したものがさらに結合し8量体を形成する。それぞれのヒストンタンパク質が、メチル化、アセチル化、ユビキチン化などの化学修飾を受け、それが遺伝子発現などに影響を与えることが明らかになりつつある。 - 8.クロマチン構造
DNAがヒストンタンパク質に巻き付いたものをヌクレオソームと呼ぶが、このヌクレオソームが凝集したものをクロマチンと呼ぶ。クロマチン構造は、クロマチンが立体的にどのような状態になっているかを表す。凝集が強い場合は、DNAに転写因子などが結合できず遺伝子の発現制御ができないが、凝集が弱い状態だと、DNAがさまざまな因子の影響を受けやすくなる。このように、クロマチン構造は単にDNAをパッケージするためだけでなく、遺伝子の発現制御にも関与することが分かっている。 - 9.WIND3
WIND3はWOUND INDUCED DEDIFFERENTIATION3の略。転写因子は、特定のDNA配列に結合し遺伝子発現を制御するタンパク質の一群。WIND3転写因子は研究チームが2011年に報告している、WIND1転写因子のパラログ因子。WIND1同様、傷ストレスによって発現が上昇し、植物細胞の脱分化に関与することが分かっている。 - 10.組織培養
動物や植物など、体の組織の一部を取り出して、試験管内の培地で維持したり、培養して増やしたりする技術。植物分野では、種子をつけない植物の増産や、茎頂の分裂組織を培養してウイルスに感染していない植物を作り出すなど、広く応用されている。 - 11.プロモーターリポーター解析
ある遺伝子のプロモーター領域に、β-グルクロニダーゼ(GUS)遺伝子や緑色蛍光タンパク質(GFP)遺伝子などのレポーター遺伝子をつないで生体内で発現させ、レポーター遺伝子の発現をモニターすることで、その遺伝子がいつ、どの部位で、どんな刺激に応答して遺伝子発現が行われているかなどを観察する解析方法。 - 12.DAPI染色
DAPI(4, 6-ジアミジノ-2-フェニルインドール)は、二本鎖DNAのAT領域に結合する。紫外線を当てることで青色蛍光を発する性質を持つことから、核DNAの染色に使われる。この染色のことをDAPI染色という。 - 13.クロマチン免疫沈降法
生体内におけるタンパク質とゲノムDNAの結合部位を検出するための実験手法。ホルムアルデヒドによってDNAとDNAに結合しているタンパク質を架橋したのちに、DNAの断片化を行い、タンパク質の抗体を用いてタンパク質-DNA複合体を回収する。さらにDNAとタンパク質を脱架橋し、DNAのみを回収し配列を調べることでタンパク質がゲノムのどこに結合していたかが分かる。
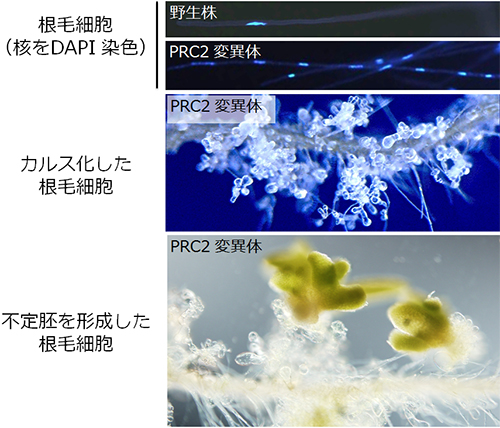
図1 PRC2変異体の根毛が分裂・脱分化し不定胚を形成する様子
蛍光色素DAPIで染色した野生株の根毛細胞には、核が1つ確認される(上)。PRC2変異株では多核になっていることが確認された(中上)。時間の経過とともに、PRC2変異株の根毛細胞ではカルス化が起き(中下)、さらには不定胚を形成するものも観察された(下)。
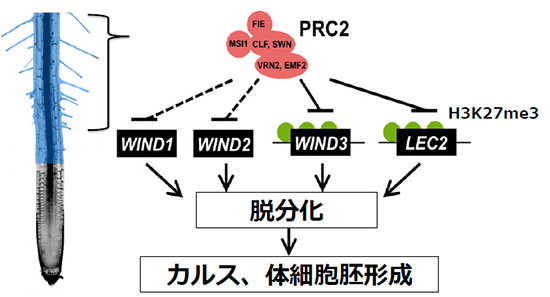
図2 PRC2による脱分化関連遺伝子の発現抑制
PRC2(赤)は、分化した根毛細胞や根の細胞(青)においてWINDやLEC2などの遺伝子の発現を、直接的(実線)・間接的(破線)に抑えることで、細胞の脱分化を抑え、分化が完了した状態を維持している。
