2016年1月18日
理化学研究所
先天性外眼筋繊維症に伴う神経発達異常の仕組みを解明
-神経軸索の正しい形成に必要なタンパク質の作用が明らかに-
要旨
理化学研究所(理研)脳科学総合研究センター分子動態解析技術開発チームの武藤悦子チームリーダー、箕浦逸史研究員らの共同研究グループ※は、3型先天性外眼筋繊維症(CFEOM3)[1]に伴う神経発達異常は、チューブリン[2]というタンパク質の変異がキネシン[3]というモータータンパク質の正常な運動を妨げ神経軸索の伸長を阻害することで生じることを明らかにしました。
CFEOMとは、眼筋麻痺による斜視や眼瞼下垂を主な症状とする先天性の疾患で、1型、2型、3型に分類されます。このうち3型であるCFEOM3は主にβ3チューブリンの遺伝子変異が原因であることが近年分かってきました。しかし、この遺伝子変異がどのように神経や筋肉の異常を起こすのか、そのメカニズムの全容は明らかになっていませんでした。
共同研究グループは、CFEOM3の原因として知られているヒトβ3チューブリン変異体の組換えタンパク質を発現・精製することに成功し、β3チューブリンの遺伝子変異がキネシンとの相互作用を妨げていることを明らかにしました。β3チューブリンと相互作用できないキネシンは正常な運動ができず、神経の伸長に重要な微小管の形成や制御が十分できないと考えられます。また、このメカニズムを元に、β3チューブリンとキネシンの相互作用を回復(レスキュー)[4]できるキネシンの変異体(レスキュー変異体)の作成にも成功しました。このレスキュー変異体が、β3チューブリン変異体によって異常が生じた神経形成を回復させる能力があることを、培養神経細胞やマウスの脳を用いて確認しました。
今回の研究により、CFEOM3に伴うβ3チューブリンの遺伝子変異が、キネシンとの結合異常を介して正常な神経の伸長を阻害する仕組みが明らかになりました。また、正常な神経の形成はβ3チューブリンとキネシンとの相互作用によって制御されていることが分かりました。今後の詳細な解析によって、CFEOMの治療法開発の促進が期待できます。さらに、神経が軸索を伸ばし配線するメカニズムの理解につながる可能性があります。
本研究は、国際科学雑誌『Nature Communications』(1月18日付け:日本時間1月18日)に掲載されます。
※共同研究グループ
理化学研究所
脳科学総合研究センター
分子動態解析技術開発チーム
チームリーダー 武藤 悦子(むとう えつこ)
研究員 箕浦 逸史(みのうら いつし)
テクニカルスタッフⅠ 鮎川 理恵(あゆかわ りえ)
研究員 八久保 有(はちくぼ ゆう)(研究当時)
研究員 髙﨑 寛子(たかざき ひろこ)(研究当時)(大阪大学大学院 生命機能研究科)
研究員 内村 誠一(うちむら せいいち)(研究当時)
視床発生研究チーム
チームリーダー 下郡 智美(しもごおり ともみ)
テクニカルスタッフⅡ 吉田 千尋(よしだ ちひろ)
神経成長機構研究チーム
チームリーダー 上口 裕之(かみぐち ひろゆき)
研究員 肥田 友伸(ひだ とものぶ)
背景
αチューブリンとβチューブリンは細胞骨格である微小管を構成するタンパク質です。微小管は細胞の形の制御や細胞内の「輸送路」として働き、神経細胞の形成や維持、細胞の運動などに極めて重要なものです(図1)。ヒトには8種のβチューブリン遺伝子がありますが、なかでもβ3チューブリンは、脳が形成される胎児~新生児期の神経細胞に多く存在することが知られています。
β3チューブリンが関連する疾患に、先天性外眼筋繊維症(CFEOM)が挙げられます。CFEOMとは眼筋麻痺による斜視や眼瞼下垂を主な症状とする先天性の疾患で、1型、2型、3型に分類されます。このうち3型であるCFEOM3は、主にβ3チューブリンの遺伝子変異が原因であることが近年明らかになりました。CFEOM3は眼瞼下垂や眼球運動が制限されることが主な症状の先天性症候群ですが、β3チューブリンの遺伝子変異がどのように神経や筋肉の異常を引き起こすか、そのメカニズムの全容は明らかになっていませんでした。
研究手法と成果
武藤チームリーダーらは、これまでヒト遺伝子由来の組み換え[5]チューブリンを発現・精製する技術を開発してきました。今回、共同研究グループはこの技術を用いてCFEOM3の原因として知られているβ3チューブリンの262番目のアルギニン残基[6](R262)が変異した変異チューブリンの発現・精製に成功しました。この変異チューブリンを用いて、全反射照明蛍光顕微鏡[7]を用いた1分子イメージング解析と生化学解析を組み合わせ、R262が変異したチューブリンにはモータータンパク質であるキネシンが相互作用できず、キネシンの正常な運動を妨げていることを明らかにしました。
R262が結合するキネシン分子内の構造は、L12ループ[8]と呼ばれる構造部位であると考えられます。このことから、β3チューブリンR262の変異は、キネシン分子L12ループを改変したキネシンによって補うことが出来ると予想されました。実際にそのような変異キネシンを作成したところ、変異キネシンは変異チューブリンからなる微小管に結合し、正常に近い運動を行うことが分かりました(図2)。すなわち、チューブリンの変異を回復(レスキュー)できるキネシンの変異体(レスキュー変異体)を作り出すことに成功しました。
β3チューブリンの変異によってキネシンが微小管に結合できなくなり、正常に運動できなくなることがCFEOM3発症の仕組みであることを確かめるため、変異チューブリン遺伝子をマウス神経由来の培養細胞で発現させました。その結果、神経細胞から伸びる軸索の長さが短くなることが分かりました。一方で、キネシンのレスキュー変異体を一緒に発現させると、再び軸索の長さは正常に戻ることを確認しました。
また、マウス胎児の脳に子宮内エレクトロポレーション[9]という技術を用いて変異チューブリンを導入したところ、左右の脳をつなぐ脳梁と呼ばれる神経繊維の長さが短くなることが分かりました。これはCFEOM3の患者に見られる脳梁の形成不全と一致します。さらに、キネシンのレスキュー変異体を一緒に発現させたところ、脳梁の神経繊維の長さもほぼ正常に戻ることを明らかにしました(図3)。
以上の結果は、β3チューブリンからなる微小管にキネシンが結合して運動できる組み合わせの時は神経細胞から正常な長さの軸索が形成されるが、β3チューブリンに変異があり微小管にキネシンが結合できないときは、正常な長さの軸索が形成されないことを示しています。共同研究グループは、β3チューブリンとキネシンとの相互作用が神経軸索を正しく形成するために必要であることを明らかにしました。
今後の期待
共同研究グループは、脳神経の形成時に神経細胞内でβ3チューブリンを含む微小管とキネシンが正しく相互作用することが、神経軸索の正しい形成に重要であることを明らかにしました。この知見はCFEOMが発症するメカニズムの理解だけでなく、複雑な脳神経がどのように形成されるかという疑問を解く鍵の一つです。
今回の実験では、まず人工的に作り出した「脳梁の神経が短い」という外眼筋繊維症の症状の一部を示すマウスを作り出し、次にその神経の異常を回復させることに成功しました。胎児期の脳が形成される以前に遺伝子の異常を診断し、かつ人工的な遺伝子を導入することには様々な困難が伴うため、この技術をそのまま人間の治療に応用することはできません。しかし、マウスでの解析を通じて発症メカニズムを深く理解することは、より良い治療につながる可能性があります。
また、この研究成果は組換えチューブリンの発現・精製技術を用いることで初めて得られたものです。この技術を応用することで、β3チューブリン以外のチューブリンの変異によって起こる、滑脳症や小頭症などさまざまな先天性疾患のメカニズムの解明が期待できます。
原論文情報
- Itsushi Minoura, Hiroko Takazaki, Rie Ayukawa, Chihiro Saruta, You Hachikubo, Seiichi Uchimura, Tomonobu Hida, Hiroyuki Kamiguchi, Tomomi Shimogori, and Etsuko Muto, "Reversal of axonal growth defects in an extraocular fibrosis model by engineering the kinesin-microtubule interface", Nature Communications, doi: 10.1038/NCOMMS10058
発表者
理化学研究所
脳科学総合研究センター 分子動態解析技術開発チーム
チームリーダー 武藤 悦子(むとう えつこ)
研究員 箕浦 逸史(みのうら いつし)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.3型先天性外眼筋繊維症(CFEOM3)
眼筋麻痺による斜視や眼瞼下垂を主な症状とする先天性の症候群。動眼神経や滑車神経、それらが支配する筋肉の異常が見られる。先天性外眼筋繊維症は眼球の向きや可動範囲などにより、1型、2型、3型と分類される。 - 2.チューブリン
真核生物の細胞内にあるタンパク質で、微小管や中心体の構成成分。αチューブリンとβチューブリンから形成されるチューブリン2量体が規則正しく重合することによって微小管を形成する。 - 3.キネシン
微小管に沿って運動し、主に物質輸送を行なうモータータンパク質。多くの種類があり14種のファミリーに分類される。その中には輸送だけでなく、微小管を安定化させたり短縮させたりすることによって、微小管の長さや動態を制御するものもある。 - 4.レスキュー
遺伝子変異などによる異常を別の改変したタンパク質の機能などにより補い、元に近い状態に戻して、異常から回復させること。 - 5.組み換え
組み換え遺伝子技術を用いて、遺伝子産物であるタンパク質を別の培養細胞などで作らせたもの。この場合、ヒトのチューブリンを培養細胞に作らせること。 - 6.アルギニン残基
アルギニンはタンパク質の元となるアミノ酸の1種類。重合してタンパク質の一部となったものをアルギニン残基と呼ぶ。アルギニン残基はプラスの電荷を持つ。 - 7.全反射蛍光顕微鏡
レーザー光を全反射させることによってできる深さ100ナノメートル程度のエバネセント場を利用して蛍光分子を観察する顕微鏡。背景光が抑えられるため、1蛍光分子の微弱な光を観察することができる。 - 8.ループ
タンパク質の構造の中でへリックスやターンなどの特定の構造を取っていない部分。タンパク質表面に存在して他のタンパク質と相互作用することが多い。 - 9.子宮内エレクトロポレーション
妊娠中のマウスなど実験動物の胎児に直接、遺伝子を導入する技術。そのまま妊娠を継続させ、組み換え遺伝子を持った子を正常に出産させることができる。
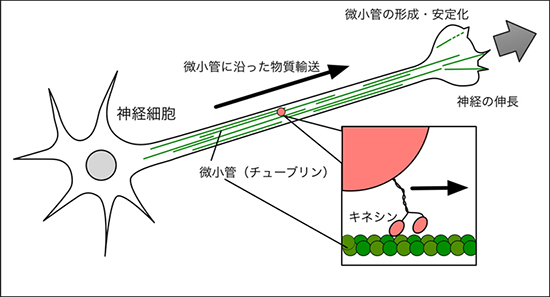
図1 神経細胞での微小管(チューブリン)の役割
神経細胞内にはαおよびβチューブリンから形成された微小管がたくさんあり、長い神経細胞の先端へ物質を運ぶための輸送路となっている。また神経の伸長には微小管の形成が重要である。これらの働きにはモータータンパク質キネシンも重要だと考えられている。
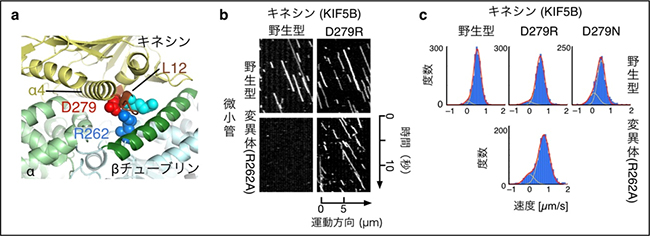
図2 キネシンの変異による、変異チューブリン上での運動異常の回復
(a)外眼筋繊維症の原因となるβチューブリンの変異場所の一つR262は、キネシンのL12ループと相互作用している。(b)1分子イメージングで捉えたキネシンの運動の様子を示した図。横軸が長さ方向の変位、縦軸が時間を表す。チューブリンの変異(R262A)により野生型のキネシンの運動が阻害されるが、D279R変異キネシンは変異微小管上を運動することができる。(c)キネシンの運動速度も野生型とほぼ同じ程度まで回復している。
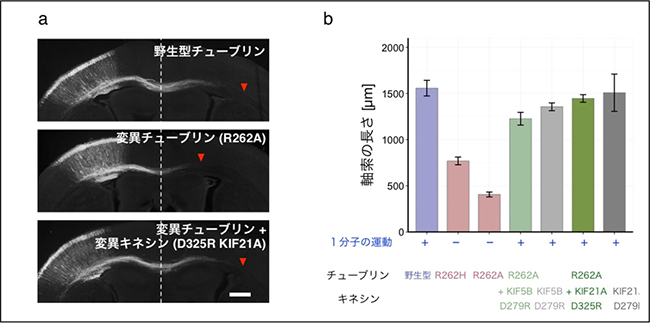
図3 マウス脳梁の発達への変異チューブリン、変異キネシンの影響
a:マウス胎児の脳皮質細胞にチューブリンおよびキネシンを導入したときの脳梁の成長の差を生後3日目で観察したもの。点線が正中線、赤い三角が神経の先端。
b:正中線から神経先端までの水平長さを比較。野生型のチューブリンを導入したとき(青)と比べて、変異チューブリンを導入すると(赤)脳梁が短くなるが、変異キネシンを同時に導入すると(緑)脳梁の神経繊維の長さが回復した。
