要旨
理化学研究所(理研)統合生命医科学研究センター免疫器官形成研究グループの古関明彦グループディレクターと藥師寺那由他客員研究員らの研究チーム※は、マウスの四肢のもととなる肢芽形成において、エピジェネティクス[1]因子の「ポリコム複合体[2]」が果たす役割を明らかにしました。
胚が形作られていく過程で、エピジェネティクス因子であるポリコム複合体は遺伝子の発現を「抑制する」ように働いており、細胞が未分化の状態から特定の細胞へと分化することに深く関わっていることが知られています。分化の過程では、発生に重要なシグナル群に依存した、組織内の領域特定化[3]が行われ、その特定化された情報に基づいて胚が形作られます。ポリコム複合体が領域特定化に関与することは知られていましたが、分子メカニズムは解明されていませんでした。
研究チームはポリコム変異マウスを用いて、肢芽の領域特定化に果たすポリコム複合体の役割を調べました。その結果、ポリコム複合体は、四肢の肩から指先にかけての軸(基部先端部軸[4])の領域特定化に関わり、特に先端部形成に寄与していることが明らかになりました。また、肢芽先端部でポリコム複合体によって抑制される「Meis2遺伝子[5]」を同定しました。Meis2遺伝子は、基部化シグナル[6]によって発現が制御されている遺伝子です。さらに、ポリコム複合体とMeis2遺伝子の両方をノックアウト[7]すると、ポリコム変異によって引き起こされる肢芽の基部先端部軸の異常が改善され、肢芽先端部の形成が部分的に回復しました。これは、ポリコム複合体の機能が肢芽の基部先端部軸形成に必要な発生シグナルによって制御され、特にその機能が肢芽先端部の形成の開始と維持に寄与することを示しています。
これにより、ポリコム複合体が基部化シグナルや先端部化シグナル[8]などの発生シグナルと協調して、マウスの四肢の領域特定化と形態形成に関与していることが明らかになりました。
本研究はJST戦略的創造研究推進事業(CREST)「エピゲノム研究に基づく診断・治療へ向けた新技術の創出」研究領域(研究総括:山本雅之(東北大学大学院医学系研究科教授)における研究課題「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用」(研究代表者:古関明彦)の一環として行われました。
成果は、英国の科学雑誌『Development』オンライン版(1月19日付け:日本時間1月19日)に掲載されます。
背景
胚が形作られていく過程で、エピジェネティクス因子である「ポリコム複合体」は遺伝子の発現を「抑制する」ように働いており、細胞が未分化の状態から特定の細胞へと分化することに深く関わっていることが知られています。分化の過程では、発生に重要なシグナル群に依存した、組織内の領域特定化が行われ、その特定化された情報に基づいて形態形成が進んでいきます。ポリコム複合体が領域特定化に関与することは知られていましたが、ポリコム複合体と発生シグナルがどのような関係があるのか、また、ポリコム複合体が領域特定化をどのように制御しているのか、その詳しい分子メカニズムは明らかにされていませんでした。
マウスの四肢は、基部先端部軸(肩から指先)、前後軸(親指から小指)、背腹軸(手の甲から手の平)の3つの軸に沿った領域特定化、形態形成が行われる器官です。この領域形成に関与する発生シグナル群については、これまでに多くの報告がされています。そこで研究チームは、四肢をモデル器官として、肢芽(四肢の原基)における領域特定化とポリコム複合体の関連について調べることにしました。
研究手法と成果
研究チームははじめに、ポリコム複合体の構成因子であるRing1AおよびRing1B遺伝子をノックアウトしたポリコム変異マウスを2種類作製し、それらの形態を観察しました。その結果、マウスの四肢の基部先端部軸の形態形成に異常が起こることが分かりました(図1)。
次に、ポリコム変異による影響が初期の領域特定化まで及んでいるかどうかを調べるために、マウス肢芽(10.5日胚)における遺伝子発現をコントロール胚(Ring1A 変異欠損型)とRing1A/B変異欠損型で比較しました。
その結果、コントロール胚では先端部で強く発現している遺伝子群が、Ring1A/B変異型では発現が減少していることが分かりました(図2左)。一方、基部側で強く発現している遺伝子群は、Ring1A/B変異型では発現が先端部まで拡大していました(図2右)。つまり、Ring1A/B両変異による異常は、初期の領域特定化の段階から起こっていることが分かりました。
さらに、基部化シグナルによって制御される遺伝子群と、ポリコム複合体によって制御される遺伝子群の中から、「Meis2遺伝子」を同定しました。Meis2遺伝子は通常、肢芽の先端部ではポリコム複合体によって制御されています。Meis2遺伝子の発現変化が、ポリコム変異体で観察された異常の一因となっている可能性を調べるために、ポリコム複合体とMeis2遺伝子両者の変異体(Ring1A、Ring1B、Meis2の全てを欠損させたもの)を作製しました。その結果、両者の変異体の形態は、Ring1A/B変異欠損型よりも部分的に回復していることが分かりました(図3)。さらにRing1A/B変異型(10.5日胚肢芽)で異常となっていた先端部化シグナルに依存した領域特定化が、ポリコムとMeis2遺伝子両者の変異胚においては一部回復していることも明らかとなりました。これらは、ポリコム複合体に依存したMeis2遺伝子の抑制が、先端部形成に重要であることを示しています。
これらのことから、ポリコム複合体の機能は基部先端部シグナルによって制御されており、先端部形成の開始と維持に寄与していると考えられます(図4)。
今後の期待
本研究成果から、ポリコム複合体が基部化シグナルや先端部化シグナルなどの発生シグナルと協調して、四肢の領域特定化と形態形成に関与していることが示されました。しかし、ポリコム複合体と発生シグナルが共通の標的遺伝子を制御するときの詳細な分子メカニズムは、まだ分かっていません。
ポリコム複合体と発生シグナルによる発現制御メカニズムの解明により、1つの受精卵から哺乳類の体が形作られる発生過程の解明と、ES細胞[9]やiPS細胞[9]から組織や器官を作り出す再生医療の発展への寄与が期待できます。
原論文情報
- Yakushiji-Kaminatsui, N. Kondo, T. Endo, TA. Koseki, Y. Kondo, K. Ohara, O. Vidal, M. and Koseki, H., "RING1 proteins contribute to early proximal-distal specification of the forelimb bud by restricting Meis2 expression", Development, doi: 10.1242/dev.127506
発表者
理化学研究所
統合生命医科学研究センター 免疫器官形成研究グループ
グループディレクター 古関 明彦(こせき はるひこ)
客員研究員 藥師寺 那由他(やくしじ なゆた)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.エピジェネティクス
DNA配列に依らない遺伝子の調節機構。A(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4塩基からなるDNAの塩基配列だけでは説明できない遺伝子発現調節の仕組みで、DNAのメチル化やヒストンの修飾などがこれにあたる。 - 2.ポリコム複合体
ショウジョウバエで見出された一群のクロマチン因子。ポリコム複合体は、体の軸に沿った各領域の特異的構造を形成する、ホメオティック遺伝子群の調節因子として発見された。のちにDNAが巻き付いているヒストンタンパク質のメチル化、ユビキチン化の活性を持つことが分かり、遺伝子の発現を抑制することが知られている。なお、核内のDNAは、主にヒストンと呼ばれるタンパク質によってコイル状構造を形成し、コンパクトに収納されている。このDNAとヒストンタンパク質からなる構造の単位をクロマチンと呼ぶ。 - 3.領域特定化
未分化な細胞群が、発生が進むにつれて、将来的に組織もしくは器官のどの部分を形成するようになるかがある程度決まること。 - 4.基部先端部軸
四肢の肩から指先にかけての軸。前肢の骨格は、肩側から柱脚〔上腕骨〕、軛脚(やっきゃく)〔橈骨(とうこつ)・尺骨〕、自脚〔手根骨・中手骨・指〕から構成されている。 - 5.Meis2遺伝子
Meis遺伝子はMeis myeloid ecotropic insertion siteの略で、白血病の原因遺伝子の1つとして発見された。ショウジョウバエにおけるホメオティック遺伝子群の補助因子として知られる homothorax遺伝子のホモログ(構造が良く似た遺伝子)で、TALE(three amino acid loop extension)ホメオボックス遺伝子で、転写調節因子の1つ。近年、ホメオティック遺伝子群以外の多くの転写調節因子(HLH、Znフィンガーなど)とも複合体を形成することが判明した。哺乳動物には Meis1、Meis2、Meis3が存在する。 - 6.基部化シグナル
肢芽の基部側の領域特定化に重要なシグナル。体幹部から分泌され、肢芽の形成に不可欠のレチノイン酸シグナルが代表的なものとして考えられている。 - 7.ノックアウト
遺伝子工学の手法により、人為的にある遺伝子を欠失させること。 - 8.先端部化シグナル
肢芽の先端部側の領域特定化に重要なシグナル。肢芽先端部の外胚葉から分泌されるFGFシグナルが挙げられる。 - 9.ES細胞、iPS細胞
ES細胞は、受精卵が分化してできた発生初期の胚の細胞から作られ、すべての細胞に分化する能力を持つ。iPS細胞は、線維芽細胞などの分化細胞に、3~4個の転写因子を導入するなどして作られた多分化能を持つ細胞。ES細胞のように、あらゆる細胞に分化する能力がある。ES細胞が抱える倫理的問題を解決できると考えられており、また患者自身の細胞から作ることができるので、iPS細胞から分化した細胞を患者に移植しても拒絶反応が起きにくいと考えられている。

図1 マウス17.5日胚における前肢の骨の形態
左:野生型の前肢の骨の形態。左から肩甲骨、柱脚(上腕骨)、軛脚(橈骨・尺骨)、自脚部(手根骨・中手骨・指)を示している。四肢のもっとも基部側が柱脚、もっとも先端部側が自脚部である。
中:Ring1B変異欠失型。矢頭が示すように、軛脚(やっきゃく)の骨が著しく短くなっている(▲部分)。指の彎曲(わんきょく)も見られる。
右:Ring1A/B変異欠損型(Ring1AとRing1Bの両方を欠損させたもの)。肩甲骨に相当すると考えられる矮小な骨片と、柱脚から自脚にかけて不完全に形成されたと考えられる骨片が観察される。
※スケールバーは全て1mm
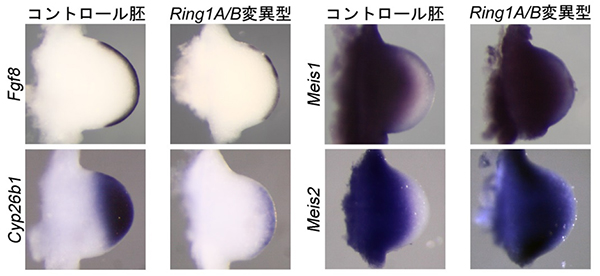
図2 マウス肢芽(10.5日胚)における遺伝子の発現比較
左:先端部側で強く発現するFgf8およびCyp26b1遺伝子の比較。青紫色で染まった部分が遺伝子の発現領域を示している。コントロール胚に対して、Ring1A/B変異欠損型(Ring1AとRing1Bの両方を欠損させたもの)ではどちらの遺伝子も発現が著しく減少している。
右:基部側で強く発現するMeis1およびMeis2遺伝子の比較。コントロール胚に対して、Ring1A/B変異欠損型では、どちらの遺伝子も発現領域が先端部側へと拡大している。
(肢芽は各写真の左側が基部側、右側が先端部側をそれぞれ示している)
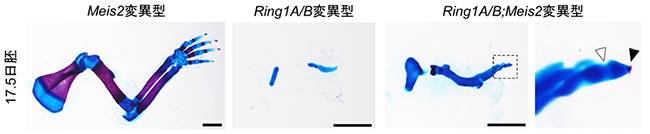
図3 部分的に形態異常が回復しているマウス17.5日胚のRing1A/BおよびMeis2変異欠損型
左:Meis2変異欠失型の前肢の形態。野生型とほとんど変わらない。
中:Ring1A/B変異欠失型(Ring1AとRing1Bの両方を欠損させたもの)。図1の右と同じ写真。肩甲骨に相当すると考えられる矮小な骨片と、柱脚から自脚にかけて不完全に形成されたと考えられる骨片が見られる。
右:Ring1A/BおよびMeis2変異欠失型(Ring1A、Ring1B、Meis2の全てを欠損させたもの)。左側のRing1A/B変異欠損型よりも、骨の形態異常が部分的に回復している。四角の点線部分内を拡大すると、指の分節化(白い矢頭)と指骨の骨化(黒い矢頭で示した赤い部分)が見られる。
※スケールバーは全て1mm
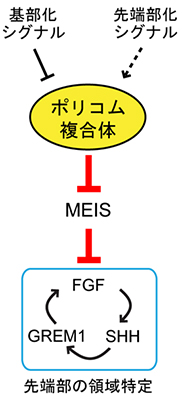
図4 ポリコム複合体が寄与する基部先端部軸の決定メカニズム
マウスの肢芽の形成過程において、先端部の領域特定化に関与するFGFシグナルはSHHとGREM1と呼ばれる別のタンパク質と相互作用して、先端部領域の形成を進めていく。
このプログラムは、肢芽の基部側ではMeis遺伝子によって抑制されるが、将来的に先端部領域が形成されるところでは、このMeis遺伝子の抑制作用がポリコム複合体によって無効化されるため、先端部の形成が正常に推し進められていく。ポリコム複合体によるMeis遺伝子の抑制機能は、基部化シグナルと先端部化シグナルからそれぞれ抑制、もしくは活性化されていると考えられる。
