要旨
理化学研究所(理研)統合生命医科学研究センター循環器疾患研究グループの尾崎浩一上級研究員、田中敏博グループディレクターらの共同研究グループ※は、虚血性心疾患(CAD:Coronary Artery Disease)の発症に関連する新たな一塩基多型(SNP)[1]を同定しました。このSNPによるFLT1遺伝子[2]の発現上昇が、冠動脈血管における炎症性接着分子群[3]の発現を誘導することで、CADの発症につながっている可能性があります。
狭心症や心筋梗塞などのCADは、生活習慣病の中でも特に重い症状を示し、日本における死因の上位を占めます。また、CADの発症には遺伝的要因と環境因子が複雑に関係しています。したがって、遺伝的要因を発見し、疾患発症における役割を解明することは、適切な予防法や治療薬の開発に貢献できると考えられます。
共同研究グループは、近年、欧米人におけるSNPを用いたゲノムワイド関連解析[4]により新たに同定されたCADの発症に関わる15のCAD座位(ゲノム上の任意の領域)について、日本人CAD患者7,990人、非患者6,852人のDNAを用いて再検証解析を行いました。その結果FLT1遺伝子内の1つのSNPが、日本人においてもCADの発症と非常に強い関連を示すことを確認しました。このFLT1遺伝子領域を解析したところ、欧米人において発見されていたSNPよりもさらにCADとの関連が強いSNPを発見され、それがFLT1遺伝子の発現を上昇させることが分かりました。また、FLT1遺伝子の発現変化が冠動脈血管などの炎症性接着分子の発現に影響を与えること、FLT1タンパク質が実際にヒト冠動脈血管の内皮細胞に発現していることから、CADの発症につながる可能性があることが分かりました。
本研究では、CADの発症に関わる新たなSNPを発見し、CAD発症メカニズムの一端を解明しました。今後、さらに詳しい解析をすることより、CADの革新的な予防法や治療法の開発につながると期待できます。
本成果は、日本の科学雑誌『Journal of Human Genetics』に掲載されるのに先立ち、オンライン版(1月21日付け:日本時間1月21日)に掲載されます。
※共同研究グループ理化学研究所
統合生命医科学研究センター
循環器疾患研究グループ
グループディレクター 田中 敏博(たなか としひろ)
上級研究員 尾崎 浩一(おざき こういち)
客員研究員 尾内 善広(おのうち よしひろ)
研修生 今田 安津子(こんた あつこ)
統計解析研究チーム
客員研究員 高橋 篤(たかはし あつし)
医科学数理研究グループ
グループディレクター 角田 達彦(つのだ たつひこ)
テクニカルスタッフⅠ 森園 隆(もりぞの たかし)
統合生命医科学研究センター
副センター長 久保 充明(くぼ みちあき)
東北大学 循環器内科
准教授 坂田 泰彦(さかた やすひこ)
大阪大学 循環器内科
助教 砂 真一郎(すな しんいちろう)
東京大学 循環器内科
教授 小室 一成(こむろ いっせい)
東京医科歯科大学 人体病理学分野
教授 江石 義信(えいし よしのぶ)
背景
心臓は心筋と呼ばれる筋肉からできており、心筋の周りには心臓に酸素や栄養を送る冠動脈が通っています。狭心症や心筋梗塞などの虚血性心疾患(CAD:Coronary Artery Disease)は、冠動脈の内側に粥状動脈硬化(プラーク)が発生することにより始まります。プラークが蓄積して血管の一部が狭くなり、心筋に行く血液量が不足すると狭心症、何かの原因でプラークが破れて血栓ができ、血流が止まって心筋に血液が行かなくなると心筋梗塞が発症します。このように、CADは心筋への血流不足による心機能の低下が原因で発症します。
プラークの発生、進展にはさまざまな要因があるとされていますが、根本的な発症メカニズムは解明されていません。一方で、CADの発症には環境的要因に加え、遺伝的因子が深く関係することも、近年の解析により明らかになってきました。遺伝的因子を詳しく解析することは発症メカニズムの解明のみならず、新たな予防法や治療法の開発に大きく貢献すると考えられます。
本研究では、機能的疾患感受性を持つ新たなSNPの同定、および関連分子の発症メカニズムへの影響を解明すべく、近年欧米人におけるSNPを用いたゲノムワイド関連解析により同定された新しいCAD座位について、日本人での再検証解析を行いました。そして、統計学的に強い関連を示したCAD座位について、詳細な解析を行いました。
研究手法と成果
共同研究グループは、欧米人で新たに同定された15個のCAD座位について、Biobank JapanおよびOACIS(Osaka Acute Coronary Insufficiency Study、大阪急性冠症候群研究会)により収集された日本人のCAD患者7,990名、非患者6,582名のDNAを用いてゲノムワイド関連解析による再検証解析を行いました。その結果、FLT1遺伝子内のSNPの「偶然にそのようなことが起こる確率(P値)」は5.98×10-8となり、日本人CADと非常に強い関連を示すことが分かりました。このほかに、EDNRA遺伝子[5]およびFURIN遺伝子[6]内のSNPも日本人CADと有意な関連(P=2.07×10-4および2.08×10-3)を示すことが分かりました。
日本人CADと非常に強い関連を示したFLT1遺伝子領域については、さらに詳しいゲノムワイド関連解析を進めました。その結果、欧米人で見つけられたSNPのP値(P=5.98×10-8)よりもはるかに強い関連(P=2.85 x 10-12)を示す別のSNPを同定しました。in vitro(試験管など人為的に制御された環境下)の解析により、このSNPがリスク型[7]のとき、FLT1遺伝子の発現量が上昇することを発見しました。さらに、FLT1遺伝子の発現変動により血管における炎症性接着分子の発現が変化することや、ヒト解剖検体を用いた免疫染色[8]により、実際にFLT1タンパクがヒト冠動脈の中で血管内皮細胞特異的に発現(図1)していることを発見しました。
今後の期待
今回の研究結果は、SNPによるFLT1遺伝子の機能変化がCADの発症、進展に重要な役割を担う可能性を示しました。今後、FLT1遺伝子を対象にさらなる分子医科学解析を行うことにより、CADの原因解明が進むことが期待できます。また、薬学的アプローチを組み合わせることにより、新たな治療法や予防法の開発につながる可能性が考えられます。
原論文情報
- Atsuko Konta, Kouichi Ozaki, Yasuhiko Sakata, Atsushi Takahashi, Takashi Morizono, Shinichiro Suna, Yoshihiro Onouchi, Tatsuhiko Tsunoda, Michiaki Kubo, Issei Komuro, Yoshinobu Eishi, and Toshihiro Tanaka, "A functional SNP in FLT1 increases risk of coronary artery disease in a Japanese population", Journal of Human Genetics, doi: 10.1038/jhg.2015.171
発表者
理化学研究所
統合生命医科学研究センター 循環器疾患研究グループ
上級研究員 尾崎 浩一(おざき こういち)
グループディレクター 田中 敏博(たなか としひろ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.一塩基多型(SNP)
ヒトゲノムの個人間の違いのうち、集団での塩基置換、挿入、欠失頻度が1%以上のものを遺伝子多型と呼ぶ。一塩基多型とは一塩基(T:チミン、G:グアニン、C:シトシン、A:アデニンのどれか)が他の塩基に置換した遺伝子多型。SNPとは、Single nucleotide polymorphismの略。 - 2.FLT1遺伝子
FLT1遺伝子は、血管内皮増殖因子Vascular Endothelial Growth Factor(VEGF)受容体タンパクの1つをコードする。血管形成に深く関与するとともに、動脈硬化をはじめとする炎症性疾患の発症、進展に関与する可能性が示されている。 - 3.炎症性接着分子群
血管内皮細胞や白血球、マクロファージなどの炎症性細胞表面に存在するタンパク質。細胞同士を接着させる機能を持ち、種々の炎症性タンパク質を誘導する。 - 4.ゲノムワイド関連解析
遺伝子多型を用いて疾患感受型遺伝子を見つける方法の1つ。ある疾患の患者とその疾患にかかっていない被験者の間で、多型の頻度に差があるかどうかを統計的に検定して調べる。検定の結果得られたP値(偶然にそのような事が起こる確率)が低いほど、関連が強いと判定できる。 - 5.EDNRA遺伝子
強力な血管収縮作用を持つエンドセリン(21個のアミノ酸からなるペプチド)の細胞膜受容体タンパクの1つをコードする遺伝子。血管収縮作用だけではなく、炎症にも深く関与していることが知られている。 - 6.FURIN遺伝子
カルシウム依存性のセリンエンドプロテアーゼ(活性中心にセリン残基を持ち、タンパク質分子のペプチド結合を加水分解する酵素。カルシウムがないと働かない。)タンパクをコードする遺伝子。 FURIN遺伝子はPCSK9(proprotein convertase subtilisin/kexin9)ファミリーに属する。PCSK9ファミリーは、そのアンタゴニスト(受容体に結合しても反応を引き起こさない物質)が強力な抗高脂血症作用を示すことが近年示されている。 - 7.リスク型
SNPの頻度を疾患集団と非疾患集団で比べたとき、疾患集団で多いSNP型をリスク型と呼ぶ。 - 8.免疫染色
細胞や組織におけるタンパク質を検出するために広く用いられる手法。抗体の持つ特性を利用するため、免疫染色と呼ばれる。検出したいタンパク質に対する抗体(一次抗体)を作製し、ホルマリンなどで固定した組織や、その切片に抗体を反応させる。すると抗体は、目的タンパク質にのみ結合する。抗体をあらかじめ蛍光色素などでラベルしておけば、タンパク質の存在するところだけが蛍光などを発するので、組織の中のどの細胞がそのタンパク質を発現しているか、あるいは細胞の中のどこにタンパク質が局在しているかを知ることができる。より広く用いられる方法としては、抗体を認識する抗体(二次抗体)を蛍光色素などでラベルして、一次抗体と反応させ、蛍光を顕微鏡などで検出する。
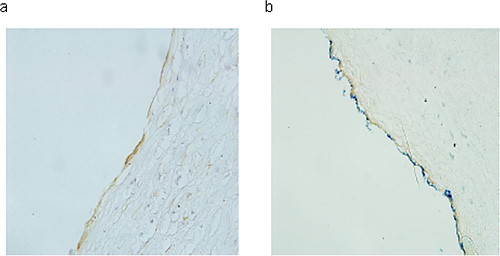
図1 FLT1タンパク質のヒト冠動脈切片における免疫染色
a)抗FLT1抗体による染色、連続的に茶色に染色された部分が血管内皮細胞におけるFLT1タンパク質の染色。
b)抗CD31抗体(血管内皮細胞特異的マーカータンパク質、青色)とFLT1タンパク質(茶色)の二重染色像。どちらも同じ場所に染色されていることが分かる。つまり、FLT1タンパク質は血管内皮細胞特異的に発現することを示している。
