要旨
理化学研究所(理研)グローバル研究クラスタ疾患糖鎖研究チームの飯島順子研究員(研究当時)、小林聡研究員(研究当時)、北爪しのぶ副チームリーダー、谷口直之チームリーダーらの共同研究チーム※は、自然免疫[1]反応において、さまざまな病原体を認識し重要な役割を果たすToll様受容体4(TLR4)の働きが、たった一つの糖の有無で大きく変わることを見いだしました。
哺乳類の免疫機能は、主に自然免疫と獲得免疫[1]に分類されます。主にリンパ球[2]の働きによる獲得免疫は抗原特異的な抗体を作ることで、病原体を特異的に認識し排除します。また、自然免疫を担うマクロファージ[3]はToll様受容体(TLR)[4]が病原体を特異的に認識し、排除することが分かってきました。一方、インフルエンザウイルスなど重篤な病気をもたらす病原体は、宿主細胞の糖鎖[5]を介して感染することが知られています。このように、TLRを介する自然免疫と糖鎖を介する感染機構のそれぞれが、生体において重要な役割を果たしています。しかし、両者の関係を理解する「TLRを介する自然免疫での糖鎖の機能」は分かっていませんでした。
今回、共同研究チームはTLR4を介する自然免疫での糖鎖の役割を明らかにするために、「コアフコース[6]」という糖に着目しました。コアフコース欠損細胞を用いて、TLR4のリガンド[7]であるリポ多糖(LPS)[8]で刺激したところ、2種類のTLR4シグナル伝達経路のうちTRIF依存的経路を介するインターフェロン-β(IFN-β)[9]の産生が特異的に抑制されることを見いだしました。これは、細胞表面に存在するTLR4/MD2複合体の細胞内への取り込みが抑制されたためと考えられます。すなわち、コアフコースが自然免疫における病原体センサーTLR4のシグナルを介した感染防御に必須であることが明らかになりました。
IFN-βは免疫機能を活性化し感染防御に重要な役割を果たすとともに、免疫活性による腫瘍増殖抑制作用も報告されています。今後、その分泌メカニズムをより詳しく解明することで、感染症や腫瘍に対する効率のよい治療法の開発につながると期待できます。
本研究は、英国の科学雑誌『Glycobiology』(8月29日号)に掲載されました。
※共同研究チーム
理化学研究所 グローバル研究クラスタ システム糖鎖生物学研究グループ
疾患糖鎖研究チーム
研究員(研究当時) 飯島 順子(いいじま じゅんこ)(現 客員研究員)
研究員(研究当時) 小林 聡(こばやし さとし)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
チームリーダー 谷口 直之(たにぐち なおゆき)
東京大学 医科学研究所
教授 三宅 健介(みやけ けんすけ)
背景
哺乳類の免疫機能は、主に自然免疫と獲得免疫に分類されます。主にリンパ球の働きによる獲得免疫は、抗原特異的な抗体の産生により病原体を特異的に認識し排除します。また、自然免疫を担うマクロファージはToll様受容体(TLR)が病原体を特異的に認識し排除することで感染防御が成立することが分かってきました。
TLRは、ショウジョウバエの発生における背腹軸の決定に必須の因子Tollとしてクローニングされた分子です。哺乳類においてもその存在が明らかとなり、さまざまな病原体が持つ特有の分子を検知して自然免疫を作動させることが分かっています。ヒトでは10種類(TLR1~10)が存在し、それぞれのTLRを活性化するウイルスや細菌などのリガンドが同定されています。
この中でTLR4は、細菌の外膜成分であるリポ多糖(LPS)などを認識します。TLR4がその機能を発揮するためには、多くの補助因子が必要です。まず、LPSが細胞膜上のCD14[10]に運ばれた後、LPSはTLR4とMD2の複合体と結合します。MD2はTLR4の細胞外部分に会合しTLR4と共役してLPSを認識する分子です。その後、TLR4/MD2複合体は2種類のシグナル伝達経路をたどります。一つは、細胞表面でアダプター分子のMyD88を介する経路でインターロイキン-6(IL-6)[11]などの炎症性サイトカイン[12]の発現を誘導します(MyD88依存的経路)。もう一つは、CD14依存的に細胞内に取り込まれたTLR4/MD2複合体に対するアダプター分子のTRIFを介する経路で、インターフェロン-β(IFN-β)を誘導します(TRIF依存的経路)。
一方、インフルエンザウイルスなど重篤な病気をもたらす病原体は宿主細胞の糖鎖を介して感染することが知られており、病原体の感染機構や感染防御を明らかにする上で、糖鎖が重要だと考えられます。
このように、TLRを介する自然免疫と糖鎖を介する感染機構のそれぞれが、生体において重要な役割を果たしています。一方、両者の関係を理解したTLRを介する自然免疫での糖鎖の機能は分かっていませんでした。そこで共同研究チームは、「TLR4を介する自然免疫での糖鎖の役割」を明らかにすることを試みました。
研究手法と成果
糖鎖は細胞の中で、糖転移酵素の働きにより糖が鎖状につながることで合成されます。この糖鎖は細胞表面上にあるタンパク質の表面を修飾しタンパク質の機能を調整するため、生命活動に不可欠であることが分かっています。
共同研究チームはTLR4を介する自然免疫での糖鎖の役割を明らかにするために、「コアフコース」という糖に着目しました。コアフコースは、N型糖鎖[13]の根元にある糖のN-アセチルグルコサミンに付加されたフコースのことです。また、コアフコースを合成する酵素をFut8[6]と呼びます(図1)。谷口直之チームリーダーらは2005年、Fut8欠損マウス(コアフコース欠損マウス)では成長遅延や肺気腫などの重篤な症状を示すなど、コアフコースが生体において重要な役割を果たすことを報告しました注)。
共同研究チームは、コアフコース欠損マウスは致死率が高く解析が困難なため、TLR4シグナルにおけるコアフコースの機能をコアフコース欠損マウスの胎児線維芽細胞(MEF細胞)を用いて調べました。まず、TLR4のリガンドであるLPSに対する反応性を検討するため、炎症性サイトカインの分泌を測定しました。その結果、コアフコース欠損MEF細胞では、LPS刺激後にTLR4シグナル伝達経路の一つMyD88依存的経路で発現誘導されるIL-6は正常に分泌されましたが、TRIF依存的経路で誘導されるIFN-βの分泌は抑制されることが分かりました(図2)。また、IFN-βの発現はmRNAの転写レベルで抑制されていることを確認しました。
次に、MyD88依存的経路とTRIF依存的経路のTLR4シグナルに必要なTLR4/MD2複合体の形成やLPSの結合を調べました。その結果、コアフコースの有無に関わらず、どちらの経路もTLR4/MD2複合体の形成やLPSの結合が観察されました。また、MyD88依存的経路にも異常がみられないことから、TRIF依存的経路に着目し、LPS刺激に対する反応性を調べました。TRIF依存的経路によるIFN-βの分泌には、CD14依存的なTLR4/MD2複合体の細胞内への取り込みが必要であることから、LPS刺激前後の細胞表面上のCD14、TLR4/MD2複合体、TLR4の量の動態変化を測定しました。
その結果、野生型MEF細胞ではLPS刺激に反応して細胞表面上の発現量が著しく低下したのに対し、コアフコース欠損MEF細胞では細胞表面上の発現量の変化が抑制されました。このことより、LPS刺激に対するCD14、TLR4/MD2複合体、TLR4の細胞内への取り込みがコアフコース欠損により抑制されることが分かりました(図3)。
また、ヒト胎児由来腎臓上皮細胞(293T細胞)を用いて、TLR4、MD2、CD14上のコアフコース修飾の有無を調べました。コアフコースを特異的に検出するレクチン[14]を用いて調べたところ、CD14がコアフコースで修飾されていることが分かりました(図4)。
さらに、コアフコース欠損細胞では、定常時(LPS刺激なし)でもCD14の細胞表面上の発現量が減少したことから、コアフコースがCD14の正常な細胞表面での発現に関わっていると考えられます。
これらの結果から、CD14上のコアフコース欠損に起因するCD14の細胞発現量低下やCD14の機能損傷は、LPSの運搬やMyD88依存的経路には影響を及ぼさないが、TRIF依存的経路を介するIFN-βの分泌を特異的に抑制する可能性が示されました。これにより、コアフコースが自然免疫におけるTLR4シグナルを介した感染防御に必須であることが分かりました(図5)。
注)Wang X, et al. “Dysregulation of TGF-beta1 receptor activation leads to abnormal lung development and emphysema-like phenotype in core fucose-deficient mice.” Proc Natl Acad Sci U S A.(No.44, 15791-6, 2005)
今後の期待
免疫応答は感染防御に必須ですが、過度の反応は自己免疫疾患[15]を引き起こします。そのため、免疫応答はバランスよく適切に行われなければなりません。コアフコースの欠損によってCD14、または別の因子がどのようにIFN-βの分泌を抑制するか、今後より詳しく調べる必要があります。特に、IFN-βは免疫機能を活性化し感染防御に重要な役割を果たすとともに、免疫活性による腫瘍増殖抑制作用も報告されています。今後、TRIF依存的経路を介したIFN-βの分泌を抑制する仕組みを解明することで、免疫応答システムの理解を深め、感染、腫瘍、自己免疫疾患などの治療法の開発が期待できます。
また、TLR4以外の他のTLRを対象に研究することで、ウイルスなどさまざまな病原体に対する効果が解明されると期待できます。
原論文情報
- Junko Iijima, Satoshi Kobayashi, Shinobu Kitazume, Yasuhiko Kizuka, Reiko Fujinawa, Hiroaki Korekane, Takuma Shibata, Shin-Ichiroh Saitoh, Sachiko Akashi-Takamura, Kensuke Miyake, Eiji Miyoshi, and Naoyuki Taniguchi, "Core fucose is critical for CD14-dependent Toll-like receptor 4 signaling", Glycobiology, doi: 10.1093/glycob/cwx075
発表者
理化学研究所
グローバル研究クラスタ システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
研究員(研究当時) 飯島 順子(いいじま じゅんこ)
研究員(研究当時) 小林 聡(こばやし さとし)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
チームリーダー 谷口 直之(たにぐち なおゆき)
 飯島 順子
飯島 順子
 小林 聡
小林 聡
 北爪 しのぶ
北爪 しのぶ
 谷口 直之
谷口 直之
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.自然免疫、獲得免疫
自然免疫は、先天的に個体に備わり、侵入してきた病原体などを認識し排除する感染初期の生体防御機構。マクロファージなどが担当する。獲得免疫は、生後に刺激を受けた病原体を記憶することで、以後同じ病原体に感染した際に病原体を効率よく排除する。主にリンパ球が担当する。 - 2.リンパ球
生体の免疫反応を担う一群の血球の総称。大きく分けて、骨髄由来で抗体を産生するB細胞と胸腺由来のT細胞がある。 - 3.マクロファージ
体内に侵入した異物を取り込み消化すること(食作用)を主な役割とする免疫細胞。マクロファージや顆粒球などの食細胞は、まとめてミエロイド系細胞とも呼ばれる。 - 4.Toll様受容体(TLR)
膜貫通型受容体で、マクロファージなどに発現し自然免疫における病原体の認識をすることで感染防御反応を誘導する。名前は、ショウジョウバエのTollと呼ばれる膜タンパクに構造が似ていることに由来している。TLRはToll-like receptorの略。 - 5.糖鎖
グルコース、ガラクトース、マンノース、N-アセチルグルコサミン、フコース、シアル酸などの単糖が、グリコシド結合と呼ばれる化学結合によりつながったもので、タンパク質や脂質を修飾し、それらの機能を調整する。タンパク質を構成するアミノ酸のうちアスパラギン(N)に結合するN型糖鎖などがある。 - 6.コアフコース、Fut8
Fut8は、糖転移酵素の一種であるα1,6-フコース転移酵素。N型糖鎖の根元のN-アセチルグルコサミンに単糖のフコースを付加する。この反応により、N型糖鎖の根元に転移されたフコースのことをコアフコースという。 - 7.リガンド
受容体と相互作用する物質のこと。 - 8.リポ多糖(LPS)
グラム陰性細菌の外膜成分で、マクロファージなどに作用して炎症性サイトカイン産生を誘導する。 - 9.インターフェロン-β(IFN-β)
免疫細胞間の情報伝達およびウイルス感染に対する防御に関与する活性分子の一つ。主に抗ウイルス作用を発揮する。また、マクロファージとNK細胞を刺激し、腫瘍細胞に対して増殖抑制作用を示す。 - 10.CD14
マクロファージなどに発現する分子で、LPSを認識しTLR4/MD2複合体にシグナルを誘導する。 - 11.インターロイキン-6(IL-6)
炎症性サイトカインの一つで、種々の炎症性疾患に関与する。免疫や炎症、造血、骨代謝の調節を行う、生体に不可欠なサイトカイン。 - 12.炎症性サイトカイン
IL-6、IFN-βなど、細胞から分泌されるタンパク質であり、細胞間相互作用に関与し炎症反応を促す生理活性物質の総称。 - 13.N型糖鎖
タンパク質のアスパラギン側鎖のアミド基の窒素(N)に結合している糖鎖。 - 14.レクチン
糖もしくは糖鎖と結合するタンパク質。植物や動物の体内に存在している。 - 15.自己免疫疾患
何らかの免疫異常によって自分の身体を構成する物質を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の組織を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。
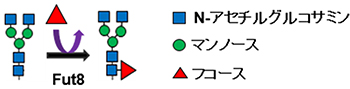
図1 糖転移酵素Fut8の機能とコアフコース
転移酵素Fut8により、単糖の一種であるフコースがN型糖鎖の根元のN-アセチルグルコサミンに付加され、コアフコースが合成される。
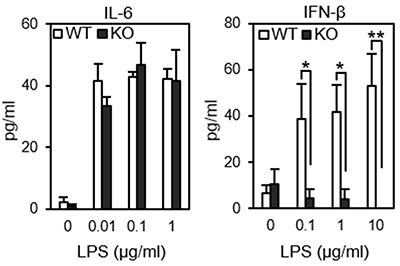
図2 野生型とコアフコース欠損細胞におけるTLR4のリポ多糖(LPS)に対する反応性
野生型(WT)、コアフコース欠損(KO)のマウス胎児線維芽細胞(MEF細胞)を各濃度のリポ多糖(LPS)で刺激しながら一晩培養した後、分泌されたそれぞれのタンパク質量をELISA法で測定した。コアフコース欠損細胞ではインターロイキン-6(IL-6)は正常に分泌されたが(左)、インターフェロン-β(IFN-β)は分泌が抑制された(右)。
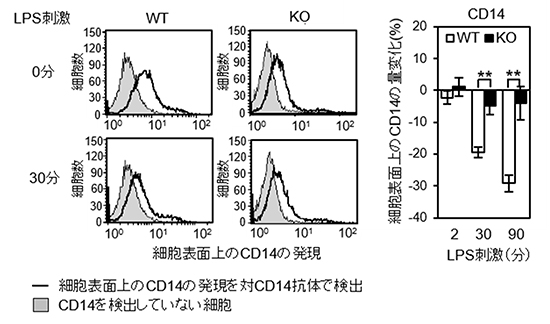
図3 野生型とコアフコース欠損細胞におけるLPS刺激による細胞表面上の量の動態変化
LPS(5μg/ml)でそれぞれ一定時間刺激した後、細胞表面上のCD14量をCD14抗体で検出した(フローサイトメトリーによる解析)。CD14の検出(黒い線)が、CD14を検出しない細胞(灰色の塗りつぶし)より右に移行するほど、細胞表面上のCD14の発現が多いことを示す。野生型細胞(WT)ではLPS刺激後、CD14が細胞内へ移行し細胞表面上で著しく減少するのに対し(左および右の棒グラフ)、コアフコース欠損細胞(KO)ではLPS刺激後の細胞内への移行が抑制された(中央および右の棒グラフ)。
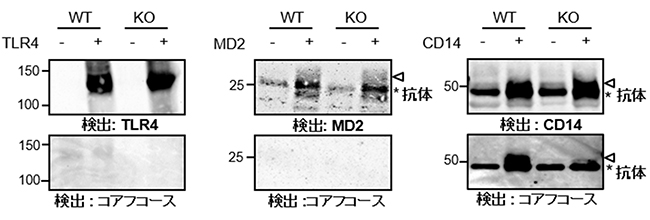
図4 TLR4、MD2、CD14上のコアフコース修飾の有無の検討
TLR4(左)、MD2(中央)、CD14(右)をヒト胎児由来腎臓上皮細胞(293T細胞)にそれぞれを発現、精製回収した後(上段)、コアフコースによる修飾の有無を調べた(下段)。▽は精製したMD2またはCD14、*は精製に用いた抗体の漏れ込み、-は対照実験としてタンパク質が発現していない細胞、+はタンパク質が発現している細胞をそれぞれ示す。野生型細胞(WT)およびコアフコース欠損細胞(KO)において、TLR4とMD2ではコアフコースの修飾が確認されなかった。CD14は、WTではコアフコース修飾が確認され、KOではコアフコース欠損が確認できた。
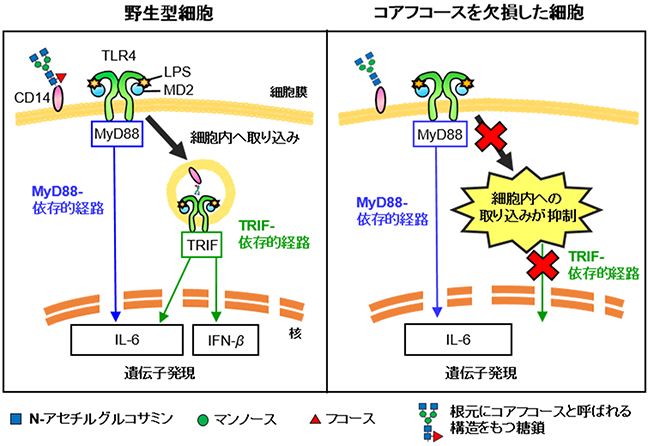
図5 LPS刺激によるIFN-βの発現に必須なコアフコース
コアフコースは細胞表面タンパク質のCD14に結合している。野生型細胞では、LPSの刺激によりMyD88依存的経路を介してIL-6が、TRIF依存的経路を介してIFN-βの発現がそれぞれ誘導される(左)。一方、コアフコース欠損細胞では、IL-6は発現するものの、TLR4/MD2複合体とCD14の細胞内への取り込みが抑制されるため、IFN-βの発現を誘導されない(右)。これらの結果から、LPS刺激によるIFN-βの発現にはコアフコースが必須であることが分かった。
