理化学研究所(理研)生命機能科学センター 呼吸器形成研究チームの藤村 崇 客員研究員、森本 充 チームリーダー、細胞システム動態予測研究チームの城口 克之 チームリーダーらの研究チームは、肺傷害の修復に関与する可能性がある新しい種類の上皮幹細胞[1]をマウスで発見しました。
本研究成果は、オルガノイド[2]を効率よく作製する手法の開発や幹細胞を移植する細胞治療に向けた研究、肺疾患の病因解明に貢献することと期待できます。
肺の細胞がウイルス感染や有害物質などにより傷害されると、上皮幹細胞がその修復・再生を担います。肺を構成する部位(気管・気管支・肺胞)ごとに再生に関与する上皮幹細胞が複数種存在すると考えられていますが、まだその全容は分かっていません。
今回、研究チームは、上皮幹細胞の一種であるクラブ細胞[3]を成体マウスの肺から取り出して一つ一つ撮影し、均一と思われたクラブ細胞の集団に外形上の個性(顔)と増殖能に違いがあることを発見しました。さらに、細胞ごとの「顔」とin vitro[4]で増殖しやすい性質、遺伝子発現パターンを結びつける新しい手法「scMORN(Single-Cell Morphometrics, Organoid-forming assay, and RNA sequencing)法」の開発により、肺胞の再生に寄与する可能性のある新しい肺の上皮幹細胞を特定し、「MLクラブ細胞」と命名しました。
本研究は、科学雑誌『Stem Cells』のオンライン版(7月20日付:日本時間7月20日)に掲載されました。
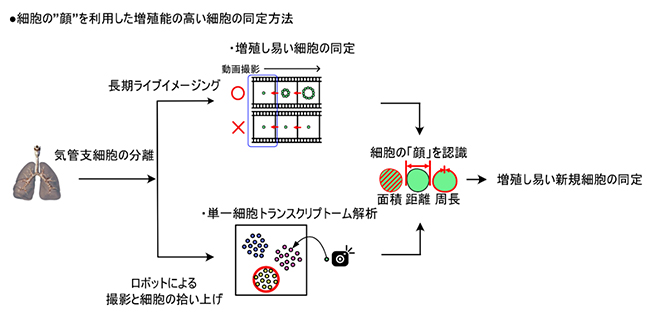
細胞の「顔」を利用した新しい幹細胞同定法「scMORN法」の概略
背景
ヒトを含む陸生動物にとって、酸素を体内に取り込む肺は生きていくために必須の臓器です。肺の細胞はコロナウイルスやインフルエンザなどの感染や、たばこなどに含まれる有害物質にさらされた際に傷害されることがありますが、上皮幹細胞によって修復・再生が促されます。肺を構成する部位(気管・気管支・肺胞)ごとに、再生に関与する上皮幹細胞が複数種類存在すると考えられていますが、まだその全容は分かっていません。また、これらの上皮幹細胞は平常時には活発に増殖せず、肺が傷害されると速やかに増殖期に入り、失われた細胞を補給するという特徴があります。そのため、平常時にどの細胞が増殖能を持っているか判断するのは困難です。
今回研究チームは、「クラブ細胞」と呼ばれる気管支の上皮幹細胞に着目しました。クラブ細胞は気管支に存在し、粘液を分泌したり幹細胞として働いたりすることで、主に気管支の恒常性の維持[5]に関与していると考えられています。一方、肺胞が傷害されると肺胞細胞へと分化[6]し、肺胞の再生に寄与しているという先行研究もあります注1)。しかし、クラブ細胞は多様性に富んだ細胞であることから、肺傷害後に増殖して本当に肺胞領域の再生に寄与しているのは、クラブ細胞の一部(亜集団)である可能性が指摘されていました。
そこで、研究チームは新たな幹細胞同定法を開発し、マウスの肺胞領域の再生に関与するクラブ細胞の亜集団を探索することにしました。
- 注1)Kathiriya, J.J., Brumwell, A.N., Jackson, J.R., Tang, X., and Chapman, H.A. (2020). Distinct Airway Epithelial Stem Cells Hide among Club Cells but Mobilize to Promote Alveolar Regeneration. Cell Stem Cell 26, 346-358.e344.
研究手法と成果
研究チームはまず始めに、複数の肺の幹細胞の培養に適したオルガノイド培養[2]という3次元培養手法を確立しました(図1A)。この方法でマウスの気管支から取り出したクラブ細胞を培養したところ、可能な限り均一な細胞集団を用いても10%程度のクラブ細胞だけが増殖し、オルガノイド(3次元の細胞塊)へと成長することが分かりました。
そこで、どのクラブ細胞がオルガノイドを形成するかを明らかにするために、10日間培地を交換しなくてもオルガノイド形成が可能な培養方法を工夫し、単一細胞がオルガノイドになるまでの形成過程を顕微鏡下で記録する長期ライブイメージングを行いました。長期ライブイメージング法により取得した動画データを巻き戻し、オルガノイドから単一細胞へとさかのぼって解析することにより、培養0日目の画像上で、どのクラブ細胞が増殖し、オルガノイドを形成したのか同定できます(図1B)。
個々のクラブ細胞の形態的特徴を、増殖能力がある細胞とない細胞に分けて解析したところ、増殖能力のある細胞の方が、細胞の面積・長径・周径など細胞のサイズに関わる測定値が有意に大きいことが分かりました(図1C)。つまり、クラブ細胞のサイズのばらつき(個々の細胞の「顔」)には意味があり、将来の増殖能力を予測する手がかりになると考えられました。
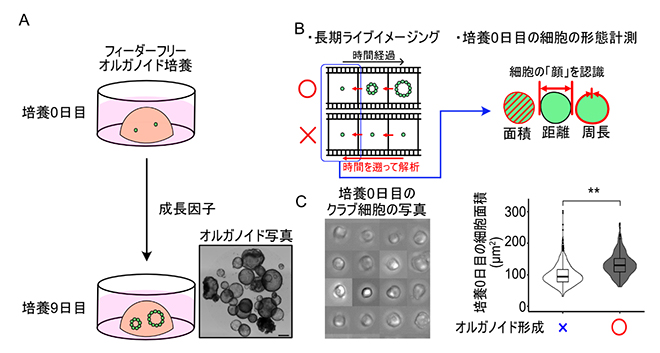
図1 オルガノイド形成過程の長期ライブイメージングによるクラブ細胞の特徴解析
- A.本研究で用いたフィーダーフリーオルガノイド培養の模式図。ライブイメージングの障害となるフィーダー細胞(上皮細胞の増殖を助ける別種類の細胞)を必要とせず、成長因子のみの添加で培養が可能。
- B.単一の細胞からオルガノイド形成までの長期ライブイメージング画像データの時間をさかのぼって、増殖した細胞としなかった細胞を特定する。培養0日目の画像を用いて、面積などの形態的特徴を解析して、増殖能と「顔」を対応させる。
- C.クラブ細胞の特徴解析の例。オルガノイドを形成した細胞(○)は、しなかった細胞(×)と比較して培養0日目の面積が有意に大きいことを示す定量結果。
次に、クラブ細胞の「顔」と遺伝子発現を対応させるために、細胞の写真撮影と単離を同時に実施できるロボットを用いて実験をしました(図2A)。ロボットで単離した一つ一つのクラブ細胞の遺伝子発現を、撮影後に単一細胞トランスクリプトーム解析[7]と呼ばれる手法で調べました。すると、均一と思われたクラブ細胞の集団には、異なる三つの特徴を持つ細胞群が存在し、一つは混入した2型肺胞上皮細胞[8]、残り二つは2種類のクラブ細胞(#1、#2)が含まれることが分かりました(図2B)。
それぞれの細胞集団の形態を解析すると、クラブ細胞#2がクラブ細胞#1よりも有意に大きいことが判明したため、以後このクラブ細胞#2を詳しく解析することにしました。クラブ細胞#2は粘液の構成タンパク質の一つであるMuc5b(ムチン5B遺伝子)を特異的に発現し、大きい(Large)形態的特徴を持つことから、研究チームはクラブ細胞#2を「MLクラブ細胞」と命名しました(図2C)。さらに、MLクラブ細胞はCD14という膜タンパク質を細胞の表面に発現しており、この因子に対する抗体(抗CD14抗体)を用いることで他の細胞集団から分取できることも分かりました。
一連の解析方法を、in vitroにおける新たな幹細胞同定法「scMORN法(Single-Cell Morphometrics, Organoid-forming assay, and RNA sequencing)」として確立しました。
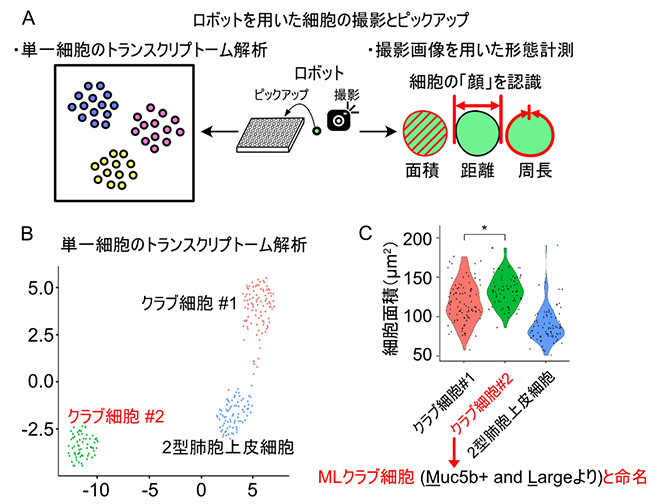
図2 単一細胞トランスクリプトーム解析で分類したクラブ細胞の形態的特徴
- A.実験の概要図。ロボットを用いて細胞の「顔」を撮影後、96穴のプレートに細胞を一つずつピックアップして、単一細胞トランスクリプトーム解析を行った。撮影した画像を用いた1細胞形態計測により、トランスクリプトームデータと細胞の顔を対応させた。
- B.クラブ細胞集団の単一細胞トランスクリプトーム解析結果。均一と思われた細胞集団には、遺伝子発現パターンで区別できる2種類のクラブ細胞(クラブ細胞#1、#2)および2型肺胞上皮細胞が含まれていた。
- C.単一細胞トランスクリプトーム解析で分類された細胞の細胞面積の定量結果。クラブ細胞#2はクラブ細胞#1より有意に大きな面積を持ち、Muc5b(ムチン5B)遺伝子を発現することから、「MLクラブ細胞」と名付けられた。
このMLクラブ細胞が肺のどこに存在するのかを明らかにするために、MLクラブ細胞が持つMUC5Bタンパク質に対する抗体などを用いて、マウス肺の切片を免疫組織染色法[9]で観察すると、気管支の中でも近位(気管に近い側)に多く局在することが分かりました。単一細胞トランスクリプトーム解析および局在解析の結果から、MLクラブ細胞は既報の肺胞細胞へと分化する幹細胞集団とは異なり、新しい細胞集団であることが示されました(図3)。
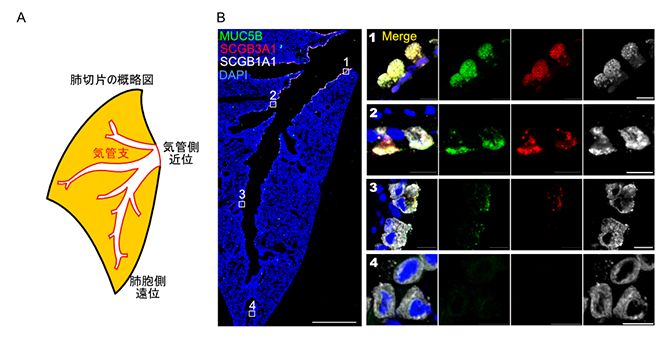
図3 MLクラブ細胞のマウス肺における局在
- A.マウス肺の切片の概略図。赤線が気管支(空気の通り道)を示す。気管側を近位、肺胞側を遠位と呼ぶ。
- B.野生型マウスの肺の免疫組織染色像。緑色:MLクラブ細胞マーカー(MUC5B)、赤色:MLクラブ細胞マーカー(SCGB3A1)、白色:全クラブ細胞マーカー(SCGB1A1)、青色:核染色(DAPI)。全クラブ細胞マーカーは気管支の近位から遠位(1~4)にかけて染色が見られるが、MLクラブ細胞マーカーは近位側(1、2)に強く局在し、遠位側(3、4)に少ない。左図の白色バーは1mmを、拡大図の白色バーは10μmをそれぞれ示す。
さらにMLクラブ細胞が、増殖能が高く、肺胞細胞へと分化する能力を持っているのかを再度検証するために、抗CD14抗体で分取したMLクラブ細胞を用いて、オルガノイド培養法および薬剤傷害させたマウス肺への細胞移植実験を行いました。気管支を近位と遠位に分けた後、抗CD14抗体を用いて細胞を分取し、それぞれのオルガノイドの形成効率を検証しました(図4A)。すると、MLクラブ細胞が多く局在する近位の細胞集団の方が、高効率でオルガノイドを生じることが確認できました(図4B)。また、このオルガノイドの細胞が分化すると、肺上皮のような組織形態をもつ肺上皮オルガノイドに変化しました。
培養した肺上皮オルガノイドが何の細胞に分化するかを検証すると、培養9日目の肺上皮オルガノイドでは、同一のオルガノイド内に全クラブ細胞マーカー、2型肺胞上皮細胞マーカー、MLクラブ細胞マーカーの発現を認めました。さらに分化を促進させた培養12日目には、肺胞にしか存在しない1型肺胞上皮細胞[8]マーカーが発現することを確認しました(図4C)。この結果は、MLクラブ細胞が気管支細胞であるクラブ細胞だけではなく、肺胞の細胞へと分化する能力を持つことを示しています。
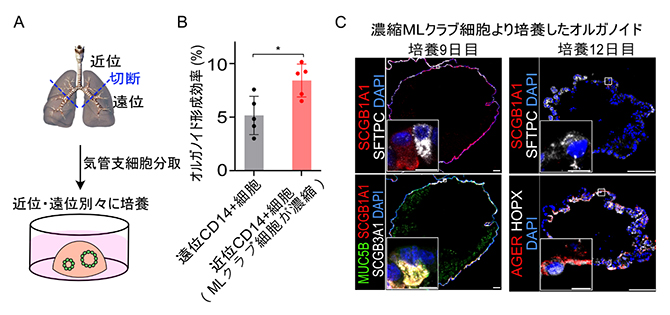
図4 in vitroにおけるMLクラブ細胞の増殖能と分化能の検証
- A.マウス肺を切断し、近位と遠位の気管支細胞を分取し別々にオルガノイド培養を行った実験の概要図。
- B.遠位CD14+細胞と近位CD14+細胞(MLクラブ細胞がより濃縮)のオルガノイド形成効率の定量結果。近位CD14+細胞のオルガノイド形成効率が有意に高い。
- C.濃縮MLクラブ細胞(近位CD14+細胞)由来オルガノイドの免疫組織染色像。左パネルは培養9日目、右パネルは培養12日目の結果。培養9日目のオルガノイドでは、MLクラブ細胞マーカー(SCGB3A1、MUC5B)と全クラブ細胞マーカー(SCGB1A1)の強い発現が観察された(左上パネルおよび左下パネル)。培養12日目になると、全クラブ細胞マーカー(SCGB1A1)の発現は減衰し、2型肺胞上皮細胞マーカー(SFTPC)あるいは1型肺胞上皮マーカー(AGER、HOPX)を発現する細胞が現れた(右上パネルおよび右下パネル)。全てのパネルに共通して青色は核染色を示す。図の白色バーは100μmを、拡大図の白色バーは10μmをそれぞれ示す。
最後に、薬剤で肺を傷害したマウスに、MLクラブ細胞、非MLクラブ細胞、2型肺胞上皮細胞をそれぞれ移植し、傷害肺における増殖能と分化能を評価しました(図5A)。移植した3種の細胞はいずれも傷害した肺に生着しましたが、濃縮MLクラブ細胞が生着細胞の集団(クラスター)を形成する能力が高い傾向を示し、かつ1クラスター当たりの細胞数が最も多い結果となりました(図5B、C)。さらに、クラスターを形成したMLクラブ細胞の一部は、2型肺胞上皮細胞マーカーおよび1型肺胞上皮細胞マーカーを発現することも分かりました(図5D)。これらの結果は、傷害した肺において、MLクラブ細胞が効率的に生着および増殖し、肺胞を構成する2種の上皮細胞を供給する能力があることを示しています。
以上の結果から、本研究で同定されたMLクラブ細胞は、高い増殖能力を持ち、気管支の細胞でありながら肺胞細胞へと分化する能力を持つクラブ細胞の新しい亜集団であり、新しい肺の上皮幹細胞であると結論付けました。
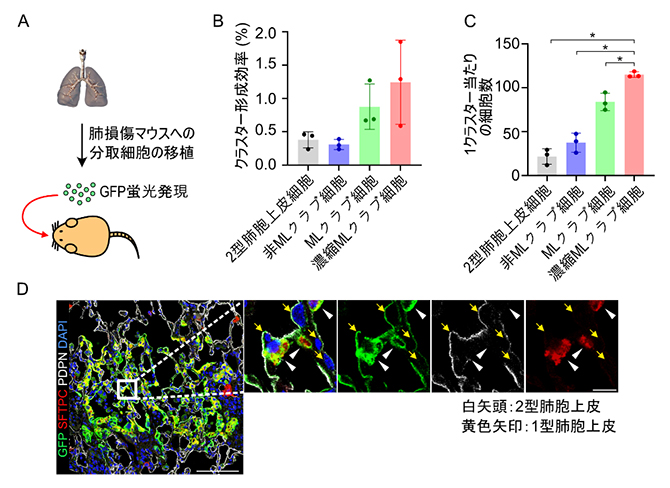
図5 in vitroにおけるMLクラブ細胞の増殖能と分化能の検証
- A.正常マウス肺から4種類の細胞(2型肺胞上皮細胞、CD14-細胞(非MLクラブ細胞)、CD14+細胞(MLクラブ細胞)、近位CD14+細胞(濃縮MLクラブ細胞))を別々に分取し、薬剤により肺を傷害したマウスに移植する実験の概略図。移植細胞はGFPと呼ばれる蛍光タンパク質を発現するように改変してあるため、生着した細胞はこの蛍光タンパク質を目印に判別がでる。
- B.移植した各細胞のクラスター形成効率の定量結果。クラスターとは、生着した細胞が増殖し周辺に集まったDのような状態を示す。
- C.移植した各細胞の1クラスター当たりの細胞数の定量結果。クラスター内の細胞数が多いほど、生着した細胞が効率よく増殖したことを示す。
- D.傷害肺に生着したMLクラブ細胞の分化能力を示す免疫組織染色像。濃縮MLクラブ細胞を移植したサンプルの観察例を示す。緑色:GFP蛍光タンパク質(移植された細胞の目印)、赤色:2型肺胞上皮細胞マーカー、白色:1型肺胞上皮マーカー、青色:核染色。一番左図の白色バーは50μmを、拡大図の白色バーは10μmを、黄色矢印は移植した細胞が1型肺胞上皮細胞へと分化したことを、白色矢頭は移植した細胞が2型肺胞上皮細胞へと分化したことをそれぞれ示す。
今後の期待
本成果は、幹細胞研究および医療応用の両面で、今後の発展が期待できます。今回確立した幹細胞同定法である「scMORN法」を肺以外の臓器にも適用できれば、これまでに知られていなかった幹細胞が新たに発見されるかもしれません。また、効率的に肺へ生着し増殖可能な上皮幹細胞がヒトに存在すれば、幹細胞そのものを利用した細胞治療の可能性も考えられます。実際に、単一細胞トランスクリプトームデータより、ヒトにもマウスMLクラブ細胞と相同と見られる細胞が見つかっています。
MLクラブ細胞集団は正常な肺の再生に寄与する可能性がある一方、MLクラブ細胞の特徴であるMUC5Bタンパク質の過剰な産生は、肺疾患の一つである肺線維症[10]との関連が指摘されています。マウスMLクラブ細胞の解析をさらに進めることで、肺線維症の基礎的理解や薬剤開発への発展が期待できます。
補足説明
- 1.上皮幹細胞
上皮細胞とは体表や管腔の表面を覆っている細胞。分泌などさまざまな生理機能を持つとともに、表面を覆うことで物理的または化学的なバリアとなる。幹細胞は分裂しながら増殖する能力を持ち、固有の機能を持つ細胞である「分化細胞」を生み出す能力を持つ細胞のこと。 - 2.オルガノイド、オルガノイド培養
3次元的に幹細胞や前駆細胞を培養する方法(オルガノイド培養)により、人工的に作製した細胞塊の中に幹細胞だけでなく分化細胞を含み、由来する組織や胚の機能を部分的に持つ「ミニ臓器」をオルガノイドと呼ぶ。培養されたオルガノイドは、薬剤のスクリーニングなどの創薬応用や、再生医療のソースとしての応用が期待されている。 - 3.クラブ細胞
気管や気管支の上皮を構成する細胞の一種。粘液を分泌するドーム型の細胞。幹細胞能を持ち、自己複製することができて、分化細胞である線毛細胞を供給することもできる。 - 4.in vitro
イン・ビトロと読む。本来は「試験管内で」を意味するが、ここでは培養皿などの中で人工的に培養した細胞を使った実験を指す。 - 5.恒常性の維持
恒常性とは生物において、その内部環境を一定の定常状態へと保とうとする性質のことである。何かのきっかけで細胞が失われた場合、細胞を再び生み出したり、別の細胞が機能を代替したりして、失われた機能を維持しようとすることを、恒常性の維持と呼ぶ。肺の恒常性維持において、クラブ細胞の分泌する粘液は、気管支に侵入した異物の殺菌、解毒や、呼気に適切な湿度を与える、細い気管支(細気管支)の癒着を防ぐなどの機能を果たす。 - 6.分化
幹細胞や前駆細胞が分裂し、機能を持つ娘細胞を生み出すこと。なお、本研究におけるクラブ細胞のように、特定の機能を持つ細胞が別の機能を持つ細胞(本研究では肺胞細胞)に分化することを「分化転換」と呼ぶ場合もある。 - 7.単一細胞トランスクリプトーム解析
トランスクリプトーム解析は、遺伝子の転写産物を網羅的に解析する手法。このトランスクリプトーム解析を、対象とする組織などに対して1細胞レベルで解析する手法を単一細胞トランスクリプトーム解析と呼ぶ。細胞集団に対する解析では、複数の細胞の平均的なデータしか得られないのに対し、個々の細胞が発現する遺伝子の種類とその発現量のデータを用いることで、詳細な細胞種の分類やシグナル解析などが可能になる。 - 8.2型肺胞上皮細胞、1型肺胞上皮細胞
肺の末梢に存在する肺胞は、1型と2型の2種類の上皮細胞から構成される。2型肺胞上皮細胞は肺胞の上皮幹細胞であり、分化細胞である1型肺胞上皮細胞を生み出す能力を持つ。1型肺胞上皮細胞は非常に薄い形態を持っており、肺胞内の空気中の酸素と、1型肺胞上皮の裏に位置する血管内の二酸化炭素が交換される場を提供している。 - 9.免疫組織染色法
組織内のある特定のタンパク質の局在を可視化する手法。標的タンパク質を特異的に認識する1次抗体と、1次抗体を抗原として蛍光物質などが結合した2次抗体を用いることで、抗原の局在を顕微鏡で可視化する。 - 10.肺線維症
肺胞の間質にコラーゲンなどの線維状タンパク質が異常に蓄積することで、肺胞のガス交換機能を妨げられる疾患。上皮細胞の傷害と修復の異常が原因と考えられている。
研究チーム
理化学研究所 生命機能科学研究センター
呼吸器形成研究チーム
チームリーダー 森本 充(モリモト・ミツル)
客員研究員 藤村 崇(フジムラ・タカシ)
(大塚製薬株式会社 大阪創薬研究センター 創薬モダリティ研究所 研究員)
基礎科学特別研究員(研究当時)榎本 泰典(エノモト・ヤスノリ)
(現 浜松医科大学 再生・感染病理学講座 助教)
研究員 桂 廣亮(カツラ・ヒロアキ)
テクニカルスタッフⅡ 馬場 小織(ババ・サオリ)
人材派遣 尾形 彰(オガタ・アキラ)
テクニカルスタッフⅠ 山岡 玲(ヤマオカ・アキラ)
細胞システム動態予測研究チーム
チームリーダー 城口 克之(シログチ・カツユキ)
研究員(研究当時)小川 泰策(オガワ・タイサク)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、理研BDR-大塚製薬連携センターの支援を受けて行われました。
原論文情報
- Takashi Fujimura, Yasunori Enomoto, Hiroaki Katsura, Taisaku Ogawa, Saori Baba, Akira Ogata, Akira Yamaoka, Katsuyuki Shiroguchi, Mitsuru Morimoto, "Identifying a lung stem cell subpopulation by combining single-cell morphometrics, organoid culture, and transcriptomics", Stem Cells, 10.1093/stmcls/sxad044
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(モリモト・ミツル)
客員研究員 藤村 崇(フジムラ・タカシ)
 藤村 崇
藤村 崇
 森本 充
森本 充
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
