2020年9月3日
理化学研究所
中部大学
植物においてキノン化合物を認識する受容体を発見
-“魔女の雑草”の防除と寄生メカニズム解明に期待-
理化学研究所(理研)環境資源科学研究センター植物免疫研究グループの白須賢グループディレクター(理研環境資源科学研究センター副センター長)、中部大学応用生物学部の鈴木孝征准教授らの共同研究チームは、植物におけるキノン化合物[1]の認識に関与する細胞表面の新しい受容体を発見しました。
本研究成果は、穀物の収穫量を大幅に減らす寄生植物「ストライガ[2]」の寄生機構の理解とその防除、および植物の免疫機構の解明と病原耐性の向上などに貢献すると期待できます。
ストライガなどのハマウツボ科の根寄生植物は、宿主植物の細胞壁由来のキノン化合物を認識することで寄生を開始します。しかし、寄生植物がどうやってキノン化合物を認識するのか、また、非寄生植物がキノン化合物を認識できるのかは不明でした。
今回、共同研究チームは、非寄生植物のシロイヌナズナを用いて、キノン化合物を認識できない変異体を単離し、全ゲノムシークエンス解析[3]により原因遺伝子「CARD1」を同定しました。CARD1は受容体様キナーゼ(RLK)[4]をコードしており、キノン化合物の認識に重要な役割を果たすと考えられます。また、CARD1変異体では病原菌に対する抵抗性が低下したことから、CARD1は植物免疫にも重要な因子であることが示されました。さらに、寄生植物ストライガとコシオガマのCARD1相同遺伝子[5]が変異体のキノン化合物認識機能を相補できることから、寄生植物もキノン化合物を認識することが明らかになりました。
本研究は、科学雑誌『Nature』オンライン版(9月2日付:日本時間9月3日)に掲載されます。
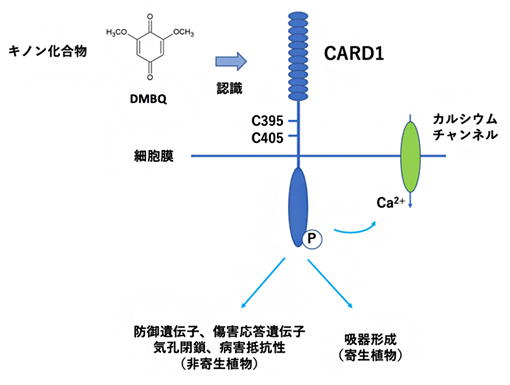
受容体様キナーゼCARD1がキノン化合物を認識する機構
背景
キノン化合物はほぼ全ての生物の体内で生産されており、キノン化合物の認識機構は、細菌や動物を対象としてよく研究されています。その一方で、アフリカで猛威を振るうストライガなどのハマウツボ科の根寄生植物は、宿主植物の細胞壁由来のキノン化合物を認識し、「吸器[6]」という特殊な器官を形成して宿主の根に寄生を開始します。特に、キノン化合物の中でも-2,6-ジメトキシ-1,4-ベンゾキノン(DMBQ)は、吸器誘導活性が高いことが知られています。
しかし、ハマウツボ科の寄生植物がどうやってDMBQを認識するのか、また、非寄生植物においてもキノン化合物は認識されるのか、もしそうであればどのような機構によるものか、なぜキノン化合物を認識するのかは未解明でした。
研究手法と成果
共同研究チームはまず、非寄生植物におけるDMBQの認識に関与する因子を同定するために、操作が容易なモデル植物のシロイヌナズナを用いました。シロイヌナズナにDMBQを投与すると、細胞内のカルシウムイオン濃度[7](以下カルシウム濃度)が上昇する(図1)ほか、真核生物に広く保存されているシグナル伝達経路の一つであるマイトジェン活性化タンパク質キナーゼ(MAPK)[8]の活性化などが見られました。さらに詳しい生化学的および薬理学的解析から、シロイヌナズナにおけるDMBQの認識にはタンパク質受容体が関与している可能性が高いと考えられました。
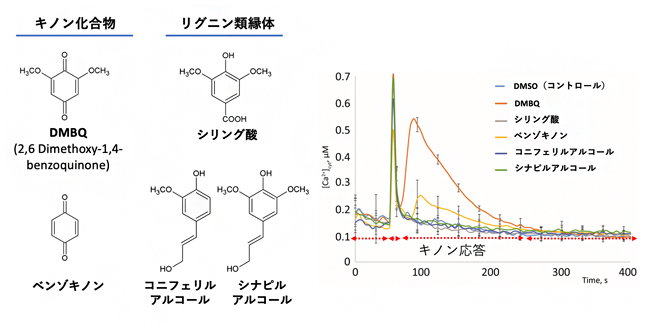
図1 シロイヌナズナにおけるキノン化合物とその関連物質への応答
- (左)シロイヌナズナで生産されるキノン化合物とその関連物質。
- (右)細胞内カルシウムイオンのマーカーを導入したシロイヌナズナに、キノン化合物およびその関連物質(植物細胞壁由化合物)を処理して、細胞内カルシウムイオン量を測定したもの。DMBQが一番強い応答、そしてベンゾキノンが弱い応答を示した。DMSO(有機溶媒コントロール)含めて、それら以外の化合物には応答しないことが分かった。
そこで、細胞内カルシウム濃度のマーカーを発現するシロイヌナズナ変異体の中から、DMBQに反応しない11の変異体(card1-1~card1-11)を特定し(図2)、全ゲノムシークエンス解析を行い、原因遺伝子「CARD1(cannot respond to DMBQ)」を同定しました。CARD1遺伝子は、新しいロイシンリッチリピート受容体様キナーゼ(LRR-RLK)[9]をコードしており、陸上植物系統全体にわたって高度に保存されていました(図2)。
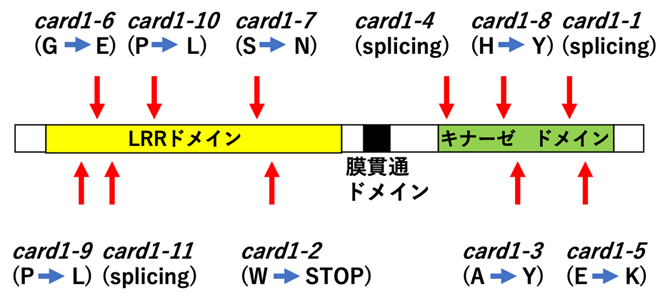
図2 CARD1タンパク質の構造と同定された11の変異の位置
CARD1タンパク質は、ロイシンリッチリピート(LRR)、膜貫通ドメイン、細胞内キナーゼドメインを持つ、典型的な受容体様キナーゼである。図中の11の変異(card1-1~card1-11)は、全てCARD1内で同定されている。括弧内は、変異によって変化したアミノ酸、スプライシング(splicing)、あるいはストップコドン(STOP)を表す。例えば、card1-1では、スプライシングの異常によりタンパク質が正常に翻訳されておらず、card1-6では、アミノ酸のグリシン(G)がグルタミン酸(E)に変異している。
また、CARD1遺伝子はシロイヌナズナのほとんどの組織で発現しており、CARD1タンパク質は細胞膜に局在していることが分かりました。タンパク質のアミノ酸配列の分析により、CARD1には細胞外ドメインのC末端に特異的な6個のシステイン(C)残基(C395、C405、C421、C424、C434、C436)が含まれることが明らかになりました。これは、CARD1を含むLRR-RLKサブグループVIII-1[9]でのみ見られました。これらのシステイン残基の重要性を評価するために、各システインを個別にセリン(S)に変異させたところ、CARD1C395SとCARD1C405Sのみが機能できませんでした。したがってC395とC405は、CARD1によるDMBQの認識に重要な役割を果たすと考えられます。
また、寄生植物でのDMBQ処理による吸器誘導を阻害するテトラフルオロ-1,4-ベンゾキノン(TFBQ)をシロイヌナズナに処理したところ、DMBQによる細胞内カルシウム濃度の上昇が阻害されました。このことから、CARD1において、TFBQはDMBQと同じ結合部位を競争阻害している可能性が示されました。
さらに、CARD1依存性シグナル伝達の下流のイベントを解明するために、最初にcard1変異体では、DMBQによるMAPKの活性化が起こらないことを確認しました。次に、DMBQ処理後の遺伝子発現を解析した結果、CARD1依存性の発現遺伝子が傷、免疫、ストレスへの応答に関与していることが示されました。これにより、CARD1が植物の免疫にとっても重要である可能性が示され、実際に、card1変異体ではトマト斑葉細菌[10]による感染の度合いが高くなっていました(図3A)。また、トマト斑葉細菌は気孔を通って葉に侵入するため、葉の気孔の様子を観察しところ、野生型にDMBQを投与すると気孔が閉じるのに対し、card1変異体では気孔は閉じないことが分かりました(図3B)。
これらの結果から、CARD1は、細菌感染時に自己または病原体からのキノン関連化合物に応答して、防御・ストレス関連の遺伝子発現を誘導し、さらに気孔を閉じることで、耐病性に貢献していると考えられます。
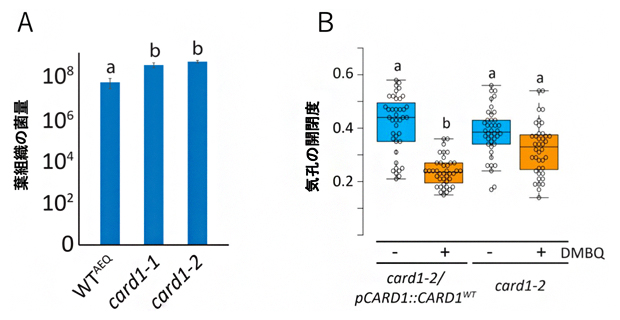
図3 card1変異体のトマト斑用細菌に対する耐性
- (A)シロイヌナズナの葉にトマト斑葉細菌を接種して5日目に葉組織の菌量を測定したもの。WTAEQは野生型コントロール。二つのcard1変異体(card1-1、card1-2)では、野生型コントロールに対してトマト斑葉細菌の感染が増加した。
- (B)card1変異体(card1-2)にDMBQを処理しても、気孔の閉鎖能はDMBQ無処理の場合と変わらず低いままであった。一方、card1-2変異体に野生型CARD1を導入したcard11-2/pCARD::CARD1WTでは、DMBQを処理すると気孔の閉鎖能が復帰した。a同士、b同士のグループは、それぞれ統計学的に有位差がないことを表す。
次に、寄生植物のCARD1の相同性遺伝子が発現するタンパク質(系統的にCARD1に最も近いPjCADL1、PjCADL2、PjCADL3)がDMBQのシグナル伝達に重要かどうかを調べるために、ハマウツボ科のモデル寄生植物としてコシオガマ[2]を用いて、その根を観察しました。すると、PjCADL2とPjCADL3は根の表皮のみで発現したのに対し、PjCADL1は根組織内で遍在的に発現していました(図4)。
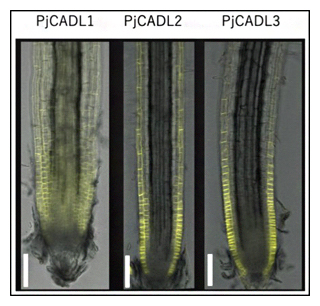
図4 コシオガマの根におけるCARD1相同性遺伝子の発現部位
コシオガマにおけるCARD1相同性遺伝子(PjCADL1、PjCADL2、PjCADL3)のプロモーターに、黄色蛍光タンパク質マーカーYFPの遺伝子をつなげて、CARD1相同性遺伝子の発現部位が黄色く光るようコシオガマの根を形質転換したもの。PjCADL2、PjCADL3では根の表皮のみで発現したのに対し、PjCADL1では根組織に偏在的に発現した。スケールバーは100マイクロメートル(μm、1μmは1,000分の1mm)。
さらに、コシオガマでもDMBQ処理時に細胞内カルシウム濃度が上昇すること、またMAPK活性化が観察されることを確認しました。DMBQ処理時の細胞内カルシウム濃度の上昇は、根先端のわずか上の通常吸器が発生する領域内に見られました。次に、カルシウム濃度やMAPKの阻害剤の実験から、細胞内カルシウム濃度の上昇とタンパク質リン酸化がコシオガマの吸器形成に重要な役割を果たすことが分かりました。さらに、コシオガマとストライガのCARD1相同遺伝子をシロイヌナズナのcard1変異体に導入すると、DMBQ認識機能が相補できたことから、寄生植物でもキノン化合物が同様に認識されていることが示されました。
微生物は、多様な種類のキノン化合物を大量に生産することが知られており、CARD1が幅広い範囲のキノン化合物に応答し、病原体に応答している可能性があります。また、一部の菌類は、宿主植物の細胞壁を分解してキノン化合物を生成することから、キノン化合物の認識は、侵入する病原体に対する警告システムである可能性もあります。さらに、DMBQは植物の根の抽出物からも分離されているため、一部のキノン化合物は傷害応答のシグナルとしても機能する可能性があります。
今後の期待
本研究は、寄生植物の吸器形成に必要なキノンシグナル伝達を明らかにしたばかりでなく、非寄生植物の防御応答におけるその役割を明らかにしました。寄生植物は非寄生植物の防御応答システムを、寄生機能に進化させた可能性があります。
この防御システムをさらに理解していくことで、今後、穀物や野菜の免疫システムを強化していく戦略の基盤が構築されると期待できます。また、寄生植物の吸器誘導阻害剤の探索など、新しい寄生植物防除の方法の開発につながり、ストライガによる農業被害の撲滅に貢献すると期待できます。
今回の研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[11]」のうち「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献するものです。
補足説明
- 1.キノン化合物
ベンゼン環から誘導され、二つのケトン構造(>C=O)を持つ環状の有機化合物。生物学的に重要な物質であり、ビタミンKが知られている。 - 2.ストライガ、コシオガマ
どちらもハマウツボ科に分類される寄生植物。ストライガは、主要な穀物に寄生して水分や養分を横取りし、その収穫量を大幅に減らす。特に、アフリカでの農業被害は深刻であり、"魔女の雑草"とも呼ばれている。主に、ソルガム、キビ、トウモロコシ、サトウキビ、(畑で栽培される)陸稲などの根に寄生し、その感染領域は、アフリカの半乾燥地域を中心に日本の面積を超える約40万km2に及び、年間被害額は約1000億円にも上ると推定されている。コシオガマは日本にも自生している。自分でも光合成をするが、他の植物の根が近づいてくると寄生を開始する。実験室環境下でもよく育ち、自家受粉をするため、モデル生物として適している。 - 3.全ゲノムシークエンス解析
次世代シーケンサーを使って、ヒトや動植物の全ゲノム情報を解読し、配列の違いや変化を同定すること。 - 4.受容体様キナーゼ(RLK)
情報伝達に関わる受容体の一種。シグナルとなる分子と結合する部分とタンパク質をリン酸化する酵素(タンパク質キナーゼ)の部分を持つ。通常、この二つの構造は細胞膜を隔てて外側と内側に位置している。RLKはreceptor-like kinaseの略。 - 5.相同遺伝子
進化的に共通の祖先遺伝子を持つ相同性の高い遺伝子。 - 6.吸器
寄生植物が宿主植物に感染する際に形成する特殊器官。 - 7.カルシウムイオン濃度
細胞質内のカルシウムイオン(Ca2+)の濃度は約10-7Mであり、細胞外液の約10-3Mに対して極端に低く抑えられている。刺激に応じて誘導される細胞質内の急激なカルシウムイオン濃度の上昇は、多くの生命現象でシグナルとして利用される。 - 8.マイトジェン活性化タンパク質キナーゼ(MAPK)
酵母から植物・高等動物まで広く真核生物に保存されているキナーゼ(リン酸化酵素)であり、細胞外のシグナルを核内へと伝える鍵分子として機能すると考えられている。MAPKはMitogen-activated Protein Kinaseの略。 - 9.ロイシンリッチリピート受容体様キナーゼ(LRR-RLK)、LRR-RLKサブグループVIII-1
ロイシンリッチリピート受容体様キナーゼは細胞表面の受容体で、1回膜貫通型で細胞外にロイシンリッチリピート(LRR)、細胞内にキナーゼドメインを持つ。免疫や細胞間コミュニケーションにおいて重要なものが多い。植物には15のサブグループがあり、サブグループVIII-1は今まで解析されていなかったグループで、シロイヌナズナでは8種存在する。 - 10.トマト斑葉細菌
主にトマトの果実、果柄、葉柄、葉身に斑点を発生させる細菌。シロイヌナズナにも感染するため、モデル病原細菌として研究に用いられる。 - 11.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省ホームページから一部改変して転載)
共同研究チーム
理化学研究所 環境資源科学研究センター 植物免疫研究グループ
グループリーダー 白須 賢(しらす けん)
(環境資源科学研究センター 副センター長)
研究員 アヌフォン・ラオハビジット(Anuphon Laohavisit)
特別研究員 若竹 崇雅(わかたけ たかのり)
研究員 石濱 伸明(いしはま のぶあき)
中部大学 応用生物学部
准教授 鈴木 孝征(すずき たかまさ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究S「植物と病原体の攻防における分子機構(研究代表者:白須賢)」、文部科学省新学術領域研究(研究領域提案型)「植物の成長可塑性を支える環境認識と記憶の自立分散型統御システム(研究領域代表者:木下俊則)」の計画研究「寄生植物による維管束情報ハイジャック機構の解明(研究代表者:白須賢)」などによる支援を受けて行われました。
原論文情報
- Anuphon Laohavisit, Takanori Wakatake, Nobuaki Ishihama, Hugh Mulvey, Kaori Takizawa, Takamasa Suzuki, Ken Shirasu, "Quinone perception in plants via leucine-rich-repeat receptor-like kinases", Nature, 10.1038/s41586-020-2655-4
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
理化学研究所 環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
(環境資源科学研究センター 副センター長)
 白須 賢
白須 賢
中部大学 応用生物学部
准教授 鈴木 孝征(すずき たかまさ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
中部大学 学園広報部広報課
Tel: 0568-51-7638
Email: cuinfo [at] office.chubu.ac.jp ※[at]は@に置き換えてください。
