2015年12月18日
理化学研究所
名古屋大学
2つのシグナル物質の使い分けによる正反対の神経制御
-新たな抑制性シナプス伝達制御メカニズムの発見-
要旨
理化学研究所(理研)脳科学総合研究センター発生神経生物研究チームの御子柴克彦チームリーダー、丹羽史尋研究員、坂内博子客員研究員(名古屋大学大学院理学研究科特任講師)らの国際共同研究グループ※は、脳の抑制性神経伝達効率の増加と減少が、グルタミン酸とカルシウム(Ca2+)という2つのシグナル物質の使い分けにより選択的に引き起こされることを明らかにしました。
神経細胞はシナプス[1]という構造を介して情報の伝達を行っています。シナプスには情報を受け取る側の神経細胞を興奮させる「興奮性シナプス」と、興奮を抑える「抑制性シナプス」があります。GABAA受容体[2]は抑制性シナプスでの情報の受け取りを担うタンパク質で、効率よく情報を受け取るために通常シナプスに集まっています。しかし国際共同研究グループは2009年、細胞外から細胞内へ大量のCa2+流入が起こると、GABAA受容体が細胞膜内で動きやすくなりシナプスから散逸するため、抑制性神経伝達が弱くなることを報告しています。
今回、国際共同研究グループは、細胞内のCa2+貯蔵庫である小胞体からの「IP3受容体(イノシトール三リン酸受容体)[3]」を介したCa2+放出が抑制性シナプスに果たす役割に注目しました。量子ドット[4]を用いて神経細胞膜上のGABAA受容体の動きを1分子レベルで追跡したところ、小胞体(IP3受容体)からのCa2+放出が、GABAA受容体を動きにくくし、抑制性シナプスの中でのGABAA受容体の安定性を高めていることが分かりました。さらに、GABAA受容体の安定性を高めるためには、IP3受容体に加えて「代謝型グルタミン酸受容体[5]」と「リン酸化酵素プロテインキナーゼC[6]」の活性化が必要であることも明らかにしました。
これまでの研究で、グルタミン酸は「NMDA型グルタミン酸受容体[7]」を活性化し、細胞外から細胞内へ大量のCa2+を流入させることにより、GABAA受容体を動きやすくすることが知られていました。一方、今回解明したメカニズムでは、同じグルタミン酸とCa2+というシグナル物質が、代謝型グルタミン酸受容体とIP3受容体という全く異なる受容体を介して、逆にGABAA受容体を動きにくくし、安定性を高める働きをしています。これはグルタミン酸とCa2+というGABA作動性シナプス(GABAA受容体が機能するシナプス)の制御に関与するシグナル物質が、従来知られていた役割とは正反対の役割も担っていることを示す結果です。
脳内の興奮と抑制のバランスの崩れはてんかん[8]、統合失調症、自閉症などさまざまな精神・神経疾患の原因と考えられています。本研究の成果を発展させることで、脳の神経細胞の過剰な興奮を抑え、これら精神・神経疾患の治療法の開発につながると期待できます。
本成果は、米国の科学雑誌『Cell Reports』(12月29日号)に掲載されるのに先立ち、オンライン版(12月17日付け:日本時間12月18日)に掲載されます。
※国際共同研究グループ
理化学研究所 脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦 (みこしば かつひこ)
研究員 丹羽 史尋 (にわ ふみひろ)
客員研究員 坂内 博子 (ばんない ひろこ)(名古屋大学大学院 理学研究科 特任講師)
フランス・パリ高等師範学校 生物学研究所
ディレクター アントワーヌ・トゥリレ(Antoine Triller)(国立衛生医学研究所 PSL Research University 兼任)
背景
神経細胞はシナプスという構造を介して情報の伝達を行っています。シナプスには情報を受け取る側の神経細胞を興奮させる「興奮性シナプス」と、興奮を抑える「抑制性シナプス」があります。私たちの脳における情報処理は神経細胞の興奮と抑制の絶妙なバランスの上に成り立っています。
このバランスを保つカギとなるのが、抑制性シナプスでの情報の受け取りを担うタンパク質「GABAA受容体」を介した情報伝達です。GABA作動性シナプス(GABAA受容体が機能するシナプス)への適切なシグナルの入力(GABA作動性シナプス伝達)は脳が正常に機能するのに必要なだけでなく、視覚などの感覚情報の知覚回路が環境や経験によって大きな影響を受ける時期である臨界期の開始にも不可欠です。さらにその異常は、てんかん、統合失調症、自閉症など、さまざまな精神・神経疾患の原因にもなります。そのため、GABA作動性シナプス伝達の制御メカニズムを明らかにすることは、脳の機能の理解や、精神・神経疾患の原因解明のために重要です。
GABAA受容体によるGABA作動性シナプス伝達の強度はシナプス後膜[1]に集積しているGABAA受容体の数に依存します。通常、1つのシナプス後膜には数10個程度のGABAA受容体が常に集まっており、効率の良い情報伝達を可能にしています。これまでの研究で、1個1個のGABAA受容体は側方拡散[9]により細胞膜上を動き回りシナプス内外をダイナミックに出入りしていること、神経細胞の興奮に伴いGABAA受容体の側方拡散が増加してシナプス後膜から散逸することが分かっています。しかし、細胞膜上を絶え間なく動き回っているGABAA受容体が、なぜシナプス後膜に一定数集積し続けることができるのか、またシナプス後膜から散逸したGABAA受容体がどのように再集積されるのか、そのメカニズムは明らかになっていませんでした。国際共同研究グループは、シナプス後膜へのGABAA受容体の集積を維持しているメカニズムをラット及び遺伝子組み換えマウスの海馬(記憶の形成に不可欠な脳の部位)の培養神経細胞を用いて、1分子の動きを直接可視化する手法で解明することに取り組みました。
研究手法と成果
(1) GABAA受容体の集積には代謝型グルタミン酸受容体→ホスホリパーゼC→IP3受容体の活性化が必要
御子柴チームリーダーらは以前、細胞内のカルシウム(Ca2+)貯蔵庫である小胞体からのCa2+放出を司る「IP3受容体(イノシトール三リン酸受容体)1型」の遺伝子を欠損させたマウスでは、てんかん様発作など、さまざまな異常が現れることを発見しています注1)。
今回、国際共同研究グループが蛍光抗体法[10]を用いて、IP3受容体1型遺伝子欠損マウスと野生型マウスの海馬から作製した培養神経細胞のシナプス後膜に存在するGABAA受容体を調べたところ、遺伝子欠損マウスの培養神経細胞では野生型と比べて、GABAA受容体の数が75%程度に減少していました(図1A)。また、野生型ラット海馬の培養神経細胞において、代謝型グルタミン酸受容体、ホスホリパーゼC[11]、IP3受容体に対する各阻害剤を用いて小胞体からのCa2+放出を阻害したところ、いずれにおいてもシナプス後膜のGABAA受容体の数が減少しました(図1B)。これらの結果から、GABAA受容体がシナプス後膜に持続的に集積するためには、代謝型グルタミン酸受容体→ホスホリパーゼC→IP3受容体というシグナル経路の活性化を通して引き起こされるCa2+放出が必要であることが分かりました。
さらに、このシグナル経路の活性化によるGABAA受容体のシナプス後膜への集積の維持が、GABA作動性シナプス1個あたりの電気的応答の大きさの維持に必要であることも分かりました(図1C)。
注1)1996年1月11日 Nature; Matsumoto...Mikoshiba (corresponding author) et al.
「Ataxia and epileptic seizures in mice lacking type 1 inositol 1,4,5-trisphosphate receptor」
(2) グルタミン酸はCa2+流入とCa2+放出を引き起こし、GABAA受容体のシナプス後膜からの散逸と集積という正反対の役割を担う
御子柴チームリーダーらは以前の研究で、グルタミン酸が結合し細胞外から細胞内へのCa2+流入を引き起こす「NMDA型グルタミン酸受容体」が活性化すると、GABAA受容体の側方拡散が大きくなり、シナプス後膜から散逸することを報告しています(図2A右側)注2)。散逸したGABAA受容体は通常、NMDA型グルタミン酸受容体の活性化が止まると15分ほどでシナプス後膜に再集積してその数が回復します。しかし、代謝型グルタミン酸受容体を阻害し小胞体(IP3受容体)からのCa2+放出を止めた場合には回復しませんでした(図2B)。この結果は、散逸したGABAA受容体がシナプス後膜に再集積するには、代謝型グルタミン酸受容体から始まるシグナル経路の活性化により引き起こされる小胞体からのCa2+放出が必要なことを示しています。
このようにグルタミン酸は「NMDA型グルタミン酸受容体」を活性化してCa2+流入を引き起こし、シナプス後膜からGABAA受容体の散逸させる一方で、「代謝型グルタミン酸受容体」を活性化してCa2+放出を引き起こし、シナプス後膜へGABAA受容体を集積させるという正反対の役割を担っていることが分かりました。また、この2つのシグナル経路は互いに、先に起こった方がもう片方の経路に優先することが分かりました(図2C)。
注2)2009年6月12日プレスリリース「抑制性神経伝達を制御する新たな分子機構を、量子ドットを活用し発見」
(3) 細胞内Ca2+濃度変化は側方拡散の制御を通してGABAA受容体の集積を制御する
代謝型グルタミン酸受容体を阻害し小胞体(IP3受容体)からのCa2+放出を止めるとシナプス後膜でのGABAA受容体の数は減少しましたが、細胞膜上のGABAA受容体の総数は変化しませんでした。この結果はシナプス後膜に局在するGABAA受容体数が減ったのは細胞膜上に発現しているGABAA受容体が減少したからではなく、シナプス後膜に密集していたGABAA受容体がシナプス外の細胞膜上に移動したことを示しています。
国際共同研究グループは量子ドットを用いた1分子イメージング法(図3A)により、光学顕微鏡を超える解像度で細胞膜上のGABAA受容体の側方拡散を解析しました。その結果、代謝型グルタミン酸受容体を阻害し小胞体(IP3受容体)からのCa2+放出を止めると、GABAA受容体の側方拡散が速くなり、シナプス後膜に滞在する時間が短くなることが分かりました(図3B、C)。この結果はCa2+放出経路が恒常的にGABAA受容体を動きにくくし、安定性を高めることにより、GABAA受容体の散逸を防いでいることを意味しています。
(4) GABAA受容体の側方拡散は拮抗するリン酸化-脱リン酸化酵素によって制御されている
国際共同研究グループは、代謝型グルタミン酸受容体の活性化による小胞体(IP3受容体)からのCa2+放出が恒常的に起こることにより、GABAA受容体の周囲に存在するカルシウム依存型の「リン酸化酵素プロテインキナーゼC」の量が保たれていることを確認しました(図4A)。また、カルシニュリン阻害剤を用いてIP3受容体の阻害を行い小胞体からのCa2+放出を止めたところ、GABAA受容体のシナプス後膜からの散逸には「脱リン酸化酵素カルシニュリン」の活性が必要であることが分かりました(図4B)。一方で、カルシウム依存型のリン酸化酵素プロテインキナーゼCの特異的な阻害剤はGABAA受容体のシナプスでの側方拡散を増大させました(図4C)。
これらの結果は恒常的なCa2+放出に依存するリン酸化酵素プロテインキナーゼCの活性とCa2+流入の下流で著しく増加するカルシニュリンの活性が拮抗して、GABAA受容体の動きやすさとシナプス後膜のGABAA受容体数を決定していることを示しています(図5)。
今後の期待
本研究で国際共同研究グループはGABA作動性シナプス伝達の恒常性の維持により、神経細胞の興奮-抑制のバランスを維持する新しいメカニズムを発見しました。この発見は、これまでGABAA受容体をシナプス後膜から散逸させる引き金になると考えられてきたグルタミン酸が、GABAA受容体をシナプス後膜に集積させる引き金にもなっており、全く逆の役割を担っているという興味深い事実を示しています。これは生体内に存在する限られた種類の分子を駆使して、人体の複雑な機能が巧妙に営まれている一例かもしれません。
また、本研究は抑制の制御という観点からも、記憶の分子基盤であるシナプス可塑性[12]の制御にIP3受容体によるカルシウム放出が関わっていることを示しており、記憶のメカニズム解明に新たな手掛かりを与えることになります。
さらに、興奮と抑制の精密なバランス制御が失われると、てんかんをはじめとするさまざまな脳神経疾患につながります。例えば、興奮性シナプスの過剰な興奮によってシナプス後膜からGABAA受容体が散逸することは、生命の危機をもたらすてんかん重積症状の発症機序の1つと考えられています。国際共同研究グループは代謝型グルタミン酸受容体経路をあらかじめ活性化しておくことで、シナプス後膜からのGABAA受容体の散逸を防げることを確認しました。これまでGABA作動性シナプスの抑制を強める薬としてはGABAA受容体のCl-透過性[13]を高める薬と、神経伝達物質GABAの量を増大させる薬が使われてきました。私たちの今回の発見はGABAA受容体のシナプスへの集積を促進するという新たな創薬のターゲットを提示しています。
今後、研究が進展することによってGABAA受容体の側方拡散制御の分子メカニズムが明らかになるともに、てんかんや、GABA作動性シナプス伝達の異常が一因として考えられている統合失調症・自閉症など、さまざまな精神・神経疾患の治療法確立への貢献が期待できます。
原論文情報
- Hiroko Bannai†, Fumihiro Niwa†, Mark W. Sherwood, Amulya Nidhi Shrivastava, Misa Arizono, Akitoshi Miyamoto, Kotomi Sugiura, Sabine Levi, Antoine Triller‡ and Katsuhiko Mikoshiba,‡†Co-first author,‡Co-corresponding author, "Bidirectional Control of Synaptic GABAAR Clustering by Glutamate and Calcium", Cell Reports, doi: 10.1016/j.celrep.2015.12.002
発表者
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦 (みこしば かつひこ)
研究員 丹羽 史尋 (にわ ふみひろ)
客員研究員 坂内 博子 (ばんない ひろこ)(名古屋大学大学院理学研究科 特任講師)
 前列左より、坂内博子、御子柴克彦、 有薗美沙、後列左より宮本章歳、丹羽史尋、Mark W. Sherwood
前列左より、坂内博子、御子柴克彦、 有薗美沙、後列左より宮本章歳、丹羽史尋、Mark W. Sherwood
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
名古屋大学 総務部 広報渉外課
Tel: 052-789-2699 / Fax: 052-788-6272
kouho [at] adm.nagoya-u.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.シナプス、シナプス後膜
神経細胞同士の情報伝達に関わる構造。情報を伝える細胞と伝えられる細胞の間には約20ナノメートル(nm、1nmは10億分の1メートル)のすき間がある。情報を伝える細胞はこのすき間に神経伝達物質を放出し、伝えられる細胞側の神経伝達物質受容体がそれを受け取ることにより神経情報が伝わる。情報を受け取る細胞のシナプスの細胞膜には神経伝達物質受容体が密集しており、この構造を「シナプス後膜」と呼ぶ。 - 2.GABAA受容体
中枢神経系において速い抑制性神経伝達を担う、5つのサブユニットから構成されるイオンチャネル。神経伝達物質の1つのγアミノ酪酸(GABA)が結合することで開口し、塩化物イオン(Cl-)を透過させる。 - 3.IP3受容体(イノシトール三リン酸受容体)
細胞内のカルシウム貯蔵庫の1つである小胞体膜上に存在するCa2+放出チャネル。IP3と結合することでチャネルが開き、小胞体内のCa2+を細胞質に放出する。3つのサブタイプがあるが、神経細胞ではIP3受容体1型が役割を担う。 - 4.量子ドット
直径約15~25ナノメートルの半導体素材からなるナノ結晶。生命科学の分野では蛍光プローブとして用いる。従来の蛍光色素と比べてシグナルが強く、褪色しにくいという利点があり、1分子イメージングに適している。量子ドット1分子イメージング法は内在性分子の側方拡散を長時間観察できるという点で、外来性蛍光タンパク質を用いた従来の生細胞イメージング法に比べて優れている。 - 5.代謝型グルタミン酸受容体
アミノ酸の1つであるグルタミン酸を受容するタンパク質。グルタミン酸が結合すると、IP3受容体からのCa2+の放出を上昇させる細胞内シグナル経路を活性化する。 - 6.リン酸化酵素プロテインキナーゼC
タンパク質を構成するアミノ酸のセリン/スレオニンにリン酸基を付加する酵素。IP3受容体からのCa2+放出シグナルにより活性化されることが知られている。 - 7.NMDA型グルタミン酸受容体
イオンチャネル共役型グルタミン酸受容体で、グルタミン酸の結合により開口し細胞外から細胞内へのCa2+流入を引き起こす。イオンチャネル共役型とは、イオンチャネルの開閉方式で分類されるもので、共役型は分子の特異的な結合によって開くものである。 - 8.てんかん
さまざまな原因によって引き起こされる慢性の脳疾患。大脳の神経細胞の過剰な放電(興奮)によって繰り返し引き起こされる反復性の発作を特徴とし、変異に富む臨床症状や検査所見を伴う。発症率は人口の0.5~1%である。なかでも発作がある程度の長さ以上続く状態、または短い発作の場合でも繰り返し起こって、その間の意識の回復がないものをてんかん重積状態と呼び、生命に危機が及ぶ可能性がある。 - 9.側方拡散
1972年にシンガーとニコルソンにより提唱された生体膜モデルによると、細胞膜は脂質二重層とモザイク状に入り混じり合ったタンパク質により構成されている。これらの細胞膜構成要素は流体としての性質を持ち、細胞膜の中をブラウン運動している。この2次元的なブラウン運動を側方拡散と呼ぶ。 - 10.蛍光抗体法
免疫蛍光法ともいう。抗原のタンパク質が抗体と結合する高い特異性を利用し、蛍光色素で標識した抗体を用い特定のタンパク質を蛍光顕微鏡などで可視化・検出する方法である。 - 11.ホスホリパーゼC
代謝型グルタミン酸受容体などの細胞膜上のGタンパク質共役型受容体活性化に伴い、細胞膜の主要成分であるリン脂質の1種からIP3を産生する酵素群の一つで、シグナル伝達において重要な役割を担っている。 - 12.シナプス可塑性
神経系の研究において可塑性は脳の持つ柔軟な適応能力を指す。中でも、神経細胞間のシナプスでの情報伝達効率が必ずしも一定でなく長期的に変化するシナプス可塑性は学習・記憶の細胞メカニズムだと考えられている。 - 13.Cl-透過性
塩化物イオン(Cl-)チャネルであるGABAA受容体が、Cl-を通すことのできる能力。チャネルが開く確率や開口時間を調節することで増減する。
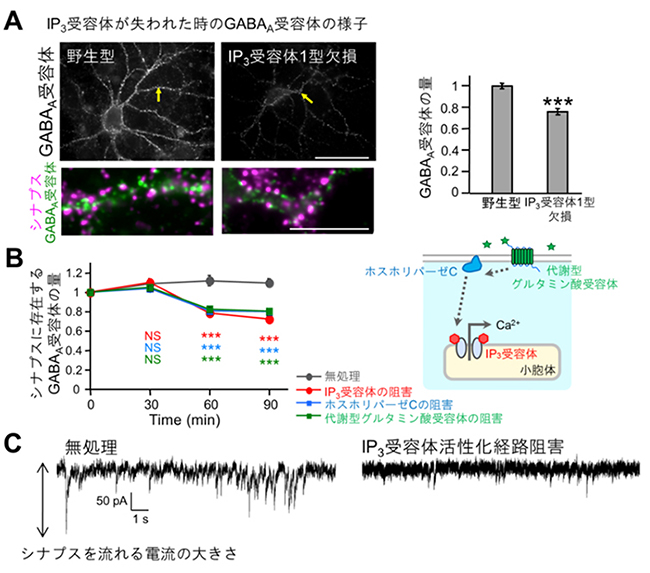
図1 マウス・ラットにおけるGABAA受容体のシナプス後膜への集積を調べた実験結果
- A: 左は、IP3受容体1型欠損マウスと野生型マウス由来の海馬培養神経細胞のGABAA受容体とシナプス後膜を蛍光抗体法で検出した画像。右のグラフは、IP3受容体1型欠損マウスの神経細胞ではGABAA受容体のシナプス後膜への集積が野生型に比べて、75%程度に減少していたことを示す(***は統計的に差が有意であることを示している)。
- B: ラット由来の海馬培養神経細胞において、代謝型グルタミン酸受容体、ホスホリパーゼC、IP3受容体に対する各阻害剤を用いると、いずれも同様にGABAA受容体のシナプス後膜への集積が有意に減少した。すなわち、代謝型グルタミン酸受容体から始まる、ホスホリパーゼC、IP3受容体の活性化がシナプス後膜へのGABAA受容体の集積に必要であることが示された。
- C: 代謝型グルタミン酸受容体の阻害剤により代謝型グルタミン酸受容体→ホスホリパーゼC→IP3受容体の活性化経路を阻害した際のGABA作動性シナプスを流れる電流の大きさの比較。阻害剤によりGABA作動性シナプス伝達の大きさが減少した。
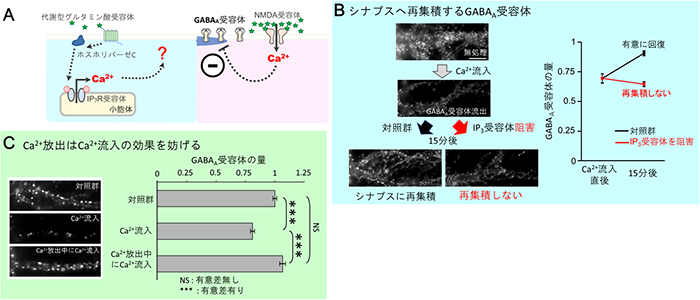
図2 Ca2+放出とCa2+流入のGABAA受容体集積への異なる役割
- A: 代謝型グルタミン酸受容体、ホスホリパーゼC、そしてIP3受容体の活性化により小胞体からのCa2+放出が起きる(左側)。一方でNMDA型グルタミン酸受容体の活性化による細胞外から細胞内へのCa2+流入はシナプス後膜からのGABAA受容体の散逸を引き起こす(右側)。
- B: ラット由来の海馬培養神経細胞においてCa2+流入を誘導し、シナプス後膜からGABAA受容体を散逸させた後、Ca2+流入が止まると15分ほどでGABAA受容体はシナプス後膜に再集積する。しかし、代謝型グルタミン酸受容体の活性化が引き起こす小胞体(IP3受容体)からのCa2+放出を止めるとシナプス後膜への再集積は起こらなかった。
- C: ラット由来の海馬培養神経細胞において、Ca2+流入はシナプス後膜からのGABAA受容体の散逸を引き起こすが、あらかじめ小胞体からのCa2+放出を起こしている状態でCa2+流入を誘導してもGABAA受容体の有意な散逸は起こらなかった。
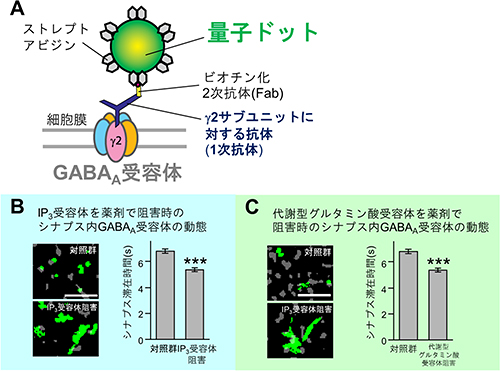
図3 側方拡散の制御によるGABAA受容体集積制御
- A: 量子ドットで細胞膜上のGABAA受容体を1分子標識する方法の概略。1次抗体、ビオチン化2次抗体を介してストレプトアビジン融合量子ドットで標識するGABAA受容体は5つのサブユニットから構成されているが、その中で1つしか存在しないg2サブユニットに対する抗体を1次抗体として用いることで、受容体と量子ドットを1:1で標識できる。量子ドットの動きは蛍光顕微鏡で追跡する。
- B: ラット由来の海馬培養神経細胞においてIP3受容体阻害剤存在下でGABAA受容体の動態を観察した。緑色の領域は量子ドットで標識したGABAA受容体が38.4秒間に動いた範囲、灰色の領域は蛍光色素で標識したシナプス後膜。同じ時間にGABAA受容体が動いた緑色の範囲が広がっており、解析してみるとGABAA受容体がシナプス後膜に滞在した時間も有意に短くなっていた。
- C: ラット由来の海馬培養神経細胞において代謝型グルタミン酸受容体阻害剤存在下でGABAA受容体の動態を観察した。IP3受容体阻害剤存在下と同様、同じ時間にGABAA受容体が動いた緑色の範囲が広がっており、解析してみるとGABAA受容体がシナプス後膜に滞在した時間も有意に短くなっていた。
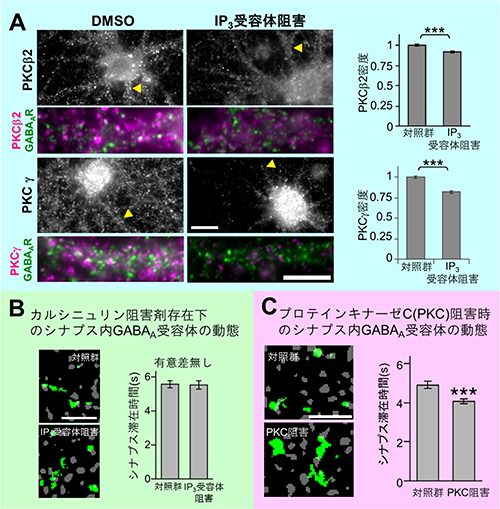
図4 GABAA受容体の側方拡散を制御する拮抗したリン酸化-脱リン酸化酵素
- A: ラット由来の海馬培養神経細胞においてIP3受容体を阻害すると、リン酸化酵素プロテインキナーゼCの一種であるPKCβ2とPKCγに変化が見られた。そこで、GABAA受容体と同じ場所に存在しているこれらのリン酸化酵素プロテインキナーゼCの密度を解析したところ、IP3受容体の阻害剤によって減少していることが判明した。
- B: ラット由来の海馬培養神経細胞においてカルシニュリン阻害剤存在下でIP3受容体の阻害も行い、GABAA受容体の動態を観察した。IP3受容体を阻害すると本来GABAA受容体の側方拡散は増大し、シナプス滞在時間は有意に短くなるが、その効果はカルシニュリン阻害剤によって打ち消された。
- C: ラット由来の海馬培養神経細胞においてリン酸化酵素プロテインキナーゼC阻害剤存在下でGABAA受容体の動態を観察した。IP3受容体阻害剤存在下と同様、同じ時間に受容体が動いた緑色の範囲が広がっており、解析してみるとGABAA受容体がシナプス後膜に滞在した時間も有意に短くなった。
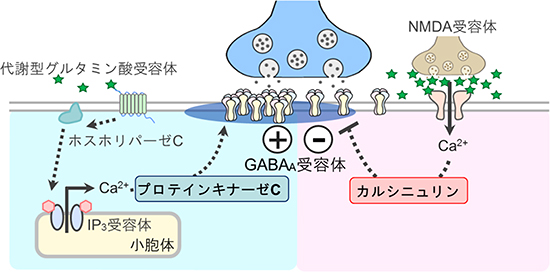
図5 グルタミン酸とCa2+によるGABAA受容体の側方拡散制御
恒常的なグルタミン酸による代謝型グルタミン酸の活性化に始まり、ホスホリパーゼC、IP3受容体からのCa2+放出によるリン酸化酵素プロテインキナーゼCの活性化がGABAA受容体のシナプス後膜への集積の維持に必要であることが明らかになった(図の左側)。これは興奮性シナプスからの大量のグルタミン酸放出によるNMDA受容体を介したCa2+流入と脱リン酸化酵素カルシニュリンの活性によるGABAA受容体のシナプス後膜からの散逸(図の右側)と拮抗する、グルタミン酸とCa2+によるGABAA受容体制御の新しいメカニズムである。
