ポイント
要旨
理化学研究所(理研)光量子工学研究領域理研-SIOM連携ユニットの杉岡幸次ユニットリーダーらの研究チーム※は、フェムト秒レーザー[1](1フェムト秒は1000兆分の1秒、10-15秒)を用いて、ガラスマイクロチップ内部の3次元マイクロ流体構造[2]へ自在に金属薄膜を堆積させることで金属配線を施す技術を開発しました。そして、この技術で作製した「エレクトロフルイディクス[3]」の閉空間内で、ミドリムシの運動方向を3次元に制御することに成功しました。
微生物や生細胞の運動方向を自在に制御することは、それらの動態・機能を解明するために極めて重要です。特に高速で運動する微生物の鞭毛などの部位を詳細に分析するには、その動きをさまざまな方向から観察することが不可欠です。観察を効率的に行うには、微生物や生細胞を限られた閉空間に入れて、その動きを“3次元に制御すること”が必要です。
研究チームは、マイクロ流体デバイス[2]内の電界方向を制御し、電気的に微生物の運動方向を制御する方法を考案しました。ガラスマイクロチップ内部に3次元マイクロ流体構造を構築した後、超短パルスかつ高強度のフェムト秒レーザーで流体構造内部を選択的にアブレーション(固体の表面がプラズマ化し、原子、分子、クラスターが蒸発して固体表面が削り取られる現象)することで、流体構造内部へ自在に金属薄膜を堆積させ、金属配線を施す技術を開発しました。この技術を用いて、任意の箇所に電極を配置したエレクトロフルイディクスと呼ばれるバイオチップを作製しました。バイオチップ内の電界分布を時間的・空間的に制御することで、ミドリムシの運動方向を3次元に制御することに成功しました。
本技術は、微生物や生細胞の微小な部位や高速運動する部位を効率的、かつ詳細に観察することができ、今後、微生物や生細胞の動態・機能の解明への応用が期待できます。また、電気化学バイオセンサー[4]などのエレクトロフルイディクス作製への応用も期待できます。
本研究は、国際科学雑誌『Microsystems & Nanoengineering』(2月27日)に掲載されました。
※研究チーム
理化学研究所 光量子工学研究領域
エクストリームフォトニクス研究グループ 理研-SIOM連携研究ユニット
ユニットリーダー 杉岡 幸次(すぎおか こうじ)
研究員(研究当時) ジェン・シュー(Jian Xu)
理化学研究所 光量子工学研究領域
領域長 緑川 克美(みどりかわ かつみ)
背景
微生物や生細胞の運動方向を自在に制御することは、それらの動態・機能を解明するために極めて重要です。例えば、ミドリムシは鞭毛[5]1本を体の周りで回転させることにより先進運動をするというユニークな動態をみせます。しかし、その鞭毛の太さは数百ナノメートル(nm、1nmは10億分の1メートル)しかなく、かつ細胞体および鞭毛の長さが約30マイクロメートル(μm、1μmは100分の1メートル)と短いこと、鞭毛の回転周期が30~40ミリ秒しかないため肉眼や通常のビデオカメラでは追跡できないこと、また鞭毛が体の近くに巻きつくように回転するためにはっきり見えないことなどから、どうやって前進するための推進力を発生させているのかは分かっていませんでした。
このように、高速で運動する微生物の鞭毛の動作を解析できれば、バイオモーター[6]などへの応用が期待されます。ただし、鞭毛の高速運動を詳しく分析するには、その動きをさまざまな方向から観察することが不可欠です。観察を効率的に行うには、微生物を限られた閉空間に入れて、その動きを“3次元に制御すること”が必要です。
既に研究チームは、マイクロ流体デバイスを用いれば、限られた閉空間で微生物を効率的に観察できることを実証しています注1)。しかし、その運動を3次元に制御するまでには至っていませんでした。そこで今回、研究チームは、マイクロ流体デバイス内で電界分布を時間的かつ空間的に制御することで、電気的に微生物の運動方向を制御する方法を考案しました。
注1)Y. Hanada, K. Sugioka, H. Kawano, I.S. Ishikawa, A. Miyawaki, K. Midorikawa, “Nano-aquarium for dynamic observation of living cells fabricated by femtosecond laser direct writing of photostructurable glass”, Biomed. Microdevices 10, 403-410 (2008).
研究手法と成果
研究チームはまず、集光した超短パルスかつ高強度のフェムト秒レーザー(1フェムト秒は1000兆分の1秒、10-15秒)をガラスマイクロチップ(ガラス基板)内部に直接照射し描画(直描)した後、フッ酸(フッ化水素酸)でエッチングすることで3次元マイクロ流体構造を形成しました(図1(a))。続いて、同じくフェムト秒レーザーを用いて、流体構造内部を選択的にアブレーション(固体の表面がプラズマ化し、原子、分子、クラスターが蒸発して固体表面が削り取られる現象)した後、無電解メッキ[7]を行いました(図1(b))。その結果、アブレーション領域のみに金属薄膜を堆積させることで、流体構造内部からガラスマイクロチップの外部に自在に金属配線を施すことに成功しました。
一般的な金属薄膜堆積法では、このように固体の中空構造内部にあとから選択的に金属薄膜を形成することは不可能です。これは、フェムト秒レーザーの多光子吸収[8]を用いることで初めて実現しました。
次に、研究チームは開発した技術により、ガラス基板内部に十字路形状の流路(マイクロチャネル)を形成し、そのチャネルの底面に対向する四つの電極を配置し、ガラス基板表面まで配線した「エレクトロフルイディクス」と呼ばれるバイオチップを作製しました(図2(a))。四つの電極間で加える交流電圧の組み合わせを変えると、マイクロチャネル内の電界方向を制御することができます。マイクロチャネル内にミドリムシを入れて観察したところ、制御した電界方向に沿ってミドリムシの運動方向を2次元に自在に制御することに成功しました(図2(b))。
さらに、ガラス基板に対して水平方向だけでなく垂直方向にもミドリムシの運動を制御するために、マイクロチャネルの底面と天井面にロの字型の電極を配置したエレクトロフルイディクスを作製しました(図3(a))。作製したエレクトロフルイディクスは、マイクロチャネル内で垂直軸に平行な方向にも交流電界を生じさせることができます。これによって、ミドリムシの運動を2次元だけでなく、垂直軸方向も含め3次元に制御することに成功しました。ミドリムシはほとんどの時間、地面に平行な方向への前進運動しか行わないため、鞭毛の回転運動をミドリムシの前方から観察することは困難です。作製したエレクトロフルイディクスを用いると、それを容易に観察することができます(図3(b))。
今後の期待
研究チームが開発した技術により作製したエレクトロフルイディクスを用いれば、微生物や生細胞の運動方向を3次元に自在に制御できます。これにより、微小な部位や高速運動をする部位を効率的かつ詳細に観察することができ、今後、微生物や生細胞の動態や機能の解明に貢献することが期待できます。
また、本技術は微生物や生細胞の運動方向の制御だけでなく、電気化学バイオセンサーなどのエレクトロフルイディクス作製への応用も期待できます。
原論文情報
- Jian Xu, Hiroyuki Kawano, Weiwei Liu, Yasutaka Hanada, Peixiang Lu, Atsushi Miyawaki, Katsumi Midorikawa and Koji Sugioka, "Controllable alignment of elongated microorganisms in a 3D microspace using electrofluidic devices manufactured by hybrid femtosecond laser microfabrication", Microsystems & Nanoengineering, doi: 10.1038/micronano.2016.78
発表者
理化学研究所
光量子工学研究領域 エクストリームフォトニクス研究グループ 理研-SIOM連携研究ユニット
ユニットリーダー 杉岡 幸次(すぎおか こうじ)
 杉岡 幸次
杉岡 幸次
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.フェムト秒レーザー
パルス幅が数十~数百フェムト秒(1フェムトは1,000兆分の1、10-15秒)のレーザー。パルス幅が極めて短いため、非常に高いピークパワー(パルスエネルギー/パルス幅)を持ち、それを集光することにより容易に数十ペタワット/cm2(1ペタは1000兆、1015)のピーク強度が得られる。 - 2.3次元マイクロ流体構造、マイクロ流体デバイス
ガラスや半導体基板、あるいはポリマーに微小流路や反応容器などの流体構造を作製し、生物研究や化学工学へ応用するためのマイクロデバイス。基板表面に形成された流体構造に対し、基板内部に埋め込まれたものを特に3次元マイクロ流体構造という。 - 3.エレクトロフルイディクス
フルイディクスとは、流体の流れを制御する流体素子のこと。エレクトロフルイディクスとは、マイクロフルイディクス(マイクロ流体素子)に、電気・電子素子を集積化したバイオチップである。 - 4.電気化学バイオセンサー
電気化学的な手法を利用して、イオンや含有物質の定量・定性分析を高感度に行うバイオチップ。 - 5.鞭毛
細胞の原形質の一部が細長い毛状に伸びた小器官で、運動性を持つ。原生動物、細菌類、藻類、菌類、動物の精子など、動植物界に広く存在する。本研究では、藻類のミドリムシを用いた。 - 6.バイオモーター
微生物の運動性や機能を利用して、マイクロ・ナノサイズの微小物体を動作させる駆動装置。 - 7.無電解メッキ
電気メッキのように直流電流を使用して金属を素材の上に析出させるのではなく、金属イオンと還元剤との化学反応によって金属イオンを素材上に金属として還元析出させる方法。 - 8.多光子吸収
半導体や絶縁体のような材料では、その材料のバンドギャップ(電子が存在できないエネルギー帯)より小さい光子エネルギーの光を入射した場合、電子を励起できないため吸収は生じない。しかしレーザー強度を大きくし単位時間あたりの光子密度を大きくしていくと、束縛電子が複数の光子を同時に吸収してイオン化する現象が生じる。このような非線形な吸収を多光子吸収と呼ぶ。フェムト秒レーザーはピーク強度が極めて高い(単位時間あたりの光子密度が極めて高い)ため、透明材料に対して効率よく多光子吸収を誘起できる。
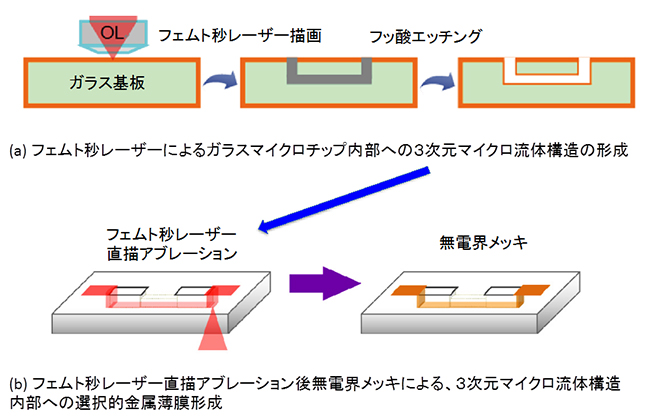
図1 フェムト秒レーザー直描技術による3次元マイクロ流体構造と選択的金属薄膜の形成
(a)ガラスマイクロチップ(ガラス基板)をフェムト秒レーザーで直描した後、フッ酸(フッ化水素)でエッチングを行い、ガラスマイクロチップ内部に3次元マイクロ流体構造を形成する。図中OLは、対物レンズ(Objective Lens)を示す。
(b)(a)の3次元マイクロ流体構造内部へ金属薄膜を選択的に形成するには、フェムト秒レーザーによる選択的なアブレーション(固体の表面がプラズマ化し、原子、分子、クラスターが蒸発して固体表面が削り取られる現象)後に無電界メッキを行う。
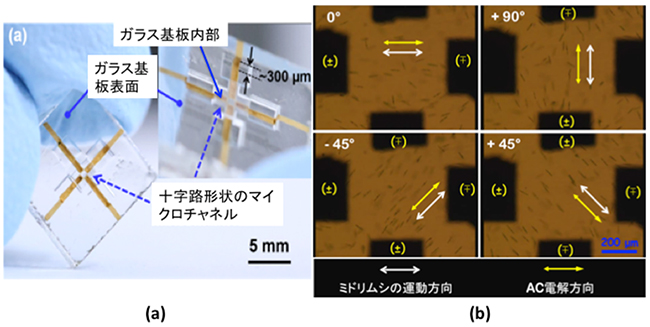
図2 2次元微小平面内でミドリムシの運動方向を自在に制御するエレクトロフルイディクス
(a)ガラス基板内部に形成された十字路形状のマイクロチャネル(流路)の底面に、対向する四つの電極を配置してエレクトロフルイディクスを作製した。
(b)(a)のエレクトロフルイディクスを用いてマイクロチャネル内の電界方向を制御し、ミドリムシの運動方向を2次元に自在に制御することに成功した。左上の0°(左側と右側の電極へ交流電圧を加える)では、ミドリムシは左右方向に運動する。右上の+90°(上側と下側の電極へ交流電圧を加える)では、ミドリムシは上下方向に運動する。同様に-45°、+45°のように電界方向を決めると、ミドリムシは斜め方向に運動する。光学顕微鏡画像。

図3 微生物の運動をガラス基板に対して垂直方向に配向させたエレクトロフルイディクス
(a)上図は、マイクロチャネルの底面と天井面に、ロの字型の電極を配置したエレクトロフルイディクスの模式図。下図はそのエレクトロフルイディクスを真上から撮影した画像。マイクロチャネル内でz軸に平行な方向に交流電界を生じさせることができる。
(b)(a)を用いてミドリムシの運動方向をz軸方向に配向し、ミドリムシの前進運動を前方から観察した光学顕微鏡画像。黄色の矢印で示した箇所のうっすらとした白い線が鞭毛(太さ数百nm)である。
