2009年3月13日
理化学研究所
免疫を抑えるT細胞が、免疫応答を促すヘルパーT細胞へ分化
- 異物を排除、許容する絶妙の腸管免疫バランスを制御する新メカニズムを発見 -
ポイント
- 制御性T細胞が、腸管でIgA抗体の産生を最も効率的に誘導
- 制御性T細胞は、免疫抑制機能を失ってろ胞性BヘルパーT細胞に分化
- 腸管免疫のバランスを人為的に制御し、腸内細菌との共存関係制御に新たな手がかり
要旨
独立行政法人理化学研究所(野依良治理事長)は、免疫応答を抑える働きを持っている制御性T細胞※1と呼ばれるT細胞※1が、B細胞※1の抗体産生を誘導する「ろ胞※2性BヘルパーT細胞」へと分化転換することで、腸管で腸内細菌を制御している抗体「IgA※3」の産生を誘導することを発見しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)粘膜免疫研究チームのシドニア・ファガラサン チームリーダー、免疫恒常性研究ユニットの堀昌平ユニットリーダーらの成果です。
ヒトの腸管内には、500~1,000種、100兆個にも及ぶ細菌が常在し、病原菌や食物など、さまざまな「異物」が、日々取り込まれています。ヒトをはじめとする脊椎動物に備わった免疫系は、これら「非自己」の体内への侵入を防ぎながら、過剰に攻撃することなく、多様な「非自己」との共生を達成しています。この共生のためには、免疫応答の正・負のバランスが適切に制御されることが重要で、「非自己」への過剰な免疫応答は、炎症性腸疾患や食物アレルギーといったさまざまな免疫疾患を引き起こします。腸管で腸内細菌の制御に重要な役割を担っているのがIgAと呼ばれる抗体で、腸内細菌や食物への過剰な免疫応答を防いでいるのが制御性T細胞と呼ばれるT細胞の一種です。IgA抗体は、主に腸管のパイエル板※4と呼ばれる免疫組織のB細胞によって作られ、B細胞によるIgA産生にはろ胞性BヘルパーT細胞と呼ばれるT細胞からの司令(ヘルプ)が必要であることが知られています。しかし、これらヘルパーT細胞がどのような道筋を経て分化し、免疫応答の複雑なバランスを保っているのかは不明でした。
研究グループは、免疫応答を抑制する制御性T細胞が、腸管パイエル板でろ胞性BヘルパーT細胞へと分化転換し、B細胞によるIgA産生を効率的に誘導することを突き止めました。さらに、そのメカニズムを解析した結果、制御性T細胞の一部がその分化と機能をつかさどる転写因子Foxp3※5の発現を消失して免疫抑制機能を失い、その後パイエル板においてB細胞との相互作用により、ろ胞性BヘルパーT細胞へと分化することを発見しました。
この研究成果は、制御性T細胞が従来考えられてきたような機能が固定化したT細胞ではなく、少なくともその一部は置かれた環境によって免疫応答を促進するヘルパーT細胞へと分化し得るダイナミックな状態にあることを示しています。そして、腸管における免疫応答の正・負のバランスがどのように保たれているかという疑問に、新たなメカニズムを提唱するものです。制御性T細胞からろ胞性BヘルパーT細胞への分化転換を制御することで、腸管免疫バランスの人為的制御が可能になり、腸内細菌と生体とのよりよい共存関係が樹立できるものと期待されます。
本研究成果は、米国の科学雑誌『Science』(3月13日号)に掲載されます。
背景
免疫系は、病気を引き起こすさまざまな細菌やウィルスの感染から個体の生命を守る一方、自分自身の身体や腸管内に生息する共生細菌や食物といった異物に対しては破壊的に反応することなく「寛容」を保っています。生体が生命を健康に維持するためには、免疫応答の正・負のバランスを適切に保つことが大切です。このバランスが負に偏ると免疫不全症を引き起こし、逆に正に偏るとさまざまな自己免疫疾患やアレルギー疾患を発症します。腸管では、この正負のバランスが見事に保たれ、日々取り込まれる病原菌や食物といったさまざまな異物に対して免疫系が機能し、膨大な種類と数に及ぶ腸内細菌が平和的に共存しています。
腸管において腸内細菌の制御に重要な役割を担っているのがIgAと呼ばれる抗体タンパク質です。IgAは、主に腸管のパイエル板と呼ばれるリンパ組織のB細胞で作られ、消化管内に分泌しています。しかし、パイエル板のB細胞は、それ自身でIgAを作ることができず、ヘルパーT細胞からの司令(ヘルプ)があって初めてクラススイッチ※6を受けてIgAを作るようになります。ヘルパーT細胞は、B細胞やマクロファージなどの免疫細胞に働きかけて、その機能を活性化する司令塔の役割を担っており、遺伝子発現の特徴や機能に応じてさまざまなタイプに分類されています。中でも、ろ胞性BヘルパーT細胞と呼ばれるタイプのヘルパーT細胞は、リンパろ胞に存在するB細胞に直接働きかけて、増殖や抗体のクラススイッチ・親和性成熟、抗体産生細胞あるいは記憶B細胞への分化を誘導する重要な役割を担っています。しかし、このIgA産生を誘導するろ胞性BヘルパーT細胞がどのようにして成熟分化するのかは明らかではありませんでした。
一方、T細胞には、免疫応答を増強するヘルパーT細胞とは異なり、免疫応答を抑制する機能に特化した制御性T細胞と呼ばれるT細胞群が存在しています。制御性T細胞は、すでに自己免疫や炎症、アレルギーの抑制に重要な役割を担っていることが分かってきており、腸管でも腸内細菌や食物に対する過剰な炎症反応やアレルギー反応を抑制していることが明らかとなってきました。制御性T細胞は、転写因子Foxp3を特異的に発現し、Foxp3が制御性T細胞の分化と免疫抑制機能をつかさどるマスター転写因子※7として機能しています。ヒトの致死的な遺伝性免疫疾患として知られるIPEX症候群※8では、Foxp3遺伝子の突然変異により制御性T細胞の分化と機能に異常が起こって免疫応答が抑制できなくなるために、さまざまな自己組織の破壊や食物アレルギー、炎症性腸疾患が発症することが知られています。しかし、この制御性T細胞もその分化経路はいまだに謎に包まれています。
また最近になって、堀ユニットリーダーらは、健常マウスから制御性T細胞を純化・単離してほかのマウスに投与すると、多くはFoxp3を発現し続けて安定して抑制機能を示すものの、一部がFoxp3発現を消失して抑制機能を失い、ヘルパーT細胞へと分化転換を起こすことを発見しました(Komatsu et al. PNAS 106: 1903-1908, 2009)。
このように、ろ胞性BヘルパーT細胞と制御性T細胞は、一見異なった研究課題です。しかし、どちらも腸管の恒常性(ホメオスタシス)を維持する上で鍵となる細胞であり、免疫応答の正と負のバランスを保つために重要な働きをします。そこで、それぞれの研究に取り組んでいたグループ・チーム・ユニットが、研究センター内での活発な研究交流により、「Foxp3発現を消失した制御性T細胞が、パイエル板でB細胞によるIgA産生を誘導するろ胞性BヘルパーT細胞へ分化するのではないか」と仮説を立て、この可能性を検討することにしました。
研究手法と成果
- 1.パイエル板において制御性T細胞が、最も効率的にIgAへのクラススイッチを誘導
遺伝的にT細胞を持たないT細胞欠損マウス(CD3ε遺伝子欠損マウス)のパイエル板では、ヘルパーT細胞からの司令がないために、B細胞はIgAを作ることができません。しかし、このT細胞欠損マウスにT細胞を投与すると、B細胞がクラススイッチに必須の酵素であるAID(Activation-Induced Deaminase)を発現してIgAを作るようになります。研究グループはこの実験システムを用いて、Foxp3を発現する制御性T細胞(Foxp3+ T細胞)あるいはFoxp3を発現しない通常の非制御性T細胞(Foxp3- T細胞)のどちらが(あるいは両方が)効率的にIgA産生を誘導するかを調べました。 Foxp3の発現をGFP(緑色蛍光タンパク質: Green Fluorescent Protein)により標識したFoxp3レポーターマウスから、Foxp3+ T細胞およびFoxp3- T細胞をセルソーター※9を使って純化・単離し、それぞれをT細胞欠損マウスに投与しました。その結果、驚くべきことに、免疫応答を抑制するはずのFoxp3+ T細胞を投与したマウスで、B細胞におけるAID発現とIgAへのクラススイッチが最も効率的に誘導されていることが分かりました(図1)。一方、免疫抑制活性を持たないFoxp3- T細胞は、B細胞にAID発現を効率的に誘導することができませんでした。 - 2.制御性T細胞が、Foxp3発現を失ってろ胞性BヘルパーT細胞に分化
免疫応答を抑制するはずのFoxp3+ T細胞が、なぜ抗体産生を促進するヘルパーT細胞として機能するようになったのでしょうか?Foxp3+ T細胞を投与したT細胞欠損マウスのパイエル板を詳しく調べたところ、AIDを発現するB細胞の近傍に、多くのT細胞が存在しますが、これらのT細胞は、Foxp3発現を失っていました(図2)。このFoxp3発現を消失したT細胞は、ろ胞性BヘルパーT細胞と同様の遺伝子発現パターンを示し、ろ胞性BヘルパーT細胞へと分化していることが分かりました。すなわち、Foxp3+ T細胞は、そのFoxp3発現を消失することで免疫抑制機能を失い、抗体産生を誘導するヘルパー機能を獲得していました。 - 3.制御性T細胞のろ胞性BヘルパーT細胞への分化にはパイエル板環境が重要
Foxp3+ T細胞をT、B両方のリンパ球を欠く変異マウスに投与したところ、Foxp3発現の消失が起こるものの、ろ胞性BヘルパーT細胞への分化は見られませんでした。また、Foxp3+ T細胞からろ胞性BヘルパーT細胞への分化転換は、パイエル板だけで起こり、脾臓(ひぞう)やリンパ節といったほかのリンパ組織では起こっていませんでした。これらの結果から、Foxp3+ T細胞からろ胞性BヘルパーT細胞への分化は、Foxp3発現の消失とそれに引き続くろ胞性BヘルパーT細胞への分化という二段階で進み、パイエル板に存在するB細胞との相互作用が必要であることが明らかになりました。
研究グループは、制御性T細胞におけるFoxp3発現の消失により、ろ胞性BヘルパーT細胞への選択的な分化と、B細胞におけるIgA産生が誘導されることを明らかにし、ろ胞性BヘルパーT細胞の新しい分化経路の存在を初めて突き止めました。
今後の期待
免疫応答を抑制する制御性T細胞が、免疫応答を促進するヘルパーT細胞の分化転換を受けるという発見は、免疫系のダイナミックで適応性に満ちた性質を改めて明らかにすることになりました。また、今回の発見は、腸管における正と負の免疫バランスがどのように維持されているのかという疑問に対して、新しいメカニズムを提唱するものといえます。今後、制御性T細胞の分化転換メカニズムを分子レベルで解明することで、腸管における免疫バランスを人為的に制御することが可能になると考えられ、消化管における腸内細菌と生体との共存関係の改良に貢献すると期待されます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫恒常性研究ユニット
ユニットリーダー 堀 昌平(ほり しょうへい)
Tel : 045-503-7069 / Fax : 045-503-7068
粘膜免疫研究チーム
チームリーダー Sidonia Fagarasan(シドニア・ファガラサン)
Tel : 045-503-7029 / Fax : 045-503-7027
お問い合わせ先
横浜研究推進部 企画課Tel : 045-503-9117 / Fax : 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.B細胞、T細胞、制御性T細胞
免疫系を構成する主な細胞であるリンパ球はB細胞、T細胞に大きく分けられる。B細胞は抗体(免疫グロブリン)と呼ばれるタンパク質を作り、この抗体がウィルスや細菌、毒素といった異物に特異的に結合して排除する。T細胞は、T細胞レセプターと呼ばれるタンパク質を細胞表面に持ち、このレセプターを介して異物を特異的に認識して活性化する。T細胞はその働きから、ウィルス感染細胞やがん細胞などを特異的に殺すキラーT細胞、B細胞やマクロファージ(食細胞)などほかの免疫細胞に働きかけてその機能を活性化するヘルパーT細胞に大きく分類されてきた。さらに最近、T細胞には、ほかの免疫細胞(キラーT細胞、ヘルパーT細胞、B細胞、マクロファージなど)に働きかけてその活性化を抑制する機能を持つ制御性T細胞と呼ばれる新たな集団が存在することが明らかにされた。制御性T細胞はリンパ組織中、T細胞の約5~10%を占め、転写因子 Foxp3(※4参照)の発現により、ほかのT細胞と区別される。 - 2.ろ胞
ろ胞とは、多数の細胞が集まって作る袋状の構造のこと。リンパ節やパイエル板といったリンパ組織では、B細胞の存在する領域とT細胞の存在する領域ははっきりと分かれており、B細胞はろ胞内に存在し、T細胞はろ胞を取り囲むように存在する。ろ胞性BヘルパーT細胞は、ほかのT細胞と異なりB細胞の存在するろ胞内に局在してB細胞と相互作用して活性化の司令を出す。 - 3.IgA
抗体(免疫グロブリン)には、哺乳類ではその構造的特徴から大きく分けてIgM、IgD、IgG、IgE、IgAの5種類の型が存在し、それぞれ異なった機能を持つ。IgAは主に腸管などの粘膜組織に存在するBリンパ球により作られ、粘膜上皮細胞を通過して体外へ分泌されて体内への異物の侵入を防いでいる。 - 4.パイエル板
小腸の粘膜固有層に、リンパ球などの免疫細胞が集合して作られるリンパ組織。B細胞がIgAを作るように クラススイッチ(※6参照)を起こす主要な場がパイエル板である。 - 5.Foxp3
ヒトの遺伝性免疫疾患 IPEX症候群(※8参照)の原因遺伝子として2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームが報告した転写因子。2003年に堀昌平ユニットリーダーらにより、この転写因子が制御性T細胞に発現する特異的な分子マーカーで、その分化と機能を制御する マスター転写因子(※7参照)であることが明らかとなった(Hori et al. Science 299: 1057-1061, 2003)。 - 6.クラススイッチ
B細胞は分化した当初は、IgM(とIgD)という型の抗体を合成するが、T細胞からのヘルプを受けて活性化すると、抗体遺伝子に組み換えが起こり、IgGあるいはIgE、IgAなどほかの型(クラス)の抗体を合成するように変化(スイッチ)する。この過程をクラススイッチと呼び、この組み換え過程に必須の役割を果たしているのが酵素「AID」である。 - 7.マスター転写因子
特定の細胞種に分化するためには、その細胞特有の機能を発現するために必要な一群の遺伝子セットを発現することが必要である。一般に、遺伝子の発現は、遺伝子発現制御領域である特定のDNA配列に「転写因子」と呼ぶタンパク質が結合することで調節されている。細胞分化に伴ってある特定の転写因子が働いて、その細胞種に特有の遺伝子セットの発現をオンにすると考えられ、そのようなスイッチとして機能する転写因子をマスター転写因子と呼ぶ。 - 8.IPEX症候群
Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked(X染色体連鎖型免疫調節異常・多発性内分泌障害・腸症)症候群の略。X染色体連鎖型劣性の遺伝様式を示し、変異を受け継いだ男子のみが致死性の自己免疫性・炎症性・アレルギー性免疫疾患を発症する。膵臓、甲状腺、大腸、皮膚などさまざまな臓器に炎症・組織破壊が起こり、患者は通常生後1、2年以内に死亡する。2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームがこの遺伝性免疫疾患の原因遺伝子を同定し、転写因子Foxp3であることを報告した。 - 9.セルソーター
目的の特徴を持った細胞集団を生きたまま分離・回収する装置。免疫蛍光法などにより染色された細胞にレーザー光をあて、発生する蛍光を検出・解析して、その情報を基に特定の細胞集団を生きたまま分離・回収することができる。
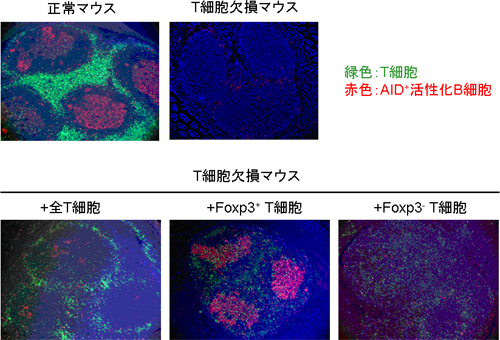
図1 パイエル板で制御性T細胞が、最も効率的にIgAのクラススイッチを誘導する状況
(上段)正常マウス(左)およびT細胞欠損マウス(CD3εノックアウトマウス:右)のパイエル板。正常マウスではT細胞の存在する領域とB細胞の存在する領域(ろ胞)がはっきり分かれており、B細胞が活性化してAIDを発現し(赤色)IgAへクラススイッチを受ける。T細胞欠損マウスでは、B細胞はAIDを発現せずIgAを作ることができない。
(下段)このT細胞欠損マウスに全T細胞(左)を投与すると、投与したT細胞は主にT細胞領域に分布するとともに、B細胞にAIDの発現を(つまりIgAへのクラススイッチを)誘導することが分かる。次に、T細胞をFoxp3の発現に従ってFoxp3+ T細胞(制御性T細胞)およびFoxp3- T細胞(非制御性T細胞)に分離し、それぞれT細胞欠損マウスに投与すると、Foxp3+ T細胞が全T細胞よりも効率的にB細胞のAID発現を誘導する(中)一方、Foxp3- T細胞はB細胞のAID発現を誘導しない(右)ことが分かる。
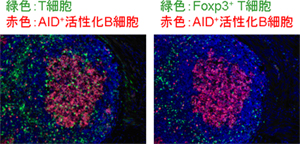
図2 Foxp3+T細胞はFoxp3発現を消失してろ胞性BヘルパーT細胞へ分化する
Foxp3+ T細胞をT細胞欠損マウスに投与すると、B細胞においてAID発現(赤色)を誘導する。T細胞は、主にT細胞領域に分布するが、AIDを発現するB細胞の間にもT細胞が存在していた(左図)。次に、Foxp3を発現するT細胞だけを染色(緑色)したところ、AIDを発現したB細胞領域には存在せず、B細胞の間のT細胞はFoxp3発現を失っていることが分かった(右図)。これらB細胞領域(ろ胞)に分布するT細胞が、ろ胞性BヘルパーT細胞に分化したT細胞である。
