2011年4月7日
独立行政法人 理化学研究所
ES細胞から人工網膜組織の3次元形成に世界で初めて成功
-画期的な自己組織化技術で、組織移植による臓器再生を目指す次々世代の再生医療実現へ-
ポイント
- マウスES細胞から試験管内で初期胚の眼組織「眼杯」の形を再構成
- ES細胞由来の眼杯組織の3次元培養で、多層の人工網膜組織の形成実現
- 幹細胞から臓器の「形」の自己組織化プログラムを解明、次々世代の再生医療を拓く
要旨
独立行政法人理化学研究所(野依良治理事長)は、眼組織のもと(原基※1)である胎児型の網膜組織「眼杯※2」を、マウスES細胞※3から試験管内で立体形成させることに世界で初めて成功するとともに、生後型の網膜組織全層の立体再構築を実現しました。これは、発生・再生科学総合研究センター(竹市雅俊センター長)器官発生研究グループの笹井芳樹グループディレクターと立体組織形成・解析ユニットの永楽元次副ユニットリーダーを中心とした研究グループの成果で、理研VCADプログラム、国立大学法人京都大学再生医科学研究所、国立大学法人大阪大学タンパク質研究所の研究者らの協力のもとに進められました。
哺乳類の眼、特に網膜はいったん障害を受けると、自然に再生しません。このため、網膜色素変性症※4などの網膜変性症※4には治療法がなく、失明に至ることから、幹細胞を利用した再生医療が期待されています。網膜の基本構造※5は、主要な光感知部である神経網膜とそれを助ける色素上皮で構成されます。色素上皮は薄い1層の細胞シートで、ES細胞・iPS細胞からの産生が容易なため、加齢黄斑変性※4などへの細胞移植の臨床研究が進みつつあります。一方、視細胞などを含む神経網膜は多種類の細胞を含む多層構造を持ち、ES細胞などからこうした複雑な組織を形成することは不可能でした。
研究グループは、独自に開発してきた細胞集団からの「3次元の自己組織化※6技術」を応用し、胚の発生を再現する方法でマウスES細胞から試験管内で立体的な網膜組織を形成することに成功しました。3,000個程度のES細胞から細胞凝集塊を作り、特殊な培養液の中で浮遊立体培養を続けると、培養開始9~10日後に初期胚の眼組織である眼杯と酷似した杯状の網膜組織が、3次元的に形成しました。また、研究グループは、ES細胞からのこの複雑な眼杯の形の「自己組織化プログラム」についても、細胞計測とコンピュータシミュレーションを駆使して解明し、3つの単純な力学機序の組み合わせによることも明らかにしました。
この眼杯様の網膜組織をさらに2週間程度、3次元培養を続けることで、生後マウスの網膜に近い神経網膜組織の立体形成にも成功しました。この組織は、神経網膜の主要細胞をすべて含むだけでなく、3次元的に秩序だった多層構造※7を有し、神経細胞間のシナプスを形成していることも確認しました。
この研究成果は、多能性幹細胞※3から生体の眼組織に酷似した人工網膜組織を産生することができるという画期的なものです。「次世代再生医療」の研究では、主に、ES細胞・iPS細胞から分化させた1、2種類の細胞を用いて、それらを単に細胞(あるいは細胞塊)として移植することを目指してきました。今回の成果は、そのさらに先に進むもので、「生体に近い複雑な組織」の産生と移植による高度な機能再生を目指す「次々世代の再生医療※8」を切り拓くものと考えられます。
本研究成果は、文部科学省の「再生医療の実現化プロジェクト」の一環として行い、英国の科学誌『Nature』4月7日号に掲載されます。
背景
ES細胞やiPS細胞などの多能性幹細胞は、すべての種類の体細胞に分化する能力(多能性)を有しており、試験管内で医学的に有用な細胞を産生する提供源として注目を集めています。例えば、ある細胞種が生体内で変性するために起こる病気に対し、ヒトES細胞・iPS細胞などから分化させた細胞を移植して治療しようとする再生医療は、難病克服の切り札として期待が寄せられています。
研究グループは、これまでに、ES細胞などから神経細胞やその前駆細胞を効率良く分化させる方法として、無血清凝集浮遊培養法(SFEBq法)※9という簡便な方法を開発しています(2005年2月7日プレス発表)。この手法は、ES細胞やiPS細胞を分化誘導する際に、通常の細胞培養で添加する牛血清や増殖因子※10を除いた培養液で培養する方法で、3,000個程度の細胞を凝集させ浮遊状態で培養します。
すでに、この方法で、マウスやヒトのES細胞・iPS細胞から、中脳ドーパミン神経細胞、大脳神経細胞、網膜細胞、小脳細胞、視床下部内分泌細胞などに試験管内で分化誘導することに成功してきました。現在、この技術の応用として、パーキンソン病や加齢黄斑変性などの治療を目指した前臨床研究が、理研、先端医療センター研究部門、京都大学などの共同研究で進められています。
このように、研究グループのこれまでの成果は、多能性幹細胞由来の細胞移植を目指す「次世代の再生医療」の推進に大きく貢献してきました。しかし、単純な1、2種類の細胞の移植で治療できる疾患は限られており、難病の治療などを含むより多くの場合には、生体内と同様に複数の種類の細胞が複雑な組織構造を形成して働く必要がありました。そのため、多能性幹細胞からこうした「複雑な組織構造」の立体形成を試験管内で再現できるかが、基盤技術上の大きな課題でした。
研究グループは、この数年間、基礎的な脳発生の研究成果を基に、「複雑な組織構造」の立体形成を研究し、ES 細胞からのSFEBq法による「試験管内での3次元自己組織化技術」を開発してきました。その成果の一部として、2008年にマウスやヒトのES細胞から層構造を持った大脳皮質組織の立体培養に成功しました(2008年11月6日プレス発表)。これは画期的な成果であったものの、形成した組織は、胎児型での大脳発生の初期の構造を有するというところまでで、生後型の大脳に見られる程の複雑な組織構造の形成には至りませんでした。
眼の主要機能部である網膜組織(図1)は、初期胚の間脳組織に由来する中枢神経系組織で、複雑な組織変形を経て形成していきます(図2)。今回、研究グループは、より高度で複雑な網膜組織構造の試験管内での形成に挑戦しました。
研究手法と成果
(1)マウスES細胞から高効率な網膜前駆上皮組織を分化誘導
これまでに研究グループは、分散したマウスES細胞を小さなくぼみ(細胞が底に接着しないタイプの培養ウェル)の底へ集めて培養することで、2~3時間以内に素早く3次元に再凝集(細胞数は約3,000個程度)させる方法「SFEBq法」を開発し、数日~1週間程度浮遊培養して、中枢神経系の前駆細胞に高い効率で分化させることに成功していました。今回、研究グループは、網膜前駆組織※11への分化に適した培養液を検討するなどの改良を行いました(改良SFEBq法)。さらに、胎児型の網膜前駆組織が、上皮構造(1層の細胞のシート構造)を持つことに注目し、上皮構造を安定化させることが知られているラミニンやエンタクチンを含む細胞外マトリクスタンパク質の混合物を培養液に添加することで、5割以上の培養細胞を網膜前駆組織(Rxというマーカー遺伝子※12を発現する)に分化誘導することに成功しました(図3)。
(2)ES細胞由来の網膜前駆組織から眼杯を立体形成
この改良SFEBq法を用いて、7日間ES細胞の細胞塊を浮遊培養し続けると、細胞塊の中に形成した網膜前駆組織の上皮構造に大きな変化が起きることが分かりました。最初に網膜前駆組織(Rx陽性)が細胞塊の外へ向かって、袋状に突出しだしました。その後、さらに2日間培養する過程で、袋状の網膜前駆組織のうち細胞塊本体から遠い部分が、今度は袋の内側に向かって自然に陥入するようになりました。その結果、網膜前駆組織は、培養開始10日目までに内外の2層の上皮シートからなるカップ状の構造を形成しました(図4)。
これは、胚発生過程の網膜の原基である「眼杯」に酷似しており、形だけでなく、局所のマーカー遺伝子の発現パターンも眼杯と同様でした。胚の中と同じく、2層の上皮シートのうちカップ状の外側の壁は、色素上皮からなり、色素を蓄積することも分かりました。一方、陥入して形成した内側の壁は、神経網膜の前駆組織に特異的なマーカー遺伝子を発現していました。眼杯は、マウス胎児では胎生10~11日に完成し、直径300μm程度のサイズです。マウスES細胞から形成した眼杯もこれとほぼ同じサイズでした。
このように多能性幹細胞から複雑な器官の原基の3次元形成に成功したのは、世界で初めての成果です。
(3)ES細胞から眼杯組織の立体形成は自己組織化による
このように複雑な眼杯の形成は、ES細胞を単純に均一に凝集させた細胞塊から生じ、しかも均一な培養液の中で浮遊培養しただけで実現しました。単純な要素(この場合は細胞)の集合が、外部からの細かい指示がないにも関わらず、自然と複雑な構造を形成することを「自己組織化」といいます。今回、研究グループは、「ES細胞から複雑な眼杯の自己組織化が起きうる」という大変興味深い現象を発見したことになります。
次に、自己組織化の機序を解明するために、特別に組み上げた長期立体培養用顕微鏡による3次元多光子励起蛍光イメージング※13を数日間かけて行い、細胞凝集塊からの眼杯形成過程を詳細に検討しました。解析の結果、ES細胞由来の網膜前駆組織は、まず色素上皮と神経網膜の領域に自発的に分かれ、神経網膜の組織は外からの力などで変形するのではなく、自らの力で内側にくぼんで行くことが分かりました。すなわち、網膜前駆組織には元々「眼杯の形」を作るプログラムが内在されていて、それが発揮できる環境で培養すると、自然と眼杯を形成する自己組織化が誘発されることが判明しました。
精密な構造決定が必要な眼組織の形成に、こうした内在的な「自己組織化プログラム」が働いていることは大変興味深く、これまで全く未知のメカニズムでした。
(4)眼杯組織の「かたち」を決める力学的原理の解明
次に、眼杯形成における内在的な「自己組織化プログラム」について、詳細な解析を行いました。研究グループは、先端的な力学計測法や独自に開発した組織内圧の解析法を駆使して、網膜前駆組織の1層の細胞シートである上皮構造の中での力学特性の動態を調べました。その結果、次のたった3つの「組織構造の局所ルール」を順序だって発揮することで、この複雑な眼杯の形が決定していくことを明らかにしました(図5)。
培養7日までに形成した網膜前駆組織は、ES細胞塊の本体から丸く飛び出した上皮の袋状の構造を示しています(胚の眼胞と良く似ています)。
次の2日間の間に
- 1.飛び出した眼胞様の袋の中で、ES細胞塊本体から遠い部分が神経網膜の前駆組織に運命付けされ、その部分が他の部分より構造的に「変形しやすい柔軟な組織」になります。これは、神経網膜組織では、細胞の中のバネに当たるミオシンが不活性の状態(柔らかいバネの状態)になるためです。
- 2.次に、色素上皮と神経網膜の境目の細胞が特別な「くさび形」に変わり、色素上皮と神経網膜の「折り返し部分」で鋭角なカーブを形成します。
- 3.最後に、神経網膜組織が盛んな細胞分裂により急速に面積が大きくなり、それにより横方向の圧力が生じて、自らを眼杯の内部へ変形させ、陥入して行きます。
研究グループは、これらの局所ルールが働いていることを実験的に観察するとともに、コンピュータによる組織形成シミュレーション※14を用いて、これらの3つのルールだけで確かに眼杯の形が決定できることも証明しました(シミュレーションは京都大学再生医科学研究所および理研VCADプログラムの安達研究室との共同研究で行いました)。
(5)生体組織に酷似した多層の神経網膜組織の3次元形成
さらに研究グループは、試験管内でES細胞から3次元再構築した眼杯組織(胎児型網膜組織)から、生後の眼で見られるような多層の神経網膜組織(生後型網膜組織)の形成に挑戦しました。分化培養10日後に、形成したES細胞由来の眼杯組織を細いピンセットで単離し、さらに14日間立体浮遊培養を行ないました(合計24日間の培養)。すると、その間に眼杯の内壁である神経網膜組織の細胞が盛んに分裂して、自然と重層化するようになりました。培養24日後には、神経網膜を形成する6種類の主要細胞(視細胞、水平細胞、双極細胞、アマクリン細胞、神経節細胞、ミュラー細胞)のすべてを含み、しかも、それらが生後の眼組織に見られるように順序正しい層状構造を形成しました。また、神経網膜組織内のシナプスの形成も形態的に確認しました。分化培養10日後には直径300μm程度のカップ状であった神経網膜は、24日間の培養後には2mmの直径に達する大きな上皮構造になっていました(図6)。
このように、今回の研究では、多能性幹細胞にも内在する自己組織化プログラムを誘発することにより、世界で初めて胎児型の網膜組織(眼杯)の立体形成に成功しただけではなく、生後型の網膜組織全層の立体再構築も実現しました。
今後の展望と課題
これまで、眼杯の形成原理について相反する仮説※15が出されていましたが、今回、網膜前駆組織自体が持っている内在的な自己組織化プログラムで眼杯形成が起こることを明確に証明したことで、1世紀にわたる論争に結論を与え、組織・臓器の形の決定機構に新しい概念を導入したことになります。
また、最先端の光学イメージングや力学特性解析などの「細胞の先端定量計測」と「コンピュータによる数理・計算科学的解析」を組み合わせた研究は、新しいライフサイエンスの潮流として注目される「生命動態システム科学」※16を組織(多細胞)レベルで実践した先駆的な例として位置づけられ、「細胞集団を自在に操作し、組織構築をデザインする研究」につながると期待できます。
これまでの「次世代再生医療としての細胞治療」では、多能性幹細胞から個別の細胞を作り、それらをバラバラの細胞(あるいは単純な細胞塊)として移植することを念頭にした研究開発が行われてきました。今回の成果は、こうした考え方から大きく飛躍して、高度の機能性を有する「人工生体組織」を試験管内で多能性幹細胞から形成させ、それを移植する「次々世代の再生医療」の可能性を拓く画期的なものです(図7)。
2008年の大脳皮質組織の形成に加え、今回の網膜組織の成果で、3次元培養による自己組織化技術は、人工組織・器官の開発で高い有用性と可能性を持つことが示されました。特に、多能性幹細胞由来の人工網膜組織については、これまでの細胞移植法のアプローチでは十分な組織再生が見込めなかった神経網膜でも、再生医療の実現に近づける大きな一歩となることが期待できます。
特に視細胞のゆっくりとした変性・壊死により起こる網膜色素変性症は国内に数万人の患者が存在し、失明に至る重篤な網膜疾患です。多くは遺伝性で、その原因となるいくつかの遺伝子も同定されていますが、これまで有効な治療法はありませんでした。今回の研究成果により、多能性幹細胞から視細胞を含む神経網膜の立体組織を形成し、しかもmm単位のスケールで実現したことで、患者の傷んだ神経網膜に重層する「網膜シート組織移植」の材料作製が、試験管内で可能となる道筋がついたことになります。
こうした可能性を現実のものとするため、研究グループではすでにヒトES細胞からの立体網膜組織の形成技術の開発を進めています。1、2年の間にヒト人工網膜の産生技術を完成させることを目指し、発生・再生科学総合研究センターの網膜再生医療研究チームとの共同研究で、サルなどの中型実験動物へヒト人工網膜組織を移植し、その有効性を確認する「前臨床研究」へ進める予定です。
また、多能性幹細胞由来の立体網膜組織は創薬、毒性試験、病因研究などでも幅広く利用することが可能で、緑内障(神経節細胞の変性)などの治療法の開発などにも利用されることが期待されます。
発表者
理化学研究所
発生・再生科学総合研究センター 器官発生研究グループ
グループディレクター 笹井 芳樹(ささい よしき)
お問い合わせ先
神戸研究推進部 広報・国際化室
Tel: 078-306-3092 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.原基
胚の中の器官の基となる組織。眼の場合、マウスでは胎生10~11日に形成される眼杯がそれに当たる。原基は形成したあと、さらに局所で成長して、大きな器官を形成する。 - 2.眼杯と眼胞
網膜は、水晶体などの体表外胚葉由来の組織と異なり、中枢神経組織由来である。胚の発生過程で網膜の原基は、間脳の側面から発生し、間脳から外側へ袋状に飛び出すように形成される。この袋状の上皮構造を「眼胞」という。さらに眼胞の一番外側の部分(将来の神経網膜)は、次第に眼胞の内側へ陥入し、内外2層の上皮からなる杯状の組織「眼杯」を形成する。眼杯は、その後さらに大きく成長し、網膜を形成する。 - 3.ES細胞、多能性幹細胞
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を有し、試験管内で培養して未分化なまま無限に増やすことができる細胞を多能性幹細胞という。哺乳類の着床前胚(胚盤胞)に存在する多能性細胞(内部細胞塊)から作製した胚性幹細胞(ES細胞)は、最も典型的な多能性幹細胞である。マウス、サル、ヒトなどで樹立しており、マウスのES細胞を初めて樹立したマーチン・エバンス卿(英国)は2007年のノーベル賞医学・生理学賞を受賞した。そのほか、皮膚細胞などの体細胞に Oct3、 Sox2、 Klf4遺伝子などを導入して初期化し、多能性を持たせたiPS細胞も人工的な多能性幹細胞である。これらの細胞は多能性を有しているため、体のさまざまな細胞に分化する能力があり、再生医療の材料としての利用が期待されている。 - 4.網膜変性症、加齢黄斑変性症、網膜色素変性症
「網膜変性症」は、網膜を構成する特定の種類の細胞が加齢や遺伝的原因などで変性し、脱落するために起こる疾患で、失明を含む強度の視力障害に至る重篤なものである。代表的なものは、色素上皮が加齢などの原因で機能不全を起こして生じる「加齢黄斑変性症」と、視細胞が遺伝的原因などで変性して起こる「網膜色素変性症」である。加齢黄斑変性症は、色素上皮の移植で治療可能であることが動物実験などで確認されている。色素上皮は、ヒトES細胞やiPS細胞からも簡単に作製できることから、世界的にもその移植による臨床研究が進みつつあり、国内でも理研と先端医療センター研究部門との共同研究により臨床試験への準備が進んでいる。一方、網膜色素変性症は、ヒトES細胞やiPS細胞からの分化誘導した視細胞を移植する必要があり、分化誘導技術の難度が高い上、視細胞の移植はいまだ低い効率でしか実現していないため、従来の方法では再生医療への応用にはハードルが高く、画期的な技術革新が求められている。 - 5.網膜の基本構造
網膜は光を受容し、電気シグナルに変換して、さらに情報処理後に、脳の視覚中枢へ軸索を介して情報を伝える重要な感覚組織である。網膜は大きく内外2つの上皮組織が重なってできている。内側は光を受容し、情報処理を行なう神経網膜であり、視細胞などの複数種類の細胞を含む。外側は、視細胞の生存と機能をサポートする1層の細胞シートである色素上皮(色素を多く含むため、そう呼ばれる)からなる。 - 6.自己組織化
1種類あるいは少数の種類の要素が、外部から特別の「指示」となる情報を受けることなく、自分たちの内在的な特性を発揮して複雑な高次の構造を組み上げて行くこと。例えば、雪の結晶形成などのように、パターンのない集合体の中で、自発的な秩序が生まれてパターンが形成されて行く自然現象が観察されるほか、ナノテクノロジーや光学結晶の作製などで工学的にも利用されている。 - 7.神経網膜の層構造
神経網膜は、6種類の主要細胞(視細胞、水平細胞、双極細胞、アマクリン細胞、神経節細胞、ミュラー細胞)からなる。そのうち、組織構造上の支持細胞であるミュラー細胞を除く5つの細胞は、光受容の情報処理を行なう特殊な神経細胞であると考えられ、生後の神経網膜では、外層から内層に向けて、視細胞、水平細胞、双極細胞、アマクリン細胞、神経節細胞の順に整然と層をなした組織構築を行っている。受容した光はまず視細胞で電気シグナルに変換される。そのシグナルはシナプスを介して、水平細胞、双極細胞、アマクリン細胞などで情報処理された後、神経節細胞へ受け渡される。神経節細胞は、長い軸索を脳の視覚中枢へ伸ばし、神経網膜で受容した視覚情報を中枢へ伝達する。 - 8.次々世代の再生医療
これまでの実施されてきた再生医療は体細胞あるいは体性幹細胞の移植であったが、次世代の再生医療では、ES細胞、iPS細胞などのヒト多能性幹細胞から分化させた有用細胞の細胞移植を目指している。さらにその先には、ヒト多能性幹細胞から複数の種類の細胞からなる複雑な有用生体組織を試験管内で作製し、それを組織移植する「次々世代の再生医療」が期待されている。 - 9.無血清凝集浮遊培養法(SFEBq法)
Serum-free Floating culture of Embryoid Body-like aggregates with quick reaggregationの略。ES細胞などを酵素によりバラバラに分散させ、それを3,000個程度の細胞の塊に再凝集させたものを分化培養の材料に用いる。この細胞凝集塊を培養する場合、通常の細胞培養で行うような「細胞を培養シャーレに接着」させて培養する接着培養を行うと、一般に立体的な組織形成が損なわれて、きれいな構造体を作ることができない。そのため、培養容器を「細胞非接着性ポリマー」でコーティングし、細胞や組織が容器に付着しないようにすることで、細胞塊を培養液の中で浮遊させる浮遊培養が有効である。SFEBq法では、血清や転写因子などの神経分化阻害効果のある成分を一切含まない特殊な培養液に浮遊させて数日培養する。この方法により、9割以上の細胞を中枢神経系の細胞に分化させることが可能である。 - 10.増殖因子
細胞培養や生体内において、細胞の増殖を刺激するような活性を有する物質。多くの種類があるが、タンパク質であるものが多い。典型的な増殖因子は、BMP4、Wnt、Fgf、Activinなどである。増殖因子は、増殖刺激以外にも多様な生理活性を持つものが多く、ES細胞などの幹細胞の分化の制御などでも多彩な機能を発揮することが知られている。 - 11.網膜前駆組織
網膜を構成する細胞は、いったん分化するとほとんど分裂せず、形態的にも機能的にも特徴のある細胞となる。網膜細胞に最終分化する前の未熟な細胞で、細胞分裂をする能力を持つ細胞を網膜前駆細胞と呼び、網膜前駆細胞が集合したものを網膜前駆組織という。胚内では平面的に集合して上皮構造(一層の細胞シート状の構造)をとっている。 - 12.マーカー遺伝子
細胞の分化状態や分裂能などの性質を解析するための指標・目印(マーカー)となる遺伝子。そのRNA産物や細胞内あるいは細胞表面のタンパク質などをマーカータンパク質という。今回の研究では、網膜前駆細胞が発現するRxという核タンパク質を、ES細胞が網膜前駆細胞に分化した指標として使っている。一般に、マーカータンパク質に対する抗体をウサギなどで作製し、その抗体に蛍光色素標識したものを用いて、マーカータンパク質の発現の有無を解析する。 - 13.3次元多光子励起蛍光イメージング
極めて短いパルス波(10-13秒程度)で輝度の高い特殊な赤外線レーザーを用いて、分厚い組織の深い層まで高分解能で観察できる顕微鏡システム。本研究では、オリンパス株式会社の協力により、この顕微鏡システムに細胞培養用のインキュベーターを連結させ、1週間以上の期間、細胞を立体培養しながら、リアルタイムで観察できる特殊な光学系を組み上げて、眼杯形成の詳細を観察した。 - 14.コンピュータによる組織形成シミュレーション
本研究では、顕微鏡や力学計測などで想定されたミオシンの活性、組織内の内力の方向、堅さ、細胞増殖による組織拡大などを基に、組織内の力学モデルを作製し、それを用いて眼胞から眼杯への形態形成をコンピュータ上で再現(シミュレーション)した。シミュレーション結果を基に、コンピュータ上で仮想実験を行うことも可能である。 - 15.眼杯の形成原理に関する相反する仮説
眼杯形成は、発生生物学で約一世紀にわたり詳しく研究されてきたが、その形態形成の原理については相反するモデルが提唱されており、結論に至っていなかった。ドイツのハンス・シュペーマン(のちに形成体実験でノーベル医学・生理学賞を受賞)は、両生類の眼胞移植実験から、眼杯形成には水晶体や角膜などの組織は不要であるという可能性を提唱していた。しかし、その後のニワトリ胚などでの多くの実験では、水晶体や角膜などの前駆組織を除去すると、眼胞から眼杯への形成に必要な陥入が起こらないという報告がなされ、神経網膜の陥入は周囲の別の組織(水晶体、角膜、間葉組織など)からの外力で「押されて」起こると考えてられていた。どちらの場合も、胚の中での操作では、複数の組織にダメージを与えてしまい、人為的な2次的影響が生じたと考えられる。今回の研究成果は、シュペーマン以来の論争に確実な結論を与え、眼杯形成には網膜組織だけで十分であり、水晶体や角膜などの他の組織の存在は不要であることを証明した。 - 16.生命動態システム科学
次世代のシステム生物学のあり方として、「細胞の先端定量計測」と「コンピュータによる数理・計算科学的解析」を組み合わせて、複雑な生命現象の動態をシステム解析する研究のアプローチ。細胞内の分子(タンパクなど)動態をシステム解析するものと、多細胞の集団挙動のシステム解析による組織レベルの研究、の2つの領域があり、今回の研究は後者の先駆的な研究例と考えられる。
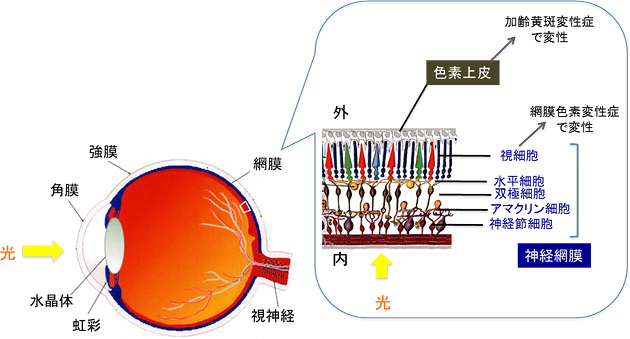
図1 網膜組織の基本構造
網膜は光を感知する感覚組織で、光を受容し電気信号に変換して脳へ伝える「神経網膜」と、その外側を包むように存在する「色素上皮」の2つの組織からなる。光を直接受容する細胞を視細胞と呼ぶが、色素上皮は視細胞の生存と機能に必須の役割を果たす。そのどちらが変性したり、傷んだりしても、著しい視機能の低下をもたらす。
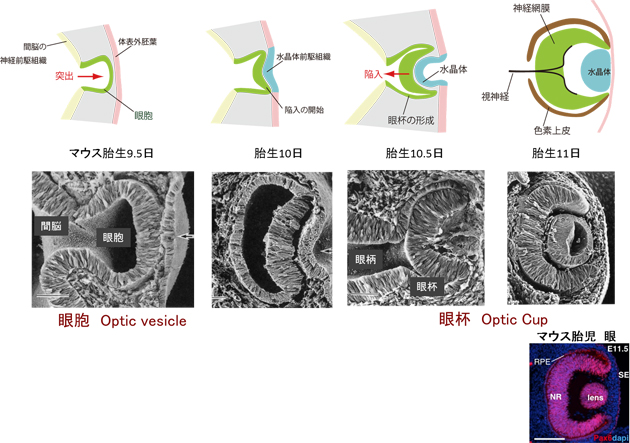
図2 網膜組織の原基(眼杯)の発生
哺乳類胚の発生初期に、間脳の一部が左右に袋状に突出してできた「眼胞」が網膜の起源である。眼胞の体表面に近い部分は神経網膜に、間脳に近い部分は色素上皮に分化する。神経網膜の部分は、胎生10~11日の間に内側に陥入する。その結果、網膜は色素上皮を外側の壁、神経網膜を内側の壁にした2重構造の杯型の「眼杯」を形成する。
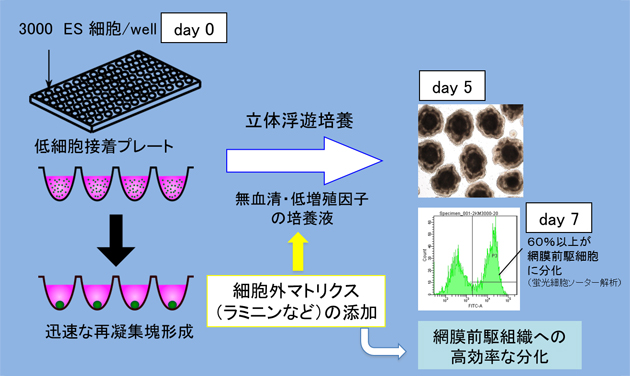
図3 改良SFEBq法によるES細胞からの網膜前駆組織の分化法
マウスES細胞を酵素でバラバラの細胞に分散したものを、3,000細胞ずつウェル(細胞のための小さなくぼみ)に入れ、凝集塊を作らせる。網膜への分化に最適化したラミニンなどの細胞外マトリクスタンパク質を含む培養液で数日間立体浮遊培養すると、網膜前駆細胞へ高効率に分化する。
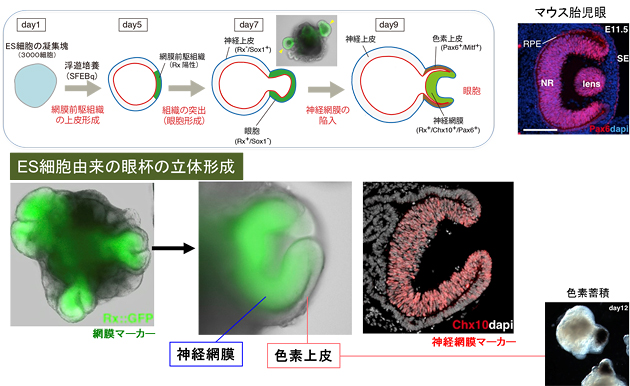
図4 ES細胞塊からの自己組織化による網膜の原基(眼杯)の立体形成
ES細胞塊を5日間、改良したSFEBq法で培養すると、細胞塊の一部が網膜マーカーであるRx陽性の網膜前駆組織(上皮構造)になり、培養7日後にその部分が眼胞のように細胞塊から突出してくる。培養9日後には、袋の先端部が陥入し、眼杯様の構造を自然に形成する(左下図では1つの細胞塊から4つの眼杯が形成)。胎児の眼同様に内側が神経網膜、外側が色素上皮(さらに2日後には色素の蓄積が始まる)に分化する。マウス眼と違い、この眼杯の周りには水晶体などはなく、眼杯の形成は網膜組織だけで自然と形成される「自己組織化」であることが分かる。
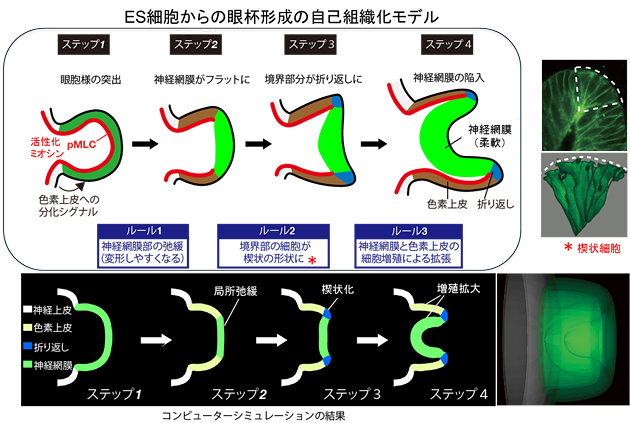
図5 ES細胞由来の眼杯の自己組織化の機序とシミュレーション
今回の研究での解析の結果、胎児眼でもES細胞培養でも、眼杯の形成は4つのステップからなり、たった3つの「組織構造の局所ルール(青字)」によって、その形を決定していることが判明した。そのルールで網膜組織の変形についてコンピュータシミュレーションを行ったところ、この3つのルールだけで眼杯組織の形が3次元的に再現されることも明らかになった。
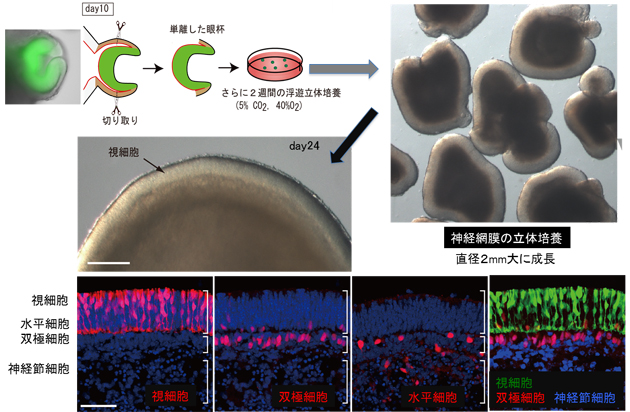
図6 自己組織化によるES細胞からの神経網膜全層の立体形成
ES細胞由来の神経網膜を培養10日後に切り取り、さらに2週間、高濃度の酸素下で3次元浮遊培養を行ったところ、大きく均一に成長し、生後の網膜で見られる視細胞をはじめとする網膜細胞が整然と多層をなした立体構造を形成した。
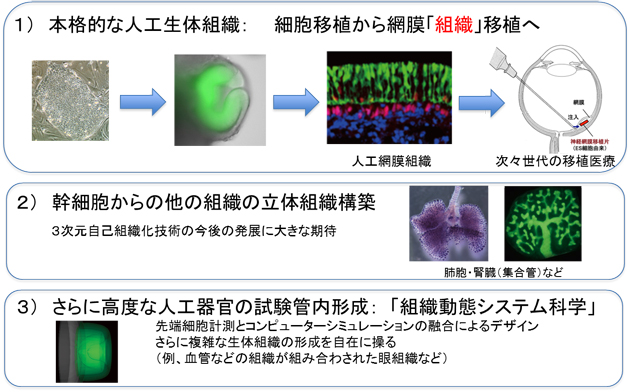
図7 次々世代の再生医療へ:ES細胞からの立体網膜組織の自己組織化の展望
立体網膜などの本格的な人工生体組織の自己組織化技術は、再生医療を次々世代化することが期待される。他にも肺や腎臓など、単なる細胞移植では治療効果が望めない場合が多いため、立体組織構築技術の展開は期待が大きく、網膜での成功はその第一歩といえる。こうした複雑な組織の構築には、単に培養実験だけでなく、先端的な定量細胞計測とコンピュータシミュレーションによる再構築のin silicoデザイン実験が有用であり、今回の研究はこうした「組織動態システム科学」の先駆的な研究成果としても位置づけることができる。
