2011年8月30日
独立行政法人 理化学研究所
カルシウムイオンチャネル「IP3レセプター」の開口メカニズムを解明
-蛍光共鳴エネルギー移動を利用して、IP3レセプターの構造変化を可視化-
ポイント
- 青色と黄色の蛍光タンパク質をIP3レセプターに融合し、蛍光顕微鏡で観測
- 細胞外刺激で細胞内カルシウム濃度を周期変化させる情報符号化メカニズムの解明へ
- 細胞内カルシウム調節異常による病態に対する新規治療薬開発へ第一歩
要旨
独立行政法人理化学研究所(野依良治理事長)は、外部から刺激を受けた細胞が小胞体※1中のカルシウムイオン(Ca2+)を放出する際に、イオンチャンネル(コック)として機能する「イノシトール三リン酸(IP3)レセプター※2」がどのような構造変化を引き起こすのかを明らかにし、その開口メカニズムを解明しました。これは、理研脳科学総合研究センター(利根川進センター長)発生神経生物研究チームの御子柴克彦チームリーダー(JST戦略的創造研究推進事業 発展研究SORSTの「カルシウム振動プロジェクト」研究総括)、篠原理研究員、および分子神経形成研究チームの道川貴章副チームリーダーらによる共同研究の成果です。
研究グループは、代表的な細胞内シグナル伝達物質であるIP3と結合して、Ca2+を放出するためのコックとして働くだけでなく、Ca2+濃度の一過性の上昇を繰り返し起こす現象(Ca2+振動形成)で中心的な役割を担うIP3レセプターの開口メカニズム解明に挑みました。青色と黄色の蛍光タンパク質を融合したIP3レセプターを作製し、IP3やCa2+と結合したときのIP3レセプターの構造変化を蛍光共鳴エネルギー移動(FRET)※3で光学的に検出した結果、IP3とCa2+は、IP3レセプターと結合してそれぞれ異なる構造変化を引き起こすこと、さらに、IP3とCa2+をさまざまな濃度で同時に添加すると、それぞれ単独で添加した場合の単純な和を超えて、FRET効率※4が変化することを見いだしました。また、IP3とCa2+の両者によって生じるFRET効率変化の中から、IP3レセプターの開口状態を表す信号を抽出することにも成功しました。これらの結果を基にIP3レセプター開口モデルを構築、解析したところ、IP3レセプターでは、通常のイオンチャネルで見られるような、チャネルが一度開口してから不活性化状態へ移行するメカニズムとは異なり、開口メカニズムと不活性化メカニズムが互いに独立し、かつ一方へ進むと他方への移行が妨げられる排他的な関係にあるというユニークな分子機構を持つことを明らかにしました。
IP3レセプターの開口メカニズムを明らかにしたことで、細胞外刺激をCa2+振動形成に変換する情報符号化メカニズムの解明や、ストレスによる神経変性疾患などCa2+調節異常による病態に対する新しい治療薬の開発に大きく貢献すると期待できます。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America:PNAS』オンライン版(8月29日付け:日本時間8月30日)に掲載されます。
背景
カルシウムは、私たちの骨格を支える主要元素であるだけでなく、細胞内情報伝達物質として重要な働きを担っています。細胞内のカルシウムイオン(Ca2+)濃度は、通常、細胞外のわずか10,000分の1程度に保たれており、細胞質に浮かぶ小胞体の中に蓄えられていますが、細胞外から種々の刺激が加わると、Ca2+は刺激に応じて小胞体から放出されて、細胞質中のCa2+濃度は一過性に増加します。このように、細胞は細胞質中のCa2+濃度を時間・空間的に多様なパターンで変化させて、神経の興奮、筋収縮、分泌、受精、免疫応答、細胞の運動、細胞死など、多岐にわたる生理現象を制御しています。実際に、ホルモンなどの刺激を受けた多くの細胞を観察すると、細胞質中のCa2+濃度が急峻に上昇したのち、緩やかに元の濃度に戻るスパイク状の時間変化が表れ、このCa2+スパイクが周期的に繰り返し起きるCa2+振動という現象が見られます。Ca2+振動の周期は刺激物質の濃度によって変化し、この周期によって、Ca2+依存性酵素の活性が変動したり、活性化される転写因子の種類が異なったりするため、細胞は、連続的に変化する細胞外の刺激物質の濃度というアナログ値を、Ca2+スパイクの周期というデジタル値に変換し、刺激情報を細胞内へ伝えていると考えられています。
一般に、細胞外からの情報は、刺激物質が細胞表面のレセプターに結合することで細胞に伝えられます(図1A)。刺激を受け取った細胞は、イノシトール三リン酸(IP3)を産生します。IP3は、小胞体膜上に存在し、Ca2+を放出するコックの役目であるIP3レセプターと結合して、細胞質中のCa2+濃度上昇を引き起こします。これまでに、神経細胞のような興奮性の細胞が示す活動電位というスパイクの生成メカニズムについては、ホジキン・ハックスレー方程式※5によってその本質が理解されてきました。しかし、非興奮性細胞を含むより広範な細胞種が示すCa2+振動については、関与するIP3レセプターが小胞体上に存在するため、生きた細胞内でチャネル分子の働きを測定することできず、本質的な生成メカニズムは分かっていませんでした。
そこで研究グループは、2色の蛍光タンパク質で標識したIP3レセプターを作製し(図1B)、生きた細胞にIP3 やCa2+を添加したときのFRETを観察して、IP3レセプターの構造変化を可視化するとともに、詳細な開口メカニズムの解明に挑みました。
研究手法と成果
(1)蛍光タンパク質と融合させたIP3レセプターの作成
IP3レセプターは同一タイプのサブユニットもしくは異なるタイプのサブユニットで構成する四量体を形成してイオンチャネルとして働いています。今回はタイプ1と呼ばれるサブユニットに青色蛍光タンパク質、あるいは黄色蛍光タンパク質を融合させたIP3レセプターを作製し、子宮頸(けい)がん由来のヒト培養細胞であるHeLa細胞に発現させました。作製した融合タンパク質は、野生型レセプターと同様に、IP3結合活性、IP3誘導Ca2+放出活性、四量体形成活性、および細胞質中のCa2+濃度に依存して二相性にCa2+放出活性を変化させるCa2+感受性を保持しており、小胞体上に選択的に局在することを確認しました(図1C)。これらのことから、蛍光タンパク質を融合させたIP3レセプターは、生きた細胞内でイオンチャネルとして働くと考えました。
(2)蛍光共鳴エネルギー移動を利用したIP3レセプターの構造変化の検出と解析
これら2種類の蛍光タンパク質と融合させたIP3レセプターを、遺伝子導入により同じHeLa細胞に同時に発現させました。2種類の蛍光タンパク質で標識したサブユニットを含む四量体のIP3レセプターでは、レセプター分子の構造変化に伴って蛍光タンパク質間の距離や角度が変化し、その結果両者間のFRET効率が変わると予想しました。そこで、薬剤処理により細胞膜を透過性にして、数十ナノモル(nM)から数マイクロモル(μM)程度でさまざまな濃度のIP3およびCa2+を別々に添加し、2種類の蛍光タンパク質間のFRET効率の変化を蛍光顕微鏡により計測しました。その結果、IP3添加でFRET効率は有意に上昇する一方(図2A、C)、Ca2+添加でFRET効率は減少することを見いだしました(図2B、D)。このことは、IP3結合によりIP3レセプター内で標識部位であるアミノ末端領域は近づくように構造変化を起こすこと、一方Ca2+結合により標識部位は遠ざかるように構造変化を起こすことを示しています。さらに、IP3とCa2+を同時に添加すると、それぞれ単独で添加した場合の単純な和を超えて、FRET効率が変化することを見いだしました(図2E)。特に、IP3およびCa2+存在下で測定したFRET効率変化から、Ca2+だけで生じたFRET効率変化を差し引くと、IP3レセプターの開口状態を表す信号を抽出することが可能であると分かりました(図3)。この結果は、IP3レセプターを構成する4つのサブユニットのアミノ末端領域間の相対位置が、チャネルの開口状態と相関があることを示しています。
(3)IP3レセプターの開口モデルの構築
取得したFRET効率変化から、IP3やCa2+がIP3レセプターと結合したときのIP3レセプター開口モデルを構築しました(図4)。このモデルが示すように、他のイオンチャネルで見られるような、チャネルが一度開口してから不活性化状態へ移行するメカニズムとは異なり、IP3レセプターでは、開口メカニズムと不活性化メカニズムが互いに独立しており、かつ一方へ進むと他方への移行が妨げられる排他的な関係にあるというユニークな分子機構を持つことを明らかにすることができました。
今後の期待
今回、光学的にイオンチャネルの構造変化を可視化することで、IP3レセプターの開口メカニズムを初めて明らかにすることができました。今後、Ca2+スパイク形成の分子機構を定量的に明らかにすることで、シナプス可塑性、筋収縮、分泌、受精、免疫応答、細胞の運動、細胞死など、さまざまな生命現象を制御しているカルシウムによる情報符号化のメカニズムを解明することができると期待できます。
発表者
理化学研究所
脳科学総合研究センター 分子神経形成研究チーム
副チームリーダー 道川 貴章(みちかわ たかゆき)
Tel: 048-467-5906 / Fax: 048-467-6079
脳科学総合研究センター 疾患メカニズムコア 発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
Tel: 048-467-9745 / Fax: 048-467-4744
お問い合わせ先
脳科学研究推進部 企画課Tel: 048-467-9654 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.小胞体
真核細胞の細胞質内に網目状に広がる膜系。微細なため通常の光学顕微鏡では見ることができない。形態は細胞の種類によって多様であり、核の外膜と連続している。膜の細胞質側表面に多数のリボソームが付着している粗面小胞体と、リボソームがまったく付着していない滑面小胞体とに大別されるが、それぞれの膜同士はところどころで連続している。粗面小胞体は、肝臓、膵臓などの分泌臓器細胞に発達し、分泌タンパク質や細胞膜タンパク質などを合成している。滑面小胞体は、タンパク質以外の脂肪、リン脂質、コレステロールなどの複合脂質を合成している。また、タンパク質の輸送、代謝、Ca2+の貯蔵などの機能を果たしている。 - 2.イノシトール三リン酸(IP3)レセプター
細胞内カルシウムイオンチャネル。細胞外情報物質(ホルモンや神経伝達物質)が細胞膜にある受容体に結合した結果、細胞膜の構成成分の1つであるホスファチジルイノシトール二リン酸が、ホスホリパーゼCによって加水分解されて細胞内にIP3を生じる。IP3は代表的な細胞内シグナル伝達分子で、Ca2+貯蔵庫である小胞体から細胞質へのCa2+の放出を促進する。 - 3.蛍光共鳴エネルギー移動(FRET)
近接した2個の色素分子(または発色団)の間で励起エネルギーが、電磁波にならず電子の共鳴により直接移動する現象。このため、一方の分子(供与体)で吸収された光のエネルギーによって他方の分子(受容体)にエネルギーが移動し、受容体が蛍光分子の場合は受容体から蛍光が放射される。 - 4.FRET効率
FRET効率は、分子間の距離の6乗の関数として距離とともに急速に減少する。これを応用して、両分子間の距離をFRET効率から計算することができる。 - 5.ホジキン・ハックスレー方程式
神経細胞に見られる活動電位について、現象論的に詳細に記述した式である。A. L. Hodgkin とA. F. Huxleyは、B. Katzとともに、ヤリイカの巨大神経軸策を用いて、軸策内外のイオン濃度をコントロールし活動電位などを測定し、神経細胞膜の性質を初めて詳細に調べた。さらに、興奮伝導のナトリウム説を提唱し、その功績によりノーベル生理学賞を受賞している。その説を数式で示したものが、ホジキン-ハックスレー方程式(H-H方程式)である。
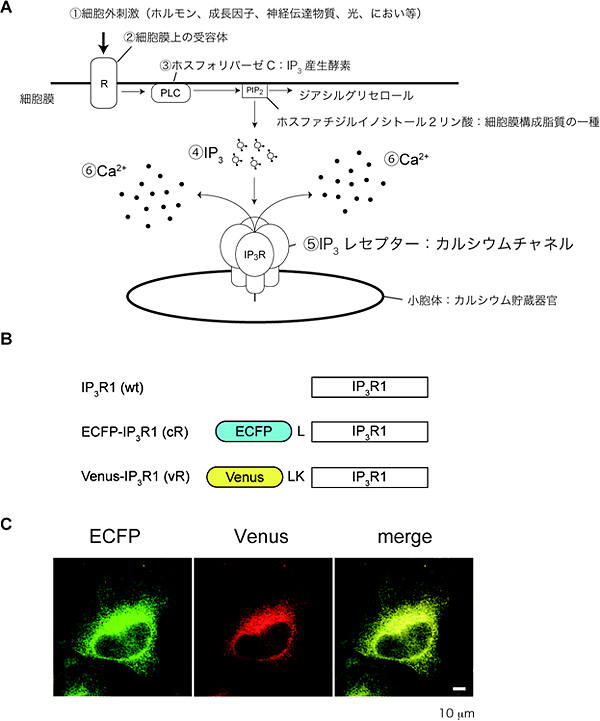
図1 Ca2+シグナルと蛍光タンパク質を融合したIP3レセプター
(A)IP3レセプターを介した細胞質Ca2+シグナル形成機構。さまざまな細胞外刺激(1)は、細胞膜上の受容体(2)を介してホスフォリパーゼC(3)を活性化しIP3産生を促進する(4)。IP3は細胞質内に拡散し、Ca2+貯蔵器官である小胞体上に存在するIP3レセプター(5)に結合することでチャネル開口を誘導し、細胞質のCa2+濃度上昇(6)を引き起こす。
(B)青色蛍光タンパク質(enhanced cyan fluorescent protein: ECFP)および黄色蛍光タンパク質(Venus)を融合させたIP3レセプターの模式図。ロイシン残基(L)およびロイシン、リジン残基(LK)で蛍光タンパク質とIP3レセプターをつないでいる。
(C)蛍光タンパク質で標識したIP3レセプターの細胞内分布。merge:青色蛍光タンパク質のシグナルと黄色蛍光タンパク質のシグナルを重ねて示している。
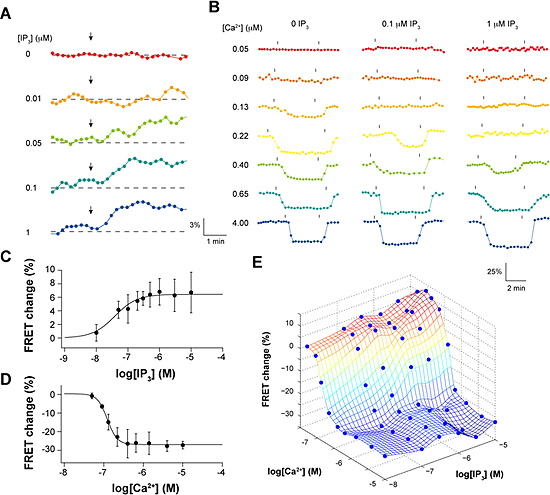
図2 IP3およびCa2+添加によるIP3レセプターのFRET効率変化
(A)IP3添加によるFRET効率変化。
IP3濃度が増えるにつれて、FRET効率が上昇する。
(B)Ca2+添加によるFRET効率変化。
Ca2+濃度が増えるにつれて、FRET効率が減少する。
(C)IP3添加による最大変化値をIP3濃度に対してプロット。
(D)Ca2+添加による最大変化値をCa2+濃度に対してプロット。
(E)IP3およびCa2+同時添加によるFRET効率変化。
IP3やCa2+単独添加の単純な和を超えてFRET効率が変化している。
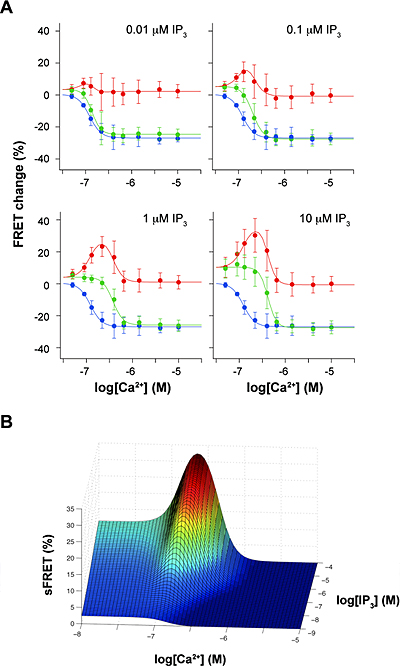
図3 IP3とCa2+同時添加とCa2+単独添加のFRET効率変化の差
(A)Ca2+だけで生じたFRET効率変化(青色)を、IP3とCa2+を同時に添加した時に生じたFRET効率変化(緑色)から差し引いた値(赤色)。
(B)差し引かれたFRET値(sFRET)とIP3およびCa2+濃度との関係。
sFRETは既知のチャネルの開口状態とよく一致する。
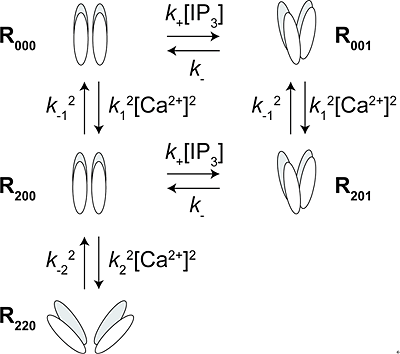
図4 IP3レセプター開口モデル
測定したFRET変化を再現するモデル。
四量体チャネル1分子あたり、4分子のCa2+および1分子のIP3が結合する。
R000:リガンドが何も結合していない状態のチャネル
R200:開口に関与するCa2+が2分子結合したチャネル
R220:R200に不活性化に関与するCa2+が2分子結合したチャネル
R001:IP3が1分子結合したチャネル
R201:開口に関与するCa2+が2分子、IP3が1分子結合したチャネル
R000のFRET効率を基準(ゼロ)とした場合、R200は変化せず、R001およびR201は正のFRET変化を示し、R220は負のFRET変化を示す。R201が開口状態であり、R220が不活性化状態である。R000とR001はわずかに開口している。
