ポイント
- 制御性T細胞と「マスター転写因子」Foxp3の定説を覆す
- 制御性T細胞にはFoxp3発現を記憶する潜在型がある
- Foxp3発現の記憶にはDNA脱メチル化が重要
要旨
独立行政法人理化学研究所(野依良治理事長)は、免疫応答を抑制する働きをもつ制御性T細胞※1が、さまざまな状況に置かれてもヘルパーT細胞※1へと分化せずに安定的に分化した状態を維持することを発見しました。またその安定性を保つためにはFoxp3遺伝子のDNA脱メチル化※2が重要であることを突き止めました。これは理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫恒常性研究ユニット堀昌平ユニットリーダーらを中心とする国際共同研究グループの成果です。
制御性T細胞は、自己免疫疾患やアレルギー疾患など過剰な免疫応答を抑制する働きがあり、この機能を利用した免疫疾患の治療法が世界中で研究されています。これまで制御性T細胞は“マスター転写因子”※3であるFoxp3※4が特異的に発現し、その発生・分化と免疫抑制機能がコントロールされると考えられてきました。一方、2009年に免疫恒常性研究ユニットらは、Foxp3を発現したT細胞※1(当時は制御性T細胞と解釈)がある環境下に置かれるとFoxp3の発現を失って免疫応答を促進するヘルパーT細胞へと分化することを報告しました。制御性T細胞は体内で安定的に存在すると考えられてきましたが、この報告をきっかけに環境変化に対する制御性T細胞の安定性について論争が起きるとともに、制御性T細胞を用いた免疫疾患治療の有効性と安全性にも疑問を投げかけることになりました。
今回、研究グループは、マウスを用いてフェイトマッピング解析※5を行って、Foxp3を発現しているT細胞(Foxp3+ T細胞)がどのような細胞に分化するのかを調べました。その結果、Foxp3+ T細胞は制御性T細胞のほかにも非制御性T細胞を少数含むことが分かり、ヘルパーT細胞に分化するのは制御性T細胞ではなくFoxp3を一過的に発現する非制御性T細胞であることを突き止めました。また、一部の制御性T細胞は一過的にFoxp3の発現を失うものの、それらはFoxp3の発現を記憶しており、活性化によって再びFoxp3と免疫抑制活性を発現する“潜在型”制御性T細胞であることを見いだしました。さらに、制御性T細胞はFoxp3遺伝子の発現制御領域をDNA脱メチル化することによってFoxp3の発現を記憶して安定に分化した状態を維持していることが分かりました。
今回の成果は、制御性T細胞の安定性に関する論争に決着をつけるとともに、さまざまな免疫疾患の治療に用いることができる制御性T細胞の作製・誘導に道を開くものと期待できます。本研究成果は、米国の科学雑誌『Immunity』オンライン版(2月9日付け:日本時間2月10日)に掲載されます。
背景
免疫系は、生体内に侵入した細菌やウイルスなどの病原体を認識して排除し、病気や感染から生体を守る高度なシステムです。このシステムでは、多種多様な免疫細胞群がお互いに連携しながら働いていますが、その応答が過剰になると正常な細胞や組織まで攻撃してしまい、生体に悪影響を及ぼします。そのため免疫応答は、アクセルとブレーキ機能をバランス良く保つことが重要です。
制御性T細胞は免疫応答を抑える機能を持ち、自己免疫疾患、炎症性疾患、アレルギー疾患、移植片対宿主病や、移植臓器に対する拒絶反応などで起こっている過剰な免疫応答を抑制する重要な役割を担っています。2003年に現免疫恒常性研究ユニットの堀ユニットリーダーらは、ヒト自己免疫疾患(IPEX症候群)※6の原因遺伝子として同定された転写因子Foxp3が制御性T細胞の“特異的な”分子マーカーであり、その発生・分化と免疫抑制機能を司る“マスター転写因子”であることを明らかにしました(Hori et al., Science, 2003)。これまでの研究から制御性T細胞は安定にFoxp3を発現することでさまざまな状況に応じて免疫応答を抑制することができると考えられてきました。そして、この広範で安定な免疫抑制機能を利用して、制御性T細胞を移植する免疫疾患治療法の試みが世界中で行われています。その一方で、2009年に免疫恒常性研究ユニットらは、Foxp3を発現しているT細胞(Foxp3+ T細胞)を、T細胞を持たない変異マウスに移植した場合や、炎症環境下に置いた場合に一部がFoxp3の発現を失って免疫応答を促進するヘルパーT細胞へと分化することを見だしました(Komatsu et al., PNAS, 2009; Tsuji et al., Science, 2009)。当時、この成果は、制御性T細胞がヘルパーT細胞に分化するという衝撃的な発見でした。その後、このFoxp3+ T細胞がヘルパーT細胞へ分化するという現象は、他の研究グループからも報告されましたが、それに対する反証も報告され、世界的に大きな論争を引き起こしました。また、外的要因により制御性T細胞がヘルパーT細胞へ分化するならば、免疫疾患の治療のために用いた細胞が期待とは逆に疾患を悪化させることにつながりかねません。ヘルパーT細胞が制御性T細胞に分化するという可能性は、制御性T細胞を用いた免疫疾患治療の有効性と安全性に疑問を投げかけるものでもありました。そこで研究グループは、制御性T細胞の安定性を巡る論争に決着をつけるために、Foxp3+ T細胞の分化の仕組み解明に挑みました。
研究手法と成果
研究グループはフェイトマッピング解析と呼ばれる手法を正常なマウスに適用して(図1(A))、Foxp3の発現の有無と制御性T細胞の分化の関係性について調べました。通常、T細胞は抗原と他の様々な因子によって活性化されることで、ヘルパーT細胞や制御性T細胞へ分化します。この手法でFoxp3を現在発現している細胞を緑色蛍光タンパク質(GFP)で、一度でもFoxp3を発現した経験を持つ細胞を赤色蛍光タンパク質(RFP)でマーキングすることができます(図1(B))。例えば、Foxp3+ T細胞がFoxp3の発現を失えば、それらの細胞はGFP-RFP+細胞として検出することができます。この実験の結果、T細胞のうちFoxp3を発現しているT細胞(Foxp3+ T細胞)の約3~5%の細胞がGFP-RFP+であり、ヘルパーT細胞に分化することが分かりました。(図1(C))次に、正常なマウスのFoxp3が発現していないT細胞(Foxp3- T細胞)を活性化することでFoxp3の発現の有無について調べました。Foxp3- T細胞のなかから抗原に出会ったことのないナイーブT細胞だけを選別して活性化すると、約10%の細胞がFoxp3を発現することが分かりました。しかも、このような活性化によって誘導されるFoxp3+ T細胞は、制御性T細胞とは異なった遺伝子発現を示すことや免疫抑制活性を有さないこと、またこのFoxp3の発現は不安定で、サイトカインなどのシグナルによって容易に失われることを発見しました。つまり、Foxp3は制御性T細胞以外の通常のT細胞においても一過的に発現され得るという予想外の事実を発見しました。
さらに、Foxp3- T細胞の移植実験と上記のフェイトマッピング解析を用いた実験を行ったところ、Foxp3- T細胞を移植された細胞から免疫抑制活性を持たない不安定なFoxp3+ T細胞(非制御性T細胞)が誘導され、T細胞欠損マウスや炎症環境下ではヘルパーT細胞はこれらからのみ分化することを見つけました。一方、免疫抑制活性を示す制御性T細胞を同様の環境に置いてもヘルパーT細胞へ分化することはありませんでした。そして、一部の制御性T細胞は一過的にFoxp3発現を失うものの、活性化させると再びFoxp3と免疫抑制機能を安定に発現するようになり、これらは“潜在型”制御性T細胞であることが分かりました。つまり、制御性T細胞は、Foxp3発現を記憶していることが明らかになりました。(図2)。
そこで、制御性T細胞における頑健なFoxp3の発現と、免疫抑制機能を持たない非制御性T細胞の一過的なFoxp3の発現とでは何が異なるのかを調べました。その結果、Foxp3遺伝子の発現制御領域のDNAメチル化状態が大きく異なることを見だしました。制御性T細胞ではFoxp3発現の有無に関わらず、この領域が完全に脱メチル化されることで遺伝子が常に発現可能な状態に保たれているのに対し、一過的なFoxp3発現を示す非制御性T細胞では、Foxp3を発現するのにも関わらず完全にメチル化されており、遺伝子が不活性化状態であることがわかりました。つまり、制御性T細胞におけるFoxp3発現の記憶はFoxp3遺伝子の発現制御領域のDNA脱メチル化によってコントロールされており、制御性T細胞はこの記憶のメカニズムによって安定に分化状態を維持していることが分かりました。
今後の期待
今回の成果は、ヘルパーT細胞は制御性T細胞から分化するのではなく、Foxp3を一過的に発現する非制御性T細胞から分化することが示されたように、Foxp3+ T細胞集団には様々な種類の細胞が含まれていることを証明し(図3)、制御性T細胞の安定性を巡る論争に決着をつけることができました。また、制御性T細胞はさまざまな環境においてもFoxp3の発現を記憶して免疫抑制機能を発揮することが分かり、本成果は制御性T細胞を利用した免疫疾患治療法を科学的に後押しすることとなります。またこれまでは、「Foxp3が制御性T細胞の“特異的”分子マーカーでありその“マスター転写因子”である」という過度に単純化された概念が主流でしたが、Foxp3が制御性T細胞の分化と関係なく発現し得るという発見は、これまでの学術界の定説を覆すものとなります。今後は、頑健なFoxp3発現を誘導するメカニズムの解明を目指します。将来的に安定な免疫抑制活性を備えた制御性T細胞を人為的に作製・誘導することが可能になれば、免疫疾患の治療に大きく貢献すると期待できます。
原論文情報
- Takahisa Miyao, Stefan Floess, Ruka Setoguchi, Herve Luche, Hans Joerg Fehling, Herman Waldmann, Jochen Huehn, Shohei Hori.
“Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells” Immunity, 2012
DOI 10.1016/j.immuni.2011.12.012
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫恒常性研究ユニット
ユニットリーダー 堀 昌平(ほり しょうへい)
Tel: 045-503-7069 / Fax: 045-503-7068
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.制御性T細胞、ヘルパーT細胞、T細胞
T細胞は、T細胞レセプターと呼ばれるタンパク質を細胞表面に持ち、このレセプターを介して異物を特異的に認識して活性化する。T細胞はその働きから、ウィルス感染細胞やがん細胞などを特異的に殺すキラーT細胞、B細胞やマクロファージ(食細胞)などほかの免疫細胞に働きかけてその機能を活性化するヘルパーT細胞に大きく分類されてきた。さらに最近、T細胞には、ほかの免疫細胞(キラーT細胞、ヘルパーT細胞、B細胞、マクロファージなど)に働きかけてその活性化を抑制する機能を持つ制御性T細胞と呼ばれる新たな集団が存在することが明らかにされた。制御性T細胞はリンパ組織中、T細胞の約5~10%を占め、転写因子Foxp3( ※4参照)の発現により、ほかのT細胞と区別されてきた。しかし、今回の研究成果によりFoxp3を発現していても制御性T細胞でない場合もあることが分かった。 - 2.DNA脱メチル化
遺伝子発現の制御様式の1つ。DNAのCpGという配列でシトシンにメチル基が付加される修飾をDNAメチル化という。遺伝子が発現されるか否かを制御している領域がメチル化されると、その遺伝子は不活性化されて発現されなくなる。逆にメチル基が除去される過程を脱メチル化といい、不活性化されていた遺伝子が活性化され発現されるようになる。 - 3.マスター転写因子
特定の細胞種に分化するためには、その細胞特有の機能を発現するために必要な一群の遺伝子セットを発現することが必要である。一般に遺伝子の発現は、遺伝子発現制御領域である特定のDNA配列に転写因子と呼ぶタンパク質が結合することで調節されている。細胞分化に伴ってある特定の転写因子が遺伝子発現制御領域に結合することで、その細胞種に特有の遺伝子セットの発現がオンになると考えられ、そのような最初のスイッチとして機能する転写因子をマスター転写因子と呼ぶ。 - 4.Foxp3
ヒトの遺伝性免疫疾患IPEX症候群( ※6参照)の原因遺伝子として2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームが報告した転写因子。2003年に堀昌平ユニットリーダーらにより、この転写因子が制御性T細胞に発現する特異的な分子マーカーで、その分化と機能を制御するマスター転写因子( ※3参照)であることが明らかとなった(Hori et al. Science 299: 1057-1061, 2003)。しかし、今回の研究成果により、このような過度に単純化された概念に修正が加えられることになった。 - 5.フェイトマッピング解析
特殊な部位特異的遺伝子組換えの原理を使って、ある特定の遺伝子を発現した経験を持つ細胞を永久的に蛍光タンパク質などのマーカー分子で標識して、その細胞の挙動を追跡する解析手法。この手法により、目的の遺伝子を一過的に発現してその後発現を消失してしまった細胞をマーキングすることができる。詳細は 図1を参照。 - 6.ヒト自己免疫疾患(IPEX症候群)
Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked(X染色体連鎖型免疫調節異常・多発性内分泌障害・腸症)症候群の略。X染色体連鎖型劣性の遺伝様式を示し、変異を受け継いだ男子だけが致死性の自己免疫性・炎症性・アレルギー性免疫疾患を発症する。膵臓、甲状腺、大腸、皮膚などさまざまな臓器に炎症・組織破壊が起こり、患者は通常生後1、2年以内に死亡する。2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームがこの遺伝性免疫疾患の原因遺伝子を同定し、転写因子Foxp3であることを報告した。
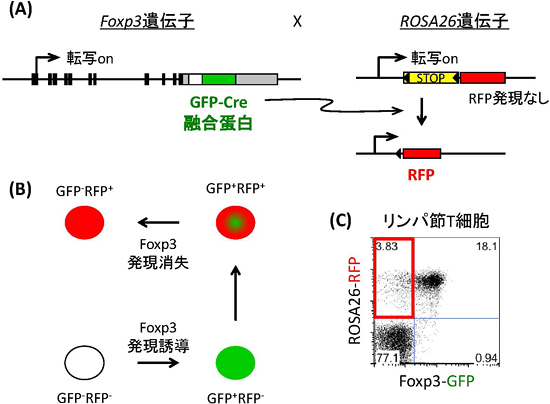
図1 フェイトマッピング解析について
- (A) この手法は、Cre-loxP部位特異的組換え※を利用する。まず、Foxp3遺伝子にGFP-Cre融合タンパク質遺伝子を導入した遺伝子改変マウス(a)を作製。また、全身で常に発現するROSA26遺伝子にloxP配列で挟んだSTOPカセットとRFPタンパク質遺伝子を導入した遺伝子改変マウス(b)を共同研究者より入手した。次に(a)と(b)を交配させる。すると、Foxp3遺伝子が発現した場合、GFP-Cre融合タンパク質遺伝子も発現し、緑色の蛍光を発すると同時にCreがloxP配列を認識してSTOPカセットを部位特異的組換えにより除去して、RFPタンパク質が発現する。(GFP+RFP+)また、Foxp3遺伝子が発現しない場合、GFP-Cre融合タンパク質遺伝子も発現しないので、CreがloxP配列を認識できず、STOPカセットの作用でRFPタンパク質遺伝子は発現しない。(GFP-RFP-)過去にFoxp3遺伝子が発現したが消滅した場合は、ROSA26遺伝子は常に発現するためRFPは発現し続ける(GFP-RFP+)
- (B) T細胞でFoxp3遺伝子発現を誘導すると、GFPによって緑色の蛍光を発し、さらにRFPによって赤色の蛍光を発する。Foxp3遺伝子を消失させると、赤色の蛍光だけが残る。
- (C) このマウスのリンパ節を解析するとGFP-RFP+ T細胞が3-5%存在することがわかり(赤枠)、Foxp3発現を消失したT細胞が存在することがわかる。
- ※
Cre-loxP部位特異的組換え
バクテリオファージ研究で見出された部位特異的組換え反応。loxPという特定のDNA配列を標的としており、DNA組換え酵素Creにより触媒される。現在では条件的遺伝子ノックアウトを実施する目的などで広く使われる技術。
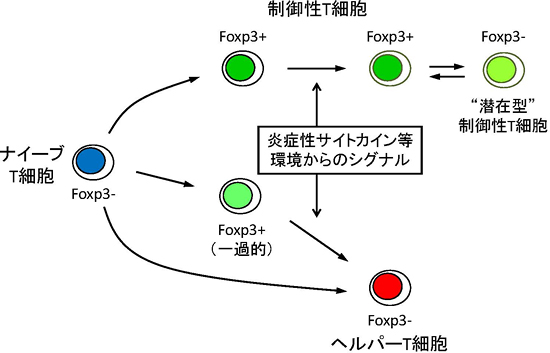
図2 ナイーブT細胞の活性化に伴う一過的なFoxp3の発現
Foxp3-ナイーブT細胞が活性化する際、一部の細胞が免疫抑制機能を獲得することなく一過的にFoxp3を発現する。この活性化によって誘導されるFoxp3の発現は不安定であり、炎症性サイトカイン(炎症を引き起こす物質)などの外部からのシグナルに応じて容易に失われる。一方、制御性T細胞におけるFoxp3発現は頑健であり、さまざまな外的シグナルに対しても安定にFoxp3を発現して制御性T細胞として維持することができる。そして、一部の制御性T細胞は一過的にFoxp3発現を失うものの、活性化によって再度Foxp3を発現し免疫抑制機能を発揮する(“潜在型”制御性T細胞)。
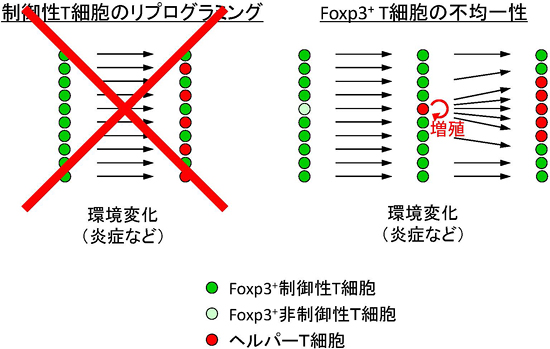
図3 Foxp3+ T細胞集団には制御性T細胞と非制御性T細胞が存在する
ヘルパーT細胞は制御性T細胞から分化するのではなく、Foxp3を一過的に発現する非制御性T細胞から分化することが示された。Foxp3+ T細胞集団は制御性T細胞の他にも少数だが非制御性T細胞を含むことが分かった。非制御性T細胞は、様々な外的要因に対してFoxp3を消失することでヘルパーT細胞へ分化し、炎症などの環境下では選択的に増殖することで蓄積する。一方、制御性T細胞の分化状態は安定であり、外的要因に対しても安定にFoxp3を発現して制御性T細胞として維持できる。
