2012年8月20日
独立行政法人理化学研究所
「第二の脳」と呼ばれる腸管神経系が形成される機構をマウスで解明
-腸管神経系の発生と病気の概念を覆す、腸管神経前駆細胞の近道移動を発見-
ポイント
- 腸管神経系の発生過程を、蛍光タンパク質を利用したライブセルイメージングで解析
- 近道移動する腸管神経前駆細胞が大腸の腸管神経系の大部分を形成
- 腸管神経系を欠損するヒルシュスプルング病の発症メカニズム解明に新たな知見
要旨
理化学研究所(野依良治理事長)は、大腸の腸管神経系※1のもととなる細胞集団を同定し、この集団がどのように小腸から大腸へ移動して腸管神経系を形成するかを突き止めました。先天的に腸管神経系が形成されないヒルシュスプルング病※2の発症メカニズム解明にもつながります。これは理研発生・再生科学総合研究センター(竹市雅俊センター長)神経分化・再生研究室の榎本秀樹研究室長を中心とした成果です。
食道から胃、小腸、大腸と腸管全体の壁内に網目状のネットワークを張りめぐらす腸管神経系は、腸管の動きや分泌、血流の調節に欠かせない神経系です。ヒトの場合、数億個にも及ぶ神経細胞で構成され、脳からの指令がなくても腸管の機能を調節できるため、「第二の脳」とも呼ばれる最も複雑な末梢神経系です。腸管神経系は、胎児の時に神経堤細胞(迷走神経堤細胞)※3と呼ばれる細胞が咽頭・食道の壁に侵入して腸管神経前駆細胞※4になり、腸管壁を口側から食道、胃、小腸、大腸、肛門へと一方向に移動しながら増殖・分化して、網目状の構造を作ると考えられてきました。しかし、この移動の過程では腸管自体も形を変え成長するため、一方向の移動だけでこの変化に対応しながら腸管壁を覆うことができるのかは謎でした。
研究室は、紫外線照射で色が変わる蛍光タンパク質を腸管神経前駆細胞に発現させた遺伝子改変マウスを作製し、腸管神経前駆細胞が腸管壁を移動する様子を「ライブセルイメージング※5」で観察しました。その結果、小腸と大腸が血管を挟んで平行に並ぶ胎令11日ごろ、血管組織(腸間膜※6)を横切って小腸から大腸へ“近道移動”する細胞集団があり、この細胞集団が大腸の腸管神経系の主要な構成細胞であることを突き止めました。さらに、マウスにおいて、この近道移動の障害がヒルシュスプルング病に似た腸管神経欠損を誘導する可能性も見いだしました。
今回の発見は、従来考えられてきた腸管神経系の発生の仕組みを覆すだけでなく、ヒルシュスプルング病の発症メカニズム解明にも大きく貢献すると期待できます。
本研究成果は、文部科学省の新学術領域研究「血管―神経ワイヤリングにおける相互依存生の成立機構」の一環として行い、科学雑誌『Nature Neuroscience』オンライン版(8月19日付け:日本時間8月20日)に掲載されます。
背景
多細胞生物の体が作られる過程では、さまざまな細胞が移動し、適切な場所に分布して器官を形成していきます。細胞移動の障害は器官形成に影響を及ぼし、多様な病態を引き起こします。発生過程で、どの細胞が、どのような経路で移動し、どの程度器官形成に寄与するかを解明することは、器官形成の原理を理解し、器官形成を侵す病態のメカニズム解明に重要な知見をもたらします。
神経系の形成には細胞移動が深く関わっていますが、中でも、腸管神経系は最も長い距離を移動して形成される神経系です。腸管神経系は、体長の数倍にも及ぶ腸管(ヒトでは数メートルにも達する)の全長にわたり、腸管壁の中に網目状構造を形成します。脳からの指令を受けなくても機能できる独自の神経回路を持ち、生命機能の維持に欠かせない腸管の運動・分泌・血流を制御していることから、「第二の脳」とも呼ばれています。
このように高度で複雑な腸管神経系ですが、それを構成する細胞の大部分は、比較的限られた細胞集団である神経堤細胞(迷走神経堤細胞)に由来します。迷走神経堤細胞は頸部の神経堤細胞で、発生早期に咽頭や食道の壁に侵入して腸管神経前駆細胞になり、以後、消化管の壁の中を肛門方向に移動して全ての腸管を覆いながら神経系を形成して行きます。この移動はマウスでは数日、ヒトでは数週間にも及ぶ非常に長い過程です(図1)。従来、この移動は腸管壁の口側から食道、胃、小腸、大腸、肛門への一方向と考えられてきました。
この移動過程で障害が起こると、大腸の末端で神経系が形成されない病態が生じ、ヒトではヒルシュスプルング病として知られています(図2左)。ほとんどのヒルシュスプルング病では大腸末端(肛門側)で腸管神経を欠損しますが、亜型として、小腸や大腸の口側でも部分的に腸管神経を欠損する症例があり、スキップエリア(skip area)と呼ばれています(図2右)。腸管神経前駆細胞が単純に口側から肛門側に一方向に移動するのであれば、移動の障害は大腸末端だけで神経欠損をもたらすはずです。スキップエリアの存在は、腸管神経前駆細胞の移動様式が単純な一方向の移動ではないことを示唆していましたが、その実態は謎のままでした。
研究室は、蛍光タンパク質を組み込んだ遺伝子改変マウスを用いて、腸管神経前駆細胞が腸管壁を覆っていく過程の全容解明に挑みました。特に、長い細胞移動の過程で、移動する「場」である腸管自身も大きく形を変え成長していくことから、この変化に腸管神経前駆細胞がどう対応しながら移動するのかを明らかにするため、発生各段階の細胞の移動の様子をライブセルイメージングで解析しました。
研究手法と成果
ある特定の腸管神経前駆細胞を追跡するため、この細胞に特異的に蛍光タンパク質を発現する2種類の遺伝子改変マウスを用いました。1つは、広く利用されている緑色蛍光タンパク質GFPを導入したGFPマウスです。もう1つは、紫外線や青色光など短波長の光を照射すると、瞬時に緑から赤に変わるKikumeGRを導入したKikumeGRマウスです。このマウスを用いると、腸管神経前駆細胞のうち、光照射した一部の細胞だけの色を変えることができるので、特定の細胞を追跡することが可能です(図3)。これらのマウス胎児(胎令10.5~13.5日)から取り出した腸管を培養しながら、腸管神経前駆細胞の振る舞いを1~2日間にわたって経時的に解析しました。
まず研究室は、胎令12.5日のKikumeGRマウスを使って、大腸の壁内を伸長していく腸管神経系のさまざまな部位に紫外線を照射して、どの部分の前駆細胞が新しい神経系を作るのか解析しました。その結果、腸管神経系は一様に伸長するのではなく、先端から200~300μmの部分が伸長して新しい神経系を作ることを発見しました(図4)。
さらに、この先端部分にある腸管神経前駆細胞がどこから移動してくるかを突き止めるため、発生を1日さかのぼったマウス(胎令11.5日)の腸管を調べました。その結果、大腸の入り口(口側)付近にある前駆細胞ではなく、大腸と小腸の間に挟まれた血管組織(腸間膜)と平行に並んだ前駆細胞群が先端部分を含む大部分の大腸神経系を形成することが分かりました(図5)。
この腸間膜側に並んだ腸管神経前駆細胞の由来を明らかにするために、さらに発生を12時間さかのぼったGFPマウスの腸管(小腸と大腸が腸間膜にある血管を挟んで平行に並ぶ時期:胎令11日)を取り出し、これを丸ごと染色して腸管神経前駆細胞の分布を調べたところ、腸間膜の中央部分に多数の腸管神経前駆細胞を見いだしました(図6左)。さらに6時間さかのぼった腸管(胎令10.7日)を培養して、前駆細胞の動きを追跡(ライブセルイメージング)したところ、実際に腸間膜を横切る腸管神経前駆細胞を確認しました(図6右)。また、この横断をさえぎると大腸の腸管神経系の形成が遅れること、腸間膜を横切る細胞だけで神経系が形成可能であることも明らかにしました。これらにより、小腸に侵入した腸管神経前駆細胞の一部は、胎令10.5日を過ぎると小腸壁を離れ、腸間膜を横切る“近道移動”によって大腸に侵入し、大腸の腸管神経系を形成することを証明しました(図7)。さらに、この“近道移動”にはグリア細胞株由来神経栄養因子(GDNF)※7のシグナルが必要であることも明らかにしました。
また、研究室が2008年に作製したヒルシュスプルング病モデルマウスの胎児を取り出して解析したところ、“近道移動”して大腸に侵入する腸管神経前駆細胞が減少していることが分かり、近道移動の障害が大腸での神経欠損につながっている可能性を見いだしました。また、今回別のヒルシュスプルング病モデルマウスを作製して解析したところ、そのマウスではスキップエリアが起きることも確認し、近道移動する前駆細胞と腸管壁内を移動する前駆細胞の癒合(ゆごう)の障害が、スキップエリアの原因である可能性を見いだしました。
今後の期待
今回、小腸と大腸が平行に並ぶ時期に腸間膜を横切る腸管神経前駆細胞があり、この“近道移動”する細胞集団が大腸の腸管神経系の大部分を形成することが明らかとなりました。近道移動の発見は、これまでの腸管神経系の発生と病気の概念を根本から覆すものです。近道移動が可能なのは、マウスの場合で小腸と大腸が平行に並んでいる約24時間で、この間に大腸側に腸管神経前駆細胞が侵入することが正常な腸管神経系の形成に重要であることを示しています。
一方、ヒルシュスプルング病モデルマウスで近道移動する細胞が減少している事実は、腸管の形の変化と腸管神経前駆細胞の移動が協調して進行することの必要性を示します。ヒルシュスプルング病の原因遺伝子の全容は解明されておらず、今後、近道移動に必要なシグナルが明らかになると、ヒルシュスプルング病を誘導する新たな分子実態が突き止められると期待できます。
現在、ヒルシュスプルング病は手術により大部分の症例で長期生存が可能になっていますが、中には、腸管神経系が腸管のほぼ全長で形成されず、手術による効果が期待できない症例があります。このような患者に対しては、ES細胞(胚性幹細胞)などから腸管神経前駆細胞を作って移植する試みが世界中で始まっています。今回明らかにした大腸神経系を形成する細胞群の性質の解明が進むと、そのような細胞群をES細胞から分化誘導する技術開発にも貢献すると考えられます。
原論文情報
- Trans-mesenteric neural crest cells are principal source for the colonic enteric nervous system, Nature Neuroscience (2012), doi: 10.1038/nn.3184
発表者
理化学研究所
発生・再生科学総合研究センター 神経分化・再生研究室
研究室長 榎本 秀樹(えのもと ひでき)
お問い合わせ先
神戸研究所 広報・国際化室 泉 奈都子(いずみ なつこ)
Tel: 078-306-3310 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.腸管神経系
生体の恒常性を保つ自律神経系に属し、末梢神経系の中で最大の神経系。消化管全長にわたり壁内に存在し、数個~数十個の神経細胞から構成される無数の神経節が神経線維でつながれた網目状構造をとる。ヒトでは神経細胞総数は数億個にも達する。腸管壁内では筋間神経叢(アウエルバッハ神経叢)と粘膜下神経叢(マイスナー神経叢)に分かれ、腸管の運動・分泌・血流を調節する。腸管神経系は、脳からの指令がなくても基本的な機能を遂行できる自律神経回路を内包しており、この特徴からしばしば「第二の脳」と呼ばれる。 - 2.ヒルシュスプルング病
腸管神経系の先天性欠損を特徴とする先天性の腸閉塞疾患。新生児5000人に1人の割合で起こり、胎便排出の遅れ・腹部膨満・胆汁性嘔吐などの症状で見つかる。腸管神経系を欠いた領域の消化管は持続的に収縮した状態となり、腸管内容物が通過できなくなることによる機能的腸閉塞が疾患の本態。停滞した腸管内容物のため、腸管神経を欠いた領域よりも口側の腸管が異常に拡張することから、過去には巨大結腸症とも呼ばれた。放置すれば腸閉塞から腸に壊死や穿孔が起こったり、重篤な腸内感染が併発したりして生命を脅かすため、無神経節腸管を切除し、神経節のある口側腸管と肛門をつなぎ合わせるという外科的処置を必要とする。 - 3.神経堤細胞(迷走神経堤細胞)
神経堤細胞は、発生初期に神経管(神経組織の原器)の背側に生じるせり上がった構造(神経堤)から派生する細胞群。末梢神経系の神経細胞および支持細胞、内分泌細胞、脂肪細胞、色素細胞、平滑筋細胞、骨・軟骨細胞、結合組織などさまざまな細胞に分化するが、その分化能は神経堤細胞が生まれる頭尾軸の位置によって異なる。迷走神経堤細胞は頸部(聴覚器官の原器より尾側)の神経堤に派生する細胞で、発生早期に咽頭や食道の壁に侵入した後に腸管神経前駆細胞となり、腸管神経系の神経細胞や支持細胞の大部分を構成する。 - 4.腸管神経前駆細胞
腸管神経系を構成する未分化な細胞で、発生早期には腸管壁の中を活発に増殖しながら移動し、網目状の構造を作りながら全腸管を覆って行く。腸管神経前駆細胞は腸管神経細胞と支持細胞に分化し、これらの細胞が神経回路を構成して腸管神経系を構築する。 - 5.ライブセルイメージング
組織の中の細胞の振る舞い(形や移動、増殖)を生きたまま観察する技術。オワンクラゲやサンゴ由来の蛍光タンパク質(GFP、Kikume)を目的の細胞に導入し、細胞を生きたまま継時的に蛍光観察する。 - 6.腸間膜
腸管全体を包む2枚の腹膜が合わさった膜のような構造で、腸管に分布する血管・外来性の神経線維・リンパ管を含む。なお、成体では腸間膜という名称通りに膜状の構造を呈するが、発生早期の腸間膜は、腸管と体内壁をつなぐ血管組織をとりまく組織。 - 7.グリア細胞株由来神経栄養因子(GDNF)
グリア細胞株の培養うわずみ液から抽出された神経栄養因子(神経の発生と機能に重要な役割を果たすタンパク質群)で、神経細胞や神経前駆細胞に発現する特異的受容体と結合して細胞内にシグナルを伝える。GDNFのシグナルを欠いたマウスでは、腸管神経をはじめとするさまざまな神経細胞の発生と分化に異常を来たす。
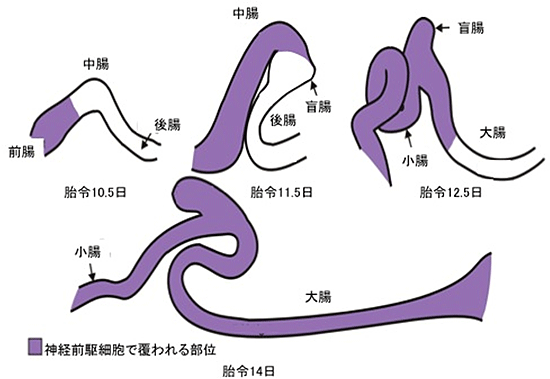
図1 マウス発生過程における腸管神経前駆細胞の移動
マウスでは受精後9~9.5日で神経前駆細胞が未熟腸管壁に侵入する。以後、胎令10.5~11.5日では中腸(将来の小腸)と後腸(将来の大腸)が平行に並び、胎令11.5日で腸管神経前駆細胞は中腸を覆う。12.5日で大腸の入り口に侵入、13.5~14日で大腸末端(肛門)に到達する。この間、腸管も形を変えながら成長していく。
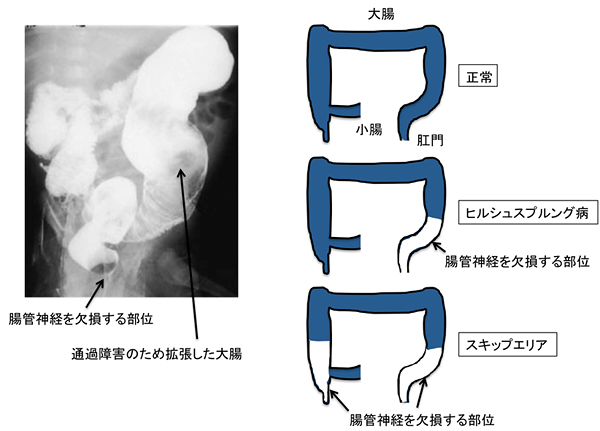
図2 ヒルシュスプルング病とスキップエリア
- (A) ヒルシュスプルング病の造影写真。バリウムを腸に注入して撮影されたもの。腸管神経を欠く部分の大腸は広がることができず、内腔が閉じて観察できない。それより口側で腸管神経のある腸管は、腸管内容物の通過障害のため拡張する。
- (B) 小腸末端から大腸の模式図。正常では全長にわたって腸管神経が存在する(上:青で塗った部位)。ヒルシュスプルング病では腸管末端で神経系の欠損が起こる(中)。その亜型であるスキップエリアでは、大腸末端で神経を欠く他に、口側の腸管の一部でも神経がない部分が存在する。
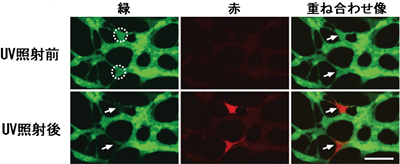
図3 KikumeGRを導入した腸管神経前駆細胞の様子
KikumeGRを組み込んだマウスでは、UV照射前は赤の蛍光は存在しないが、点線で囲んだ部分にUV照射すると、照射された腸管神経前駆細胞だけが赤くなる。これにより、腸管神経前駆細胞全体の動きと、標識した一部の細胞集団を同時に観察することが可能になった。スケールバーは100μmを表わす。
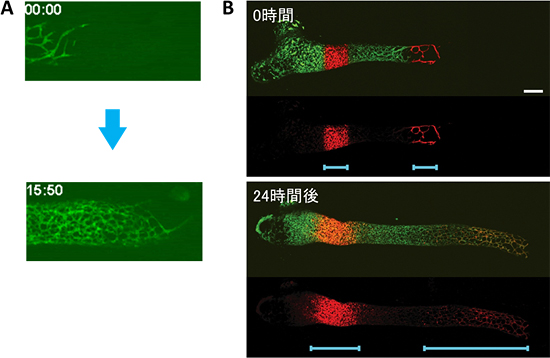
図4 大腸の腸管神経系を形成する腸管神経前駆細胞のイメージング解析
- (A) GFPマウスを用いた腸管神経前駆細胞の伸長の様子(動画から抜粋)。胎令12.5日に大腸の半ばに到達した腸管神経前駆細胞は、網目状の構造を伸ばしながら新しい神経系を作って行く(下:15時間50分後)。
- (B) KikumeGRマウスを用いて異なる部位に紫外線を照射し(上)、24時間後にそれぞれの細胞の移動を調べた(青いバーは赤い細胞を認めた範囲を示す)。伸長した網目状の神経系は、先端部分に位置する細胞群で形成されることが明らかとなった(下)。
スケールバーは200μmを表わす。
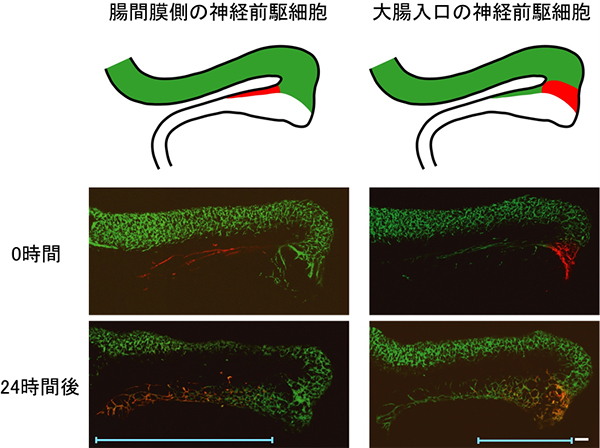
図5 腸間膜側の腸管神経前駆細胞が大腸神経系を構成する
胎令11.5日の腸管では腸間膜側と大腸の入り口に前駆細胞が存在する。
腸間膜側の細胞に紫外線を照射した場合(左)と、大腸入り口側の細胞に照射した場合(右)で、24時間後に大腸での分布の様子を調べた。腸間膜側の細胞が腸管神経系の末端部を含む大部分を構成する。一方、大腸入り口の前駆細胞は、入口近辺の神経系の一部しか構成しなかった。
スケールバーは100μmを表わす。
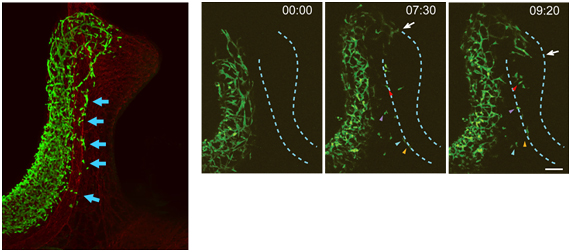
図6 腸間膜を横切る腸管神経前駆細胞
- 左: GFPマウスの胎令11日の腸管をまるごと染色した。小腸にある腸管神経前駆細胞(緑)から、小腸と大腸の間にある腸間膜内の太い血管(赤)を横切る前駆細胞(青矢印)を観察した。
- 右: 胎令10.7日の腸管神経前駆細胞のライブセルイメージング。腸管神経前駆細胞が小腸の末端に到達する頃(1、2枚目:0~7時間30分後)に、一部の細胞が腸間膜を横切って大腸(青色点線で囲った部分)に侵入する姿(色付き矢印)を捉えた。盲腸側を回る腸管神経前駆細胞は、これより遅れて大腸に侵入する(白矢印)。
スケールバーは100μmを表わす。
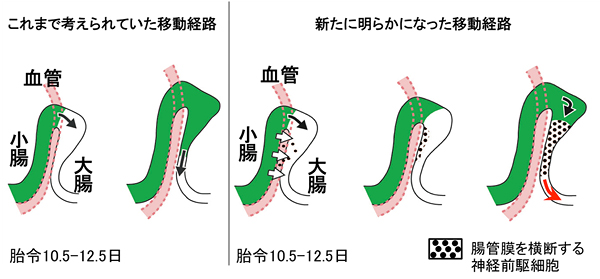
図7 大腸神経系を構成する細胞の移動経路
- 左: これまで考えられていた移動経路 腸管神経系は、腸管神経前駆細胞が腸管壁の中を口側から肛門側に一方向に移動する。
- 右: 新たに明らかになった移動経路 胎児期に小腸と大腸が近接して平行に並ぶ時期に、血管組織(腸間膜)を横断して近道移動(白矢印)する細胞集団(黒点)があり、この細胞群が伸びて(赤矢印)大腸の腸管神経系の主要な部分を構成する。
