要旨
理化学研究所(理研)脳科学総合研究センター分子動態解析技術開発チームの武藤悦子チームリーダー、内村誠一研究員らの共同研究グループ※は、生体内の現象を生体外で再構成して行うin vitro再構成実験[1]と、低温電子顕微鏡法[2]を用いた分子構造解析により、細胞内での物質輸送を担うダイニン分子モーター[3]の活性化機構の解明に向け大きな知見を得ることに成功しました。
細胞内では、分子モーターと呼ばれるタンパク質が、荷物を運ぶ「輸送車」として働いています。この輸送システムが破綻すると、必要な物質が運ばれず、疾患を引き起こします。ダイニンは、微小管[4]と呼ばれる「道路」の上を動く分子モーターで、ATP(アデノシン三リン酸)の加水分解エネルギーを使い、神経細胞の軸索内を細胞体方向へと物質輸送しています。ダイニンの活性は、道路である微小管と結合していないときには低く抑えられていますが、結合することによって数十倍活性化されることが知られています。つまりこれは、ダイニンが微小管の上に来たときだけ“スイッチ”がオンになる仕組みがあることを意味しています。
共同研究グループは、微小管を構成するチューブリン分子[5]の荷電アミノ酸[6]をアラニンで置換した変異体を用い、ダイニンとの相互作用に関わるアミノ酸のふるい分けを行いました。その結果、α-チューブリンの正荷電アミノ酸であるR403、負荷電アミノ酸であるE416の変異により、ダイニンが全く活性化されず、運動の方向性を失うことが明らかになりました。さらに、低温電子顕微鏡法を用いて、ダイニン微小管結合部位(MTBD)が微小管に結合している構造を解析したところ、反対の電荷を持ち、互いに作用していたR403とE416が、ダイニン分子中のアミノ酸(R403はダイニンのE3390、E416はダイニンのR3469/K3472)と静電的に作用していることが示唆されました。この相互作用の組み替えが“スイッチ”としての役割を果たし、ダイニン活性化を実現していると考えられました。
チューブリンのR403変異は、先天性難病である滑脳症[7]の患者で見つかっています。今回の成果は、R403変異によって引き起こされるダイニンの運動機能不全が疾患の原因であることを強く示唆しています。ダイニンと変異微小管のみのシンプルなin vitro実験系が疾患のモデルシステムとして利用できる可能性があり、今後、治療薬開発への応用が期待できます。
本成果は、米国の科学雑誌『The Journal of Cell Biology』オンライン版(1月12日付け:日本時間1月12日)に掲載されます。
※共同研究グループ
理化学研究所 脳科学総合研究センター 分子動態解析技術開発チーム
チームリーダー 武藤 悦子 (むとう えつこ)
研究員 内村 誠一(うちむら せいいち)
研究員 高﨑 寛子(たかざき ひろこ)(現 大阪大学大学院 生命機能研究科 研究員)
研究員 箕浦 逸史(みのうら いつし)
研究員(当時) 八久保 有(はちくぼ ゆう)
テクニカルスタッフ 鮎川 理恵(あゆかわ りえ)
生命システム研究センター 細胞動態計測研究グループ
研究員 藤井 高志(ふじい たかし)
大阪大学大学院 生命機能研究科
教授 難波 啓一(なんば けいいち)
大阪大学蛋白質研究所
教授 栗栖 源嗣(くりす げんじ)
特任研究員 西河 洋祐(にしかわ ようすけ)
法政大学 生命科学部
教授 昆 隆英(こん たかひで)
早稲田大学理工学術院
受託研究員 須藤 和夫(すとう かずお)
背景
細胞内では、分子モーターと呼ばれるタンパク質が、神経伝達物質を含む小胞や細胞小器官などの荷物を運ぶ「輸送車」として働いています。この輸送システムが破綻すると、必要な物質が目的の場所まで運ばれず、神経疾患などを引き起こすことが知られています。ダイニンは、微小管と呼ばれる「道路」の上を動く分子モーターで、ATP(アデノシン三リン酸)の加水分解エネルギーを使って、神経細胞の軸索内を細胞体方向へと物質輸送しています(図1)。
ダイニンの活性は、微小管と結合していないときには低く抑えられていますが、微小管と結合することによって数十倍高まることが知られています。これは、ダイニンが微小管の上に来たときだけ“スイッチ”がオンになる仕組みがあることを意味していますが、その分子メカニズムは明らかになっていませんでした。とりわけ微小管に関しては、技術的な問題から組み替えタンパク質[8]を用いた研究が行われておらず、相互作用に関する情報はほとんど得られていませんでした。
武藤チームリーダーらは、出芽酵母や昆虫細胞を用いて微小管を構成するチューブリン分子の組み替えタンパク質発現・精製システムを開発するなど、研究を進めてきました。今回、共同研究グループは、これらの発現システムとさまざまな分析技術を組み合わせ、ダイニン活性化機構の解明に取り組みました。
研究手法と成果
共同研究グループは、微小管表面に存在する36個の荷電アミノ酸を一つひとつアラニンに置換した酵母チューブリン変異株を用い、ダイニンの運動・機能に重要な役割を果たすアミノ酸の同定を試みました。表現型解析、全反射照明蛍光顕微鏡[9]を用いた1分子イメージング解析と、微小管の滑り運動解析(図2)の結果、α-チューブリンの403番目の正荷電アミノ酸R403と、416番目の負荷電アミノ酸E416がダイニンの方向性運動に必須であることが分かりました。
次に、ダイニンの活性への変異の影響を調べました。野生型微小管では、微小管濃度の増加に伴って活性が上昇します。この上昇率は微小管がない条件に比べ、約20倍にもなり、微小管との相互作用が活性に影響を及ぼすことを示しています。しかし、正荷電アミノ酸R403、負荷電アミノ酸E416をアラニンで置き換えた変異型R403A、E416Aの微小管では、微小管濃度が増加しても活性は全く上昇しませんでした。この結果は、α-チューブリンのR403、E416を介したダイニンとの相互作用が、活性化の“スイッチ”として機能していることを示しています。
さらに、“スイッチ”のメカニズムをより詳細に理解するため、低温電子顕微鏡法を用いて、「ダイニン微小管結合部位(MTBD)-微小管複合体」の構造を解析しました。その結果、正荷電アミノ酸R403の近くにはダイニン分子中のアミノ酸E3390が、負荷電アミノ酸E416の近くにはダイニン分子中のアミノ酸R3469/K3472が配置されていることが分かりました(図3A)。このことから反対の電荷を持ち、互いに作用していたR403とE416が、ダイニン分子中のアミノ酸(R403はダイニンのE3390、E416はダイニンのR3469/K3472)と静電的に作用していることが示唆されました。全体的な構造を見ると微小管のダイニンMTBDとの結合面は多くの負電荷アミノ酸で構成され、ダイニンMTBD側は多くの正電荷アミノ酸で構成されていました。しかし、それぞれ反対の電荷を持つα-チューブリンの正荷電アミノ酸R403とダイニン分子中の負電荷アミノ酸E3390は、電場の穴を生み、相補的な関係性を作り出していることも明らかになりました(図3B)。
これらの結果は、α-チューブリンのR403とダイニン分子中のE3390の相互作用がダイニン活性化“スイッチ”機構の中で、中心的な役割を果たしている可能性を示しています。ダイニンは、微小管負電場の中に置かれたα-チューブリンの正荷電アミノ酸R403という目印を頼りに次の結合場所への一歩を踏み出し、“スイッチ”をオンにしてATP加水分解を誘導する、という一連の作業を繰り返し、一方向の連続的な運動を生み出していると考えられます。
今後の期待
今回、共同研究グループはダイニン分子モーターの活性化が、微小管との間の相互作用の組み替えという“スイッチ”によってコントロールされていることを明らかにしました。“スイッチ”を構成するα-チューブリンのR403の変異は、先天性難病である滑脳症の患者で同定されています。今回の成果は、ダイニンの運動機能不全が疾患の原因であることを強く示唆しており、今後、治療薬開発への応用が期待できます。
原論文情報
- Uchimura, S. Fujii, T. Takazaki, H. Ayukawa, R. Nishikawa, Y. Minoura, I. Hachikubo, Y. Kurisu, G. Sutoh, K. Kon, T. Namba, K. and Muto, E., "A flipped ion pair at the dynein-microtubule interface is critical for dynein motility and ATPase activation", The Journal of Cell Biology, doi: 10.1083/jcb.201407039
発表者
理化学研究所
脳科学総合研究センター 分子動態解析技術開発チーム
チームリーダー 武藤 悦子(むとう えつこ)
研究員 内村 誠一(うちむら せいいち)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.in vitro再構成実験
生体内の現象を生体外で再構成して行う実験。現象を構成するタンパク質を精製して実験に用いる。 - 2.低温電子顕微鏡法
タンパク質などの生体分子を急速に凍結させ、電子顕微鏡で観察する手法。分子を染色しないため、観察像は自然に近い状態を反映していると考えられている。 - 3.ダイニン分子モーター
AAA+ ATPアーゼファミリーに属する分子量約500キロダルトンの巨大タンパク質。6つのAAA+ドメインを持つ。ドメイン4と5の間からストークと呼ばれる構造体が突き出ており、その先端で微小管と相互作用する。 - 4.微小管
α、β-チューブリンタンパク質が規則正しく重合することによって形成される細胞骨格の一種。細胞分裂の中心装置であるため、微小管作用薬は、がん細胞の増殖を抑制する抗がん剤として用いられている。 - 5.チューブリン分子
微小管や中心体を構成する分子量約50キロダルトンのタンパク質。グアニンヌクレオチド結合部位を持つ。重合/脱重合を繰り返すことによって細胞分裂などにおいて機能を果たす。 - 6.荷電アミノ酸
タンパク質を構成する20種類のアミノ酸の中で、電荷を持つアミノ酸。アルギニン、リジンが正電荷を持ち、アスパラギン酸、グルタミン酸が負電荷を持つ。 - 7.滑脳症
脳の表面にしわ(脳回)がなく、滑らかであることを特徴とする疾患。難治性てんかんと知的障害を伴うことが多い。ミラー・ディッカー症候群やX連鎖性滑脳症が知られており、LIS1やDCXなどが原因遺伝子として同定されている。 - 8.組み替えタンパク質
遺伝子組み替え技術を使って作られたタンパク質。人為的に変異を導入するなど、タンパク質のデザインができるため、機能の解析に有用である。 - 9.全反射照明蛍光顕微鏡
レーザー光を全反射させることによってできる100ナノメートル程度のエバネッセント光を利用して蛍光分子を観察する顕微鏡。背景光が抑えられるため、1分子由来の微弱な蛍光も観察することができる。
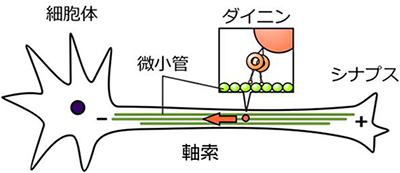
図1 神経細胞の軸索内輸送
ダイニンは、細胞体(微小管のマイナス端)へと物質を輸送する。
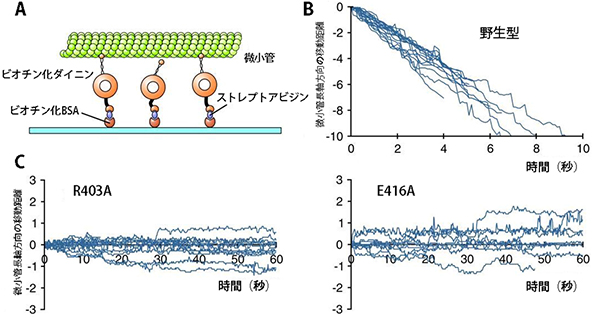
図2 微小管の滑り運動解析
- (A)
滑り運動解析模式図
スライドガラスにビオチン化BSA/ストレプトアビジンを介してダイニンを結合させ、そこにATPと微小管を加える。ガラス面に固定されたダイニンの運動により、微小管の方が動いている様子を観察できる。 - (B)
野生型の微小管移動距離の経時変化
野生型の微小管は時間の経過とともに、一方向に動いている。 - (C)
変異型の微小管移動距離の経時変化
荷電アミノ酸のR403とE416をそれぞれアラニンで置き換えたR403A、E416A微小管を実験に用いた。変異型の微小管は両方向にふらふらと動き、運動方向が定まっていない。
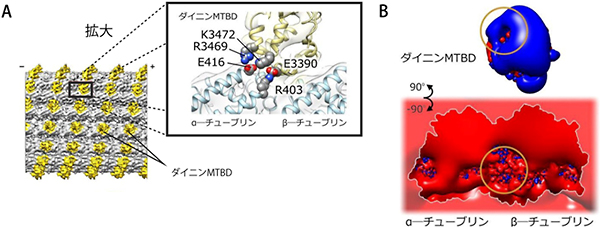
図3 ダイニンMTBD-微小管複合体の構造と電場
- (A)
左図は3次元密度マップ (黄色がダイニンMTBD)、右図は3次元密度マップから作製した構造モデル。
ダイニンMTBD-微小管結合面に形成される静電的相互作用を示している。 - (B)
ダイニンMTBD、微小管の周りの電場。
青は正電場、赤は負電場を示す。○は、α-チューブリンR403とダイニンE3390のある箇所で、電場の穴が空いている。
