要旨
理化学研究所(理研)横山構造生物学研究室の横山茂之上席研究員、ライフサイエンス技術基盤研究センター超分子構造解析研究チームの関根俊一チームリーダー、村山祐子特別研究員らの研究チーム※は、遺伝子の転写を担う酵素「RNAポリメラーゼ[1]」が、転写の状況に応じて機能を変化させる時の、具体的な構造変化やそれを制御するメカニズムを解明しました。
RNAポリメラーゼは、巨大なタンパク質複合体で、DNA上を移動しながらその塩基配列をコピーしてRNAを合成する、転写の役割を担っています。DNAからRNAへの転写は必ずしもスムーズに進行するわけではなく、RNAポリメラーゼは、DNA上で一時停止や後戻りをしたり、誤って転写した箇所を校正[2]したりするなど、多くの作業をこなしながら転写を行います。RNAポリメラーゼは必要な作業に応じた機能を発揮するために、立体構造を変化させ、機能や活性を切り替えていると考えられますが、具体的な構造変化やそれを制御するメカニズムは分かっていませんでした。
研究チームは、RNAポリメラーゼが「タイト型[3]」と「ラチェット型[4]」という2種類の異なる立体構造をとることに着目し、研究の進んでいなかった「ラチェット型」に焦点をあて、転写における役割を詳しく調べました。生化学的解析やX線結晶構造解析により、「ラチェット型」はRNAポリメラーゼの一時停止や後戻り、転写因子に依存したRNAの校正などに必要とされる重要な構造状態であることが明らかになりました。また、RNAポリメラーゼによって合成されつつあるRNAや転写因子が「タイト型」と「ラチェット型」の切り替えに重要な役割を果たしていることも分かりました。これらの成果は、RNAポリメラーゼが転写の状況に応じてその構造を切り替え、その時々に最適な機能を発揮できる仕組みを備えていることを示しており、転写制御の基本原理の解明へ向けて大きな一歩となるものです。
本研究は、日本学術振興会科学研究費補助金基盤研究、文部科学省ターゲットタンパク研究プログラム、文部科学省創薬等支援技術基盤プラットフォーム事業の一環として行われたもので、成果は、米国の科学雑誌『Molecular Cell』のオンライン版(1月15日付け)に掲載されました。
※研究チーム
理化学研究所 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 構造生物学グループ 超分子構造解析研究チーム
チームリーダー 関根 俊一(せきね しゅんいち)
特別研究員 村山 祐子(むらやま ゆうこ)
ニューヨーク大学 医学部 生化学分子薬理学科
教授 Evgeny Nudler(エブゲニー・ヌドラー),
医学部 生化学分子薬理学科
上級研究員 Vladimir Svetlov(ブラディミル・スベトロフ)
背景
生命の設計図である遺伝情報は、細胞内のDNAに塩基の配列として保存されています。生物は、DNAの中で遺伝情報を持つ一部の領域(遺伝子)を、適切な時に適切な場所(細胞)で働かせることにより、その体を維持し、活動しています。遺伝子を働かせるためには、遺伝子の配列が、まずRNAという物質に転写(コピー)される必要があります。次にそのコピーの配列をもとにタンパク質が翻訳(合成)されます。転写をつかさどるRNAポリメラーゼは、すべての生物にとって不可欠な酵素であり、DNAの配列を正確にコピーしてRNAを合成する役割を担っています。RNAポリメラーゼは、複数のタンパク質からなる巨大な複合体で、細菌からヒトまで共通の「カニのはさみ」のような形状をしています注1)。RNAポリメラーゼは、“はさみ”の間に形成された溝にDNAを結合し、はさみの根元にある活性部位で1残基ずつ、DNAの塩基と対になる塩基を取り込み、RNAを伸長合成していきます(図1)。活性部位には、RNA合成反応に必要なマグネシウムイオンのほかに、トリガーループ[5]やブリッジヘリックス[5]といった重要なタンパク質のパーツが存在します。
研究チームは、2010年に、細菌のRNAポリメラーゼと、その働きを阻害するタンパク質との複合体の結晶構造解析を行い、新たなRNAポリメラーゼの立体構造を発見しました注2)。その新たな立体構造はRNAポリメラーゼのはさみが根元のところでよじれたようになっており、活性部位やDNAを結合する溝の再編成が行われていました。研究チームは、この特徴的な立体構造を「ラチェット型」と名付け、既知の「タイト型」と区別することにしました(図2)。
RNAポリメラーゼがDNA配列をRNAに転写する過程は必ずしもスムーズに進むわけではありません。RNAポリメラーゼは、しばしばDNA上で一時停止や後戻りを繰り返しながら転写を進めます(図3)。コピーに失敗して間違った塩基(ミスマッチ塩基)を取り込んでしまった時などは、ミスマッチ塩基を含むRNAの一部を切断・除去する機能を持っており、こうした「校正」作業をしつつ転写を遂行します(図3)。
しかし、RNAポリメラーゼが、どのようにして状況に応じて多様な機能を発揮できるのか、その分子メカニズムはよく分かっていませんでした。研究チームは、「ラチェット型」の立体構造が、転写の一時停止や後戻り、校正などを含む転写機能の切り替えに深く関与しているのではないかと考え、RNAポリメラーゼの立体構造と機能との相関の解明に取り組みました。
- 注1) Vassylyev, DG.et al. "Crystal structure of a bacterial RNA polymerase holoenzyme at 2.6 Å resolution",Nature 417, 712-719 (2002). doi:10.1038/nature752
- 注2) Tagami, S. et al. “Crystal structure of bacterial RNA polymerase bound with a transcription inhibitor protein”, Nature468,978-982 (2010). doi: 10.1038/nature09573.
研究手法と成果
研究チームは、CPX法[6]を用いた生化学的解析およびX線結晶構造解析の手法を用い、転写中にRNAポリメラーゼがどのような立体構造をとっているのかを詳しく調べました。
まず初めに、細菌(高度好熱菌)のRNAポリメラーゼを用いて、2カ所にシステイン残基[7]を導入した「CPX変異体」を作製しました。この2つの残基は「タイト型」のときには離れていますが、「ラチェット型」になると近づくような位置に配置しています。そのため「ラチェット型」の時にはその2つの残基が高効率で結合し、ジスルフィド結合(S-S結合)[8]が形成されます(図4)。
次に、このS-S結合の形成効率を指標として、RNAポリメラーゼの立体構造を調べました。ミスマッチ塩基を取り込んでDNA上を後戻りした状態にあるRNAポリメラーゼの立体構造を調べたところ、“1塩基分”後戻りした状態では「タイト型」を、“大幅に”後戻りした状態では「ラチェット型」をとっていることが分かりました(図5)。さらに、“1塩基分”後戻りした状態でRNAの切断(転写の校正)を促進する転写因子Gre[2]は、RNAポリメラーゼを「タイト型」から「ラチェット型」に切り替えて高い切断活性を引き出すことが分かりました。また、RNAポリメラーゼによって生み出されたRNAがヘアピン構造をとれるような特殊な場合では、RNAポリメラーゼは安定な転写休止状態に入ったり、RNAを解離して転写を終わらせたりします。RNAポリメラーゼは、ヘアピン構造をもったRNAを含むような転写複合体でも「ラチェット型」をとることが明らかになりました(図5)。
またCPX法による解析と並行して、“1塩基分”後戻りした状態およびGre因子を結合した状態のRNAポリメラーゼの結晶構造解析を行いました。この解析からも、RNAポリメラーゼは、前者では「タイト型」を、後者では「ラチェット型」の立体構造をとっていることが確認されました(図6上段)。
特に“1塩基分”後戻りした状態では、RNAポリメラーゼのトリガーループが、RNAの後戻り(3'末端突出)に伴って「折れ曲がった」状態になっていました(図6:下段中)。上記のCPX法を用いた実験で、“1塩基分”後戻りした状態のRNAポリメラーゼは、RNAを合成中の状態と比較して、より容易に「ラチェット型」に移行できる性質をもっていることが示されましたが、トリガーループが折れ曲がっていることがその大きな要因と思われます。
これらの結果から、RNAポリメラーゼの「ラチェット型」の立体構造は、複数の重要な転写機能を支える必須の構造状態であることが明らかになりました。このことは、転写機能が「タイト型」と「ラチェット型」の2つの立体構造の切り替えによって制御されているという普遍的な仕組みの存在を示しています。また、RNAポリメラーゼによって生み出されつつあるRNAが2つの立体構造の切り替えに深く関与しており、転写の進行と休止・終結、および酵素活性の切り替えに重要な役割を果たしていることも明らかになりました。
今後の期待
巨大複合体であるRNAポリメラーゼが、転写の状況や種々のシグナルに応じてその活性や機能を切り替えることは知られていましたが、その具体的なメカニズムはほとんど分かっていませんでした。本研究は、RNAポリメラーゼの2つの構造状態にそれぞれ異なる機能が割り当てられていることを示すもので、転写制御の基本原理の解明へ向けて、大きな一歩となることが期待できます。また、RNAポリメラーゼの働きを自在に制御する方法の開発や、細菌のRNAポリメラーゼの働きを止める抗菌剤の開発など、応用への重要な基礎となることが期待できます。
原論文情報
- Shun-ichi Sekine, Yuko Murayama, Vladimir Svetlov, Evgeny Nudler and Shigeyuki Yokoyama, "The ratcheted and ratchetable structural states of RNA polymerase underlie multiple transcriptional functions", Molecular Cell, doi: 10.1016/j.molcel.2014.12.014
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 構造生物学グループ 超分子構造解析研究チーム
チームリーダー 関根 俊一(せきね しゅんいち)
特別研究員 村山 祐子(むらやま ゆうこ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.RNAポリメラーゼ
DNAの塩基配列を読み取って相補的なRNAを合成する酵素で、遺伝子の発現(セントラルドグマ)の第一段階をつかさどる。複数のタンパク質(サブユニット)が集合してできた巨大な複合体で、細菌からヒトまで類似した「カニのはさみ」のような形をしている。 - 2.校正、転写因子Gre
RNAポリメラーゼは、DNA上のシグナルなど、いくつかの条件に応じて転写を一時停止したり、DNA上を後戻りしたりする。転写ミスを起こしてミスマッチ塩基を取り込んだときにも、DNA上を後戻りして停止するが、この状態では、RNAの末端(3’末端)は鋳型となるDNAからはがれた状態にある。このとき、RNAポリメラーゼはRNA伸長とは別の加水分解活性を発揮し、ミスマッチ塩基を含むRNAの末端を切断・除去する。結果として転写のエラーが修正されるので、この過程は校正と呼ばれる。Greなどの転写因子は、RNAポリメラーゼに結合してこの切断活性を飛躍的に増強するタンパク質である。 - 3.タイト型
従来から知られていたRNAポリメラーゼの立体構造で、DNAを鋳型にしてRNAを合成するのに必要。 - 4.ラチェット型
研究チームが最近新たに発見した、RNAポリメラーゼがとることのできるもう1つの立体構造。RNAポリメラーゼのはさみが根元のところでよじれたようになっており、活性部位の再編成が行われた状態。 - 5.トリガーループ、ブリッジヘリックス
RNAポリメラーゼの中心部に存在するフレキシブルな構造で、基質結合や酵素活性に直接関与する重要な部位。 - 6.CPX法
CPXは Cys - pair crosslinkingの略。本研究では、RNAポリメラーゼの2カ所にシステイン(Cys)残基を導入した変異体を設計した。2つのシステイン残基は、RNAポリメラーゼが「タイト型」のときは互いに離れているが、「ラチェット型」になると近づくような位置に配置してある。そのため、RNAポリメラーゼが「ラチェット型」のときのみ2つのシステイン間にジスルフィド(S-S)結合が高効率で形成される。ジスルフィド結合の形成効率から、溶液中のRNAポリメラーゼが「タイト型」か「ラチェット型」かを判定できる。また、ジスルフィド結合によってRNAポリメラーゼを「ラチェット型」に縛りつけ、その活性を測定するような使い方もできる。 - 7.システイン残基
タンパク質を構成する20種類のアミノ酸の1つで硫黄を含むチオール(SH)基を持つ。記号ではCysまたはCと表記する。求核性が高いため、酵素反応や修飾など生体内での多くの反応に関与している。また、システイン同士でジスルフィド(S-S)結合を形成したり、金属を配位したりすることにより、タンパク質の構造の安定化にも寄与している。 - 8.ジスルフィド結合(S-S結合)
酸化によって2組のチオール(SH)基の間に形成される共有結合のこと。ジスルフィド架橋(またはS-S架橋)とも呼ばれる。身近な例としては、頭髪のパーマネントウエーブがあり、これは薬剤を用いて頭髪のタンパク質(ケラチン)間にS-S結合をかけ、髪型を固定するものである。
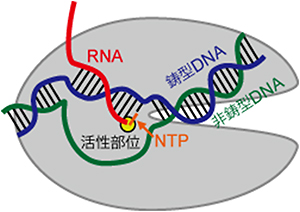
図1 RNAポリメラーゼによる転写
RNAを合成中のRNAポリメラーゼ複合体(転写伸長複合体)の構造を模式的に示す。NTPはRNA合成の材料で、DNAの塩基と対になる塩基が順に取り込まれていく。
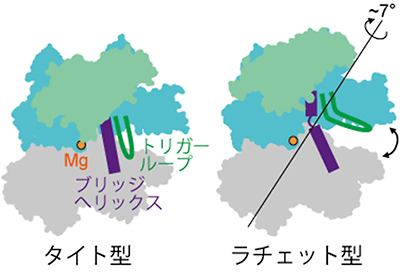
図2 「タイト型」と「ラチェット型」の立体構造
RNAポリメラーゼの構造は、いくつかの塊(モジュール)が組み合わさってできている。ラチェット型では、下部のモジュール(灰色)に対して上部のモジュール(水色)が回転してずれた位置関係にあり、結果として2つのモジュール間に形成される活性部位の再編成が行われている。
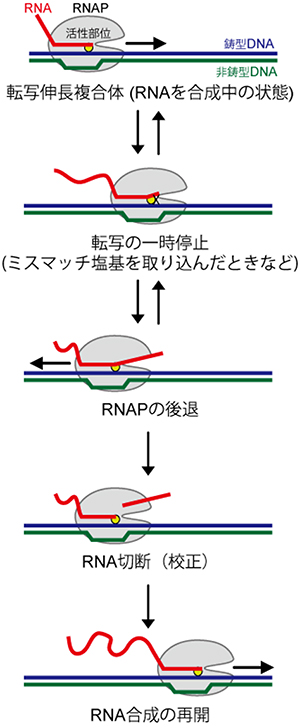
図3 転写の一時停止とRNAポリメラーゼの後退、RNAの切断
RNAポリメラーゼ(RNAP)は鋳型DNA上を移動しながらRNAを合成するが、その過程は必ずしもスムーズではなく、DNA上での一時停止や後戻り(後退)がしばしば起っている。
鋳型に適合しないミスマッチ塩基の取り込みによって後退が引き起こされた場合、RNAポリメラーゼはミスマッチ塩基を含むRNAの一部を切断・除去してからRNA合成を再開する校正機能を持っている。
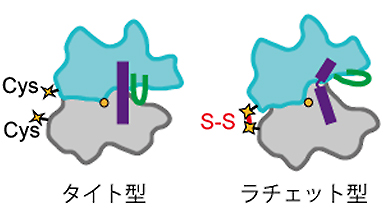
図4 CPX法の原理
CPX変異体において導入された2か所のシステイン(Cys)残基は、RNAポリメラーゼの立体構造が「タイト型」のときは互いに離れているが、「ラチェット型」のときは距離が近づく。そのため、酸化条件ではラチェット型では高効率でS-S結合が形成される。
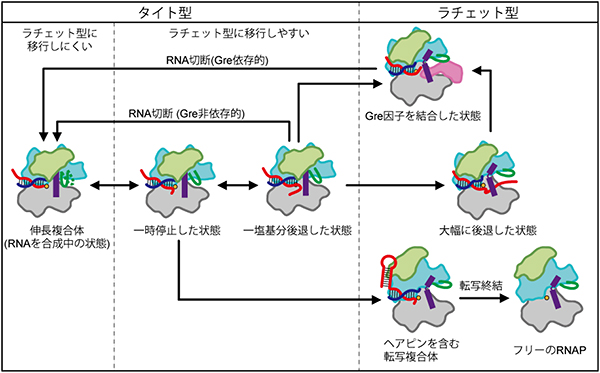
図5 RNAポリメラーゼの立体構造と転写機能の関係
RNAポリメラーゼ(RNAP)の機能の切り替えは、タイト型とラチェット型の立体構造の切り替えで説明できる。
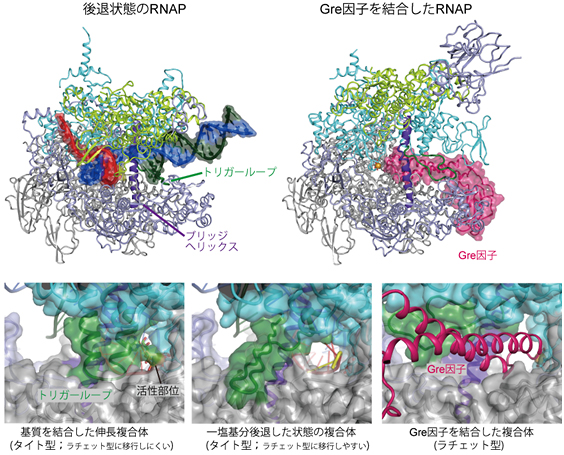
図6 後退状態およびGre因子結合状態のRNAポリメラーゼの構造とRNA転写の各種状態における活性部位付近の構造の比較
- 上段左:“1塩基分”後戻り(後退)した状態のRNAポリメラーゼ(RNAP)の構造。
- 上段右:Gre因子結合状態のRNAポリメラーゼの構造。
- 下段はRNA転写の各種状態におけるRNAポリメラーゼの活性部位付近の構造を示す。
- 下段左:基質NTP(DNAの塩基と対になる塩基)を取り込み結合した伸長複合体。活性部位はトリガーループによってふさがれている。
- 下段中:“1塩基分”後戻り(後退)した状態。トリガーループが折れ曲がっており、Gre因子の結合チャネルがやや開いている。
- 下段右:Gre因子を結合した状態。Gre因子は下段中の状態にアクセスし、RNAポリメラーゼを「ラチェット型」に切り替えると考えられる。
