要旨
理化学研究所(理研)生命システム研究センター細胞極性統御研究チームの岡田康志チームリーダーは、オリンパス株式会社と共同で、世界最高のシャッター速度で、生きた細胞内の微細構造の観察ができる超解像蛍光顕微鏡[1]を開発しました。
超解像蛍光顕微鏡は、生命科学の研究を大きく進歩させる画期的な発明として2014年のノーベル化学賞を受賞しました。しかし、これまでの超解像蛍光顕微鏡は、1枚の画像を作成するために数秒~数分以上の撮影時間が必要で、生きた細胞の中で動くものを観察する「ライブセル・イメージング」に用いるには時間分解能不足という問題がありました。
共同研究グループは、超解像蛍光顕微鏡のシャッター速度を従来の100倍高速化(1/100秒の時間分解能)することを目指しました。超解像蛍光顕微鏡の原理を一から再検討した結果、縞(しま)模様を描いた円盤を高速回転させて、これを通して撮影するという極めて単純な方法で、より高速に撮影できる超解像蛍光顕微鏡が実現できることを理論的に証明しました。スピニングディスク顕微鏡[2]として生命科学の研究に広く使われている共焦点顕微鏡[3]と類似した原理で、超解像蛍光顕微鏡に適用できます。既存のスピニングディスク顕微鏡の円盤部分を新開発したものと交換し、さらに、カメラや照明用レーザーなどを改良した結果、従来の光学顕微鏡の分解能限界の2倍に相当する約100nm(ナノメートル:1ナノメートルは100万分の1mm)の空間分解能を得ました。また、1秒間に100コマ、1/100秒のシャッター速度で細胞内の微細構造が動く様子の撮影に成功しました。
エイズウイルスやインフルエンザウイルスなど多くのウイルスの大きさは100nm程度で、従来の光学顕微鏡では観察できませんでした。開発した顕微鏡を用いれば、ウイルスの感染や増殖の様子を直接見ることが可能となり、疾患の理解や治療法の開発につながると期待できます。
本研究は、文部科学省科学研究費補助金新学術領域研究「蛍光生体イメージング」などの助成により行われ、成果は米国細胞生物学会の学会誌『Molecular Biology of the Cell』(5月1日号)に掲載されるのに先立ち、速報版がオンライン(2月25日付け)で公開されました。
背景
19世紀にドイツのエルンスト・アッベらによって、光学顕微鏡の空間分解能は観察に用いる光の波長の半分程度が限界であることが示されました。これを「回折限界」と呼びます。このため、可視光を用いて観察する限りは、光学顕微鏡では200nm(ナノメートル:1ナノメートルは100万分の1mm)より小さい構造の観察はできません。1930年代には電子顕微鏡が発明され、細胞内に微細な構造物が存在し、重要な役割を果たしていることが明らかになりました。しかし、電子顕微鏡では、細胞を薄くスライスして真空中にさらす必要があり、生きたまま観察することはできません。
一方、緑色蛍光タンパク質(GFP)によって、蛍光顕微鏡を用いて細胞を生きたまま観察するライブセル・イメージング法が広く普及しましたが、回折限界があるために微細構造の観察は不可能でした。
2000年代に入り、回折限界を超えた空間分解能を目指す超解像蛍光顕微鏡の開発が活発となり、回折限界を超えて100nmあるいはそれ以下の空間分解能が達成され、マイクロスコープからナノスコープ[4]へと進化しました。しかし、従来の超解像蛍光顕微鏡では、空間分解能の向上が最優先され、時間分解能が犠牲になっていました。1枚の画像を取得するのに数秒~数分以上の撮影時間を必要とし、生きた細胞の観察は困難でした。また、撮影中に対象物が動くとにじんだ画像となり、空間分解能を活かせませんでした。
超解像蛍光顕微鏡を生命科学研究に活用していくためには、生きた細胞を生きたまま観察する超解像ライブセル・イメージング法の実現が必須です。そこで、共同研究グループは、超解像蛍光顕微鏡の時間分解能を従来の100倍向上、つまりシャッター速度を1/100秒にすることで、超解像ライブセル・イメージングの実現を目指しました。
研究手法と成果
2014年にノーベル化学賞を受賞した誘導放出制御法(STED)[5]は、超解像蛍光顕微鏡法の1つです。1点ずつ撮影していく方法なので、縦横各1,000ピクセルの視野を撮影するためには合計で100万点の撮影が必要です。1点を100万分の1秒で撮影したとしても視野全体の画像を得るには1秒かかってしまいます。
もう1つの超解像蛍光顕微鏡法である蛍光分子局在化法[6]では、蛍光分子を1分子ずつ位置計測するため、数千枚~数万枚の原画像の取得が必要であり、撮影に数分程度かかります。
共同研究グループは、第3の超解像蛍光顕微鏡法である構造化照明法[7]に注目しました。構造化照明法では、試料に縞(しま)模様の照明光を照射します。すると、試料面の蛍光分子のうち照明光を照射している部分だけが光り、照射していない部分は光りません。このため、近接した蛍光分子も異なる点だと区別できるようになり、空間分解能が向上します(図1)。
しかし実際の撮影では、全ての点にこの効果が得られるように、縞模様の位置や向きを変えながら9~15枚の画像を撮影し、コンピュータ上で計算処理を加えるため、どうしても1秒程度の撮影時間が必要でした。
共同研究グループは、時間分解能を100倍向上させるため構造化照明法の原理を再検討しました。検討過程で、照明光の縞模様と同じ縞模様のパターンを通して試料を撮影すれば、コンピュータ上での計算処理が不要になることに気付きました。これを応用すれば、1回の撮影だけで画像を再構成でき、時間分解能の向上を達成できると考えました。
この考察から、共焦点顕微鏡の一種であるスピニングディスク顕微鏡と構造化照明法の理論的関係が得られました。スピニングディスク顕微鏡では、縞模様を刻んだ円盤を通して照明光を照射し、同じ円盤を通して撮影するため、再び縞模様を通過した照明光のみがカメラに入射することで共焦点顕微鏡としての効果が得られることが知られています。そして、この縞模様の間隔を工夫すれば、超解像蛍光顕微鏡に適用できることが分かりました。(図2)。共同研究グループは、この顕微鏡法を「スピニングディスク超解像顕微鏡法(SDSRM:Spinning Disk Super-Resolution Microscopy)」と名付けました。
この原理に基づき、まず既存のスピニングディスク顕微鏡の装置の円盤を理論にそって最適に設計したものと交換し、蛍光ビーズを用いた原理の確認実験を行いました。その結果、従来の蛍光顕微鏡では分離できなかった近接した蛍光ビーズが、1個1個きれいに分離できることが示され、理論通りに約100nmの空間分解能を達成できていることが確認できました(図3)。これは、従来の光学顕微鏡の分解能限界の2倍に相当します。
さらに、カメラと照明光源を高速撮影に適したものに交換することで、最高1/100秒のシャッター速度(時間分解能)で、生きた細胞内の微細構造を100nmの空間分解能で観察することに成功しました。近年、ミトコンドリア外膜の動態がミトコンドリア病と総称されるさまざまな疾患と関連している可能性が示唆され注目を集めています。ミトコンドリアは外膜で包まれています。従来の蛍光顕微鏡では空間分解能不足から、外膜の構造を観察できませんでしたが、開発したスピニングディスク超解像顕微鏡法で観察したところ、外膜の構造を鮮明に撮影できました。さらに、外膜の一部が伸び出したりちぎれたりと活発に運動する様子も撮影できました(図4)。これは、生きた細胞を高い時間・空間分解能で観察することにより得られた世界初の画像です。疾患状態と健常状態を比較することで、ミトコンドリア病の病態の理解や治療法の開発につながると期待できます。
スピニングディスク超解像顕微鏡法の時間分解能を活かす例として、リサイクリング・エンドソームを観察しました。リサイクリング・エンドソームは、細胞内外のさまざまな場所から回収してきたタンパク質をリサイクルしたり廃棄したりという選別を行う場所ですが、単なるゴミ捨て場ではなく、細胞の増殖や分化の信号の制御に重要な役割を果たしていることが知られています。ただ、100nm程度の小さな構造で、しかも1秒間に10μm程度の高速度で動いているため、その動態はよく分かっていませんでした。今回、スピニングディスク超解像顕微鏡法を用いた1/100秒の時間分解能、100nmの空間分解能での観察により、リサイクリング・エンドソームがわずか6/100秒の間に荷物を受け取り、選別し、送り出すというステップをダイナミックに行う様子を観察できました(図5)。
今後の期待
スピニングディスク超解像顕微鏡法の開発により、生きた細胞の中の微細な構造が動く様子を観察することが可能となりました。本顕微鏡法は、すでに生命科学研究の分野で国内外広く用いられているスピニングディスク顕微鏡の改良であるため、他の超解像蛍光顕微鏡に比べて導入は容易です。また、本顕微鏡法の原理を発展させることで、他の共焦点顕微鏡法への適用も原理的に可能と考えられます。本研究は、オリンパス株式会社との共同研究開発です。同社を通じて速やかに製品化され、世界中に普及することを期待しています。
原論文情報
- Shinichi Hayashi and Yasushi Okada, "Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics", Molecular Biology of the Cell, doi: 10.1091/mbc.E14-08-1287 (速報版)
発表者
理化学研究所
生命システム研究センター 細胞動態計測コア 細胞極性統御研究チーム
チームリーダー 岡田 康志(おかだ やすし)
お問い合わせ先
理化学研究所 生命システム研究センター
広報担当 川野 武弘(かわの たけひろ)
Tel: 06-6155-0113 / Fax: 06-6155-0112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.超解像蛍光顕微鏡
光は波としての性質を示し回折という現象を起こすため、光学顕微鏡で観察できる空間分解能は回折によって制限され(回折限界)、観察に用いる光の波長の半分程度であることが理論的に示されている。近年、蛍光分子の特徴を巧みに利用することで、回折限界を超えた高い空間分解能を達成する手法が開発され、これを超解像蛍光顕微鏡法と呼ぶ。 - 2.スピニングディスク顕微鏡
共焦点顕微鏡の一種。通常の共焦点顕微鏡は、試料を1点ずつ走査することで共焦点画像を得るが、スピニングディスク顕微鏡は縞模様あるいは点状の開口パターンを持つ円盤(ディスク)を高速回転(スピン)させることで高速に共焦点画像を得る。生きた細胞の観察に広く用いられている。 - 3.共焦点顕微鏡
試料上の1点から出た光が顕微鏡の光学系を通った後に、再び1点に集まる点に小さな針穴(ピンホール)を置くと、その1点から出た光以外を排除できる。この効果を利用して分解能を改善する顕微鏡を共焦点顕微鏡と呼ぶ。試料を1点ずつ走査するレーザー走査式共焦点顕微鏡や、多数のピンホールがあいた円盤を高速回転しながら撮影するスピニングディスク顕微鏡などの種類がある。DVDなどの読み取りでも共焦点顕微鏡と同様の光学系が利用されている。 - 4.ナノスコープ
顕微鏡を意味する英語「マイクロスコープ」はガリレオの友人が「微小な」という意味のギリシア語「ミクロ」と「見る機器」という意味のギリシア語「スコープ」を組み合わせて作ったと言われている。これに対し、超解像顕微鏡は回折限界の0.2μm(1μmは1/1000mm)を超えてナノメートルの世界(1nmは100万分の1mm)を見る機器という意味でナノスコープと名付けられた。 - 5.誘導放出制御法(STED)
ドイツのシュテファン・ヘル博士が開発した超解像蛍光顕微鏡法の1つで2014年のノーベル化学賞を受賞した。誘導放出という物理化学現象を巧みに利用して視野内の蛍光分子のオン・オフを制御することで回折限界を超えた高い空間分解能を達成する手法。 - 6.蛍光分子局在化法
蛍光分子1分子の像であっても、顕微鏡で観察すると回折の影響で波長程度の大きさ(1/2000mm程度)ににじんでしまう。通常は、視野内の蛍光分子がすべて同時に光ってしまうために、1個1個の蛍光分子の像がにじんだまま重なって全体としてボケた像になる。これが回折限界である。もし、視野内の蛍光分子が1個ずつバラバラに光れば、その位置はにじんだ円盤の中心として精密に計測することができる。これを繰り返して全ての蛍光分子について、その位置を1分子ずつ精密に計測すれば、回折によるにじみの影響を受けない画像を再構成できる。これが蛍光分子局在化法と呼ばれる超解像蛍光顕微鏡法の原理。これを考案した米国のエリック・ベツィグ博士は、誘導放出制御法を開発したドイツのシュテファン・ヘル博士と共同で2014年のノーベル化学賞を受賞した。 - 7.構造化照明法
超解像蛍光顕微鏡法の1つ。試料を縞模様の照明光で照射することで分解能を回折限界の2倍まで伸ばすことができる。原理は図1を参照。
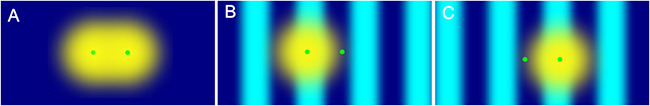
図1 構造化照明法の原理
- A)回折限界内の近接する2つの蛍光分子の像は、回折による広がりで重なってしまい2点と識別することができない。
- B, C)縞模様の照明光を照射し、照射した部分(水色)の蛍光分子だけが光る状況にすれば、縞模様を動かすことで近接する2分子でも2点と区別することが可能となり、縞模様に垂直な方向の空間分解能が向上する。
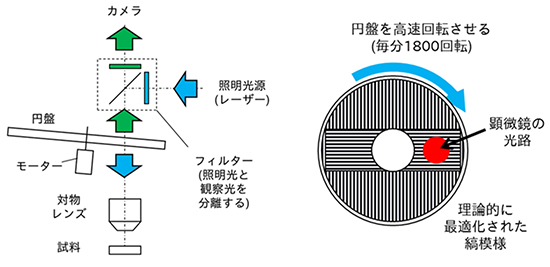
図2 スピニングディスク超解像顕微鏡の模式図
- 左: 光路の模式図。照明光(青)は円盤を通じて試料に照射され、試料からの光(緑)は円盤の同じ場所を通ってカメラへ入射する。これにより、同じ縞模様のパターンで照明と観察を行うことができ、カメラには回折限界を超えた超分解能の画像が記録される。
- 右: 円盤の縞模様の模式図。従来のスピニングディスク顕微鏡より細かい縞模様を刻んだ円盤を利用することで、従来の光学顕微鏡より高い空間分解能の成分がカメラに結像する。
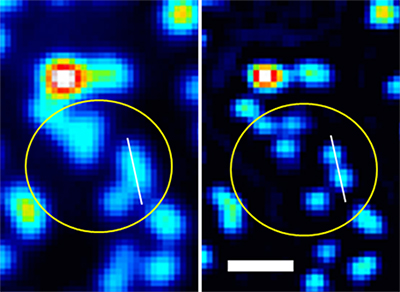
図3 蛍光ビーズを用いた原理の確認実験
- 左: 従来の蛍光顕微鏡像。
- 右: スピニングディスク超解像顕微鏡による画像。黄色の丸内の6個の蛍光ビーズが、きれいに分離できていることが分かる。スケールバーは500nm。
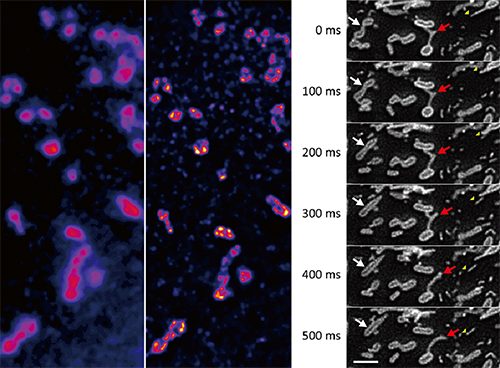
図4 ミトコンドリア外膜の動態
- 左:従来の蛍光顕微鏡像。回折限界により構造の細部がボケてしまっている。
- 中央:スピニングディスク超解像顕微鏡による画像。外膜の構造がクリアに撮影されている。
- 右:スピニングディスク超解像顕微鏡で100ミリ秒ごとに撮影した画像を並べたもの。ミトコンドリアが融合する様子(白矢印)やミトコンドリア外膜が伸び出して激しく動く様子(赤色矢印)などが観察される。
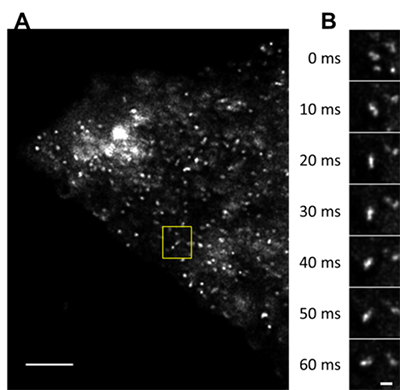
図5 リサイクリング・エンドソームの動態
- A: 全体像。スケールバーは5μm。
- B: Aの黄色い四角部分を拡大したもの。1/100秒ごとに撮影した画像。小胞が融合して、時計回りに回転しながら小胞を放出する様子が観察できた。
