要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター非天然型アミノ酸技術研究チームの坂本健作チームリーダー、大竹和正特別研究員と理研横山構造生物学研究室の横山茂之上席研究員らの共同研究グループ※は、改変した遺伝暗号[1]を利用して新規アミノ酸を含んだ酵素(タンパク質)を作製し、酵素の構造安定性を高める技術の開発に成功しました。
タンパク質はアミノ酸がつながってできた分子で、熱を加えるなどの操作によって容易に変性し、機能を失います。このとき、タンパク質の正しい形(立体構造)は壊れています。タンパク質は研究用や医薬品・産業用酵素など幅広い用途に利用されているため、構造安定性を高め、丈夫なタンパク質を作製することが極めて重要です。タンパク質にはさまざまな種類があり、その構造も機能も多様です。これまでは、タンパク質の種類に応じて、それぞれ異なる手法で安定化が試みられてきましたが、効率よく安定化させるため、タンパク質全般に応用できる簡便な技術が求められています。共同研究グループは、新規アミノ酸を導入する最新のタンパク質生産法を利用したタンパク質の構造安定化技術の開発に取り組みました。
共同研究グループはこれまでに、遺伝暗号を改変した大腸菌を利用すればハロゲン原子を結合したアミノ酸をタンパク質に取り込ませることができるとことを明らかにしています。アミノ酸の一種であるチロシン[2]を数多く含むタンパク質には、抗体や酵素などの重要なタンパク質があり、本研究では一例として、グルタチオンS-転移酵素(GST)[3]を取り上げました。この酵素のチロシン7個をハロゲン化チロシン[2]に置き換えたところ、酵素の構造安定性が大幅に向上しました。その理由を明らかにするため、この酵素の立体構造を調べた結果、酵素内部の隙間をハロゲン原子が埋めるともに、ハロゲン原子を介してアミノ酸同士の新しい相互作用が生じて構造が安定化していることが分かりました。この安定化技術を他の酵素にも応用したところ有効に機能することが分かり、開発した技術が簡便で汎用性が高いことを確認できました。
改変した遺伝暗号と新規アミノ酸を利用することによって、タンパク質の構造安定化が図られ、蛋白工学の可能性が広がると期待できます。
本研究は、英国のオンライン科学雑誌『Scientific Reports』(5月17日付け:日本時間5月18日)に掲載されました。
※共同研究グループ
理化学研究所
ライフサイエンス技術基盤研究センター 非天然型アミノ酸技術研究チーム
チームリーダー 坂本 健作(さかもと けんさく)
特別研究員 大竹 和正(おおたけ かずまさ)
横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
日本大学 工学部 生命応用化学科
生命分子工学研究室
教授 春木 満(はるき みつる)
バイオインフォマティクス研究室
助教 山岸 賢司(やまぎし けんじ)
東北大学
大学院 医工学研究科
准教授 村山 和隆(むらやま かずたか)
背景
1970年代における組換えDNA技術の登場は、タンパク質の大量生産方法に革新をもたらすとともに、タンパク質の性質や機能を改善するための新しい研究分野「蛋白工学」を誕生させました。タンパク質は20種類のアミノ酸がつながってできた分子で、生物によって合成されます。タンパク質中のアミノ酸の並び方はDNAの中のアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の化合物(塩基)の並び方と対応しています(図1)。3つの塩基がひとまとまりになって1つのアミノ酸に対応しており、この3塩基の並びを「コドン」と呼んでいます。
人工的に作製したDNAを大腸菌に取り込ませて、対応するタンパク質を大腸菌に合成させることができるので、DNAの中の塩基の並び方を変える(改変する)ことで、さまざまなタンパク質を作り出すことができます。
しかし、実際にタンパク質を一から人工的に設計することは難しく、通常は天然のDNAの塩基の並びを少しだけ改変することで、少しだけアミノ酸配列が変化したタンパク質が作られています。このようなタンパク質を変異体と呼びますが、変異体の中には、元のタンパク質よりも性質や機能が向上するものがあります。有用な変異体を作り出すことは、蛋白工学の目的の1つです。
タンパク質を構成している20種類のアミノ酸は全ての生物で共通です。生物には、DNAの情報(塩基配列)をタンパク質のアミノ酸に対応させるルール(遺伝暗号)が備わっており、大腸菌からヒトまで同じルールに従ってタンパク質を合成しています。2010年に坂本健作チームリーダーらは、遺伝暗号を改変した大腸菌を利用すればハロゲン原子を結合したアミノ酸をタンパク質に取り込ませることができることを明らかにしています注)。この大腸菌を用いると、通常の20種類のアミノ酸から作られるタンパク質変異体とは異なった、21種類のアミノ酸から作られる新しいタイプの変異体を合成することが可能です。共同研究グループは、このような最新の技術を蛋白工学に実際に医薬品や産業用酵素などに生かすことを考え、タンパク質の構造安定化への応用を試みました。
注):Codon reassignment in the Escherichia coli genetic code、Takahito Mukai, Akiko Hayashi, Fumie Iraha, Aya Sato, Kazumasa Ohtake, Shigeyuki Yokoyama, Kensaku Sakamoto、Nucleic Acids Research. 38, 8188-8195 (2010)
研究手法と成果
アミノ酸の一種であるチロシンを数多く含むタンパク質には、抗体や酵素などの重要なタンパク質があります。本研究ではその一例として、グルタチオンS-転移酵素(GST)を取り上げ、構造安定化技術の開発に取り組みました。新しく導入する人工的なアミノ酸として、ハロゲン原子を結合したチロシン(ハロゲン化チロシン)を選びました(図2)。ハロゲン化チロシンは、通常の20種類のアミノ酸であるチロシンよりも少しサイズの大きいアミノ酸です。タンパク質の構造安定化のためには、元のアミノ酸と比べて形や性質が大きく異なった新規アミノ酸を用いるより、少しだけ大きさの異なった人工アミノ酸を酵素に導入するのが効果的だと予測しました。
天然のGSTは1分子の中に15個のチロシンを含んでいます。共同研究グループは、それぞれのチロシンをハロゲン化チロシンに置き換えた変異体を15種類作製し、構造の安定性を調べました。15種類のうち1種はGSTの酵素活性に関係しているチロシンのため、活性がありませんでした。4種は構造の安定性が天然のGSTに比べて低下しました。7種は安定性の向上の幅に差はあるものの、構造が安定化しました。そこで、この7種の全てのチロシンを同時にハロゲン化チロシンに置き換えた変異体を作製し構造の安定性を調べたところ、大幅に安定性が向上しました。
次に、安定性の向上をもたらしたメカニズムを明らかにするために、X線結晶構造解析法[4]を用いて、安定化した変異体の立体構造を調べました。GSTは2つの分子がまとまって1つの塊を作っています(図3)。
安定化変異体には、1分子あたり15個のうちの7個がチロシンの代わりにハロゲン化チロシンとなっていることが確認できました。また、ハロゲン化チロシンの近くの隙間は、ハロゲン原子が埋めていることが分かりました。このことで、タンパク質の内部がより密な状態になると同時に、ハロゲン原子を介してアミノ酸同士の新しい結合が生じます(図4)。この2つの要因によってGST変異体の構造が安定化することが明らかになりました。
このようなタンパク質の安定化メカニズムはシンプルであることから、タンパク質全般に適用可能と考えました。そこで、別のタンパク質であるアゾリダクターゼ(AzoR)を用いて有用性を検証しました。AzoRは染料を分解する働きをもつ酵素です。染料のほとんどは、化学の発展によって18世紀以降に工業的に大量合成されるようになったものです。広く使用され、かつ非常に安定で壊れにくいため、環境汚染の原因になることが懸念されています。AzoRはこれらの染料を分解できるため、丈夫で活性の高いAzoR変異体を作製し大量生産できれば、環境の保全に役立つ可能性があります。AzoRは200個のアミノ酸がつながってできていますが、その中に7個のチロシンを含んでいます。このチロシンの含有量(3.5%)はタンパク質の平均チロシン含有量と同じであることから、新しい安定化方法の検証に適当だと考えました。
最初に、7個のチロシンを1個ずつハロゲン化チロシンに置き換えた7種類のAzoR変異体を作製し、どのハロゲン化チロシンが構造の安定化に効果的であるかを調べました。その結果、3個が構造の安定化に効果的であることが分かりました。次に、この3個のチロシンを同時にハロゲン化チロシンに置き換えた変異体を作製して安定性を調べたところ、通常のAzoRに比べ10倍以上、構造が安定化しました。この安定化のプロセスは、3個のチロシンをハロゲン化チロシンに置き換えるだけというシンプルなものであり、開発した構造安定化技術の簡便さが示されました。
今後の期待
本研究では、通常のアミノ酸よりも少しだけ大きなアミノ酸を組み込むことで、タンパク質分子内部の隙間が埋められて、構造が安定化することが示されました。この安定化技術は、酵素など産業的に有用なタンパク質の性質の改善に広く役立つと期待できます。こうした蛋白工学の新しいアプローチは、遺伝暗号を改変した生物をタンパク質生産に用いることで初めて可能となりました。本研究の成果は、新しいアミノ酸を使った次生代の蛋白工学への取り組みを促すと考えられます。
原論文情報
- Kazumasa Ohtake, Atsushi Yamaguchi, Takahito Mukai, Hiroki Kashimura, Nobutaka Hirano, Mitsuru Haruki, Sosuke Kohashi, Kenji Yamagishi, Kazutaka Murayama, Yuri Tomabechi, Takashi Itagaki, Ryogo Akasaka, Masahito Kawazoe, Chie Takemoto, Mikako Shirouzu, Shigeyuki Yokoyama, Kensaku Sakamoto, "Protein stabilization utilizing a redefined codon", Scientific Reports, doi: 10.1038/srep09762
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 生命分子制御研究グループ 非天然型アミノ酸技術研究チーム
チームリーダー 坂本 健作(さかもと けんさく)
特別研究員 大竹 和正(おおたけ かずまさ)
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦(やまぎし あつし)
Tel:078-304-7138 / Fax:078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.遺伝暗号
タンパク質はアミノ酸がつながった分子で、アミノ酸の並び方は、そのタンパク質の遺伝子(DNA)の中の塩基配列に対応している。3つの塩基がひとまとまりになって1つのアミノ酸に対応しており、この3塩基の並びを「コドン」と呼ぶ。64通りのコドンが存在するが、そのうちの61種類がアミノ酸を意味しており、例えばチミンが3つ並んだTTTはフェニルアラニンを意味する。このようなコドンとアミノ酸等の対応関係を「遺伝暗号」と呼ぶ。 - 2.チロシン、ハロゲン化チロシン
チロシンはタンパク質を構成する20種類のアミノ酸の1つ。環状の構造(芳香環)という特徴的な構造を持っている。ハロゲン化チロシンは、チロシンのこの環状部分にハロゲン原子が結合した分子。ハロゲン原子は周期表において第17族に属する元素(F、Cl、Brなど)の総称で、タンパク質の構造安定化に有用なのは主に塩素(Cl)が結合したクロロ化チロシンと臭素(Br)が結合したブロモ化チロシンである。 - 3.グルタチオン S-転移酵素
細菌から哺乳動物までのさまざまな生物に存在する酵素。グルタチオン(短いペプチドの一種)を有害な化合物に結合させることで無毒化する働きをする。器官ごとに含有量は異なる。肝臓には特に多く存在している。 - 4.X線結晶構造解析法
タンパク質の結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、タンパク質の内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質のかたち(立体構造)や内部構造について知ることができる。
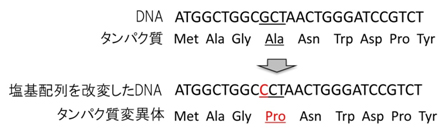
図1 DNAの塩基配列の情報に基づいたタンパク質の合成
人工的に塩基配列を変えると、その変化に対応して元のタンパク質とはアミノ酸配列の違うタンパク質変異体が合成される。図では下線Gを含むコドン「GCT」を「CCT」に変えたことでアミノ酸のアラニン(Ala)がプロリン(Pro)に変わった変異体タンパク質となる。
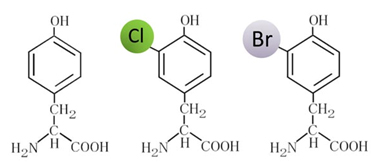
図2 ハロゲン化チロシンの化学構造
左から通常のチロシン、クロロ化チロシン、ブロモ化チロシン。クロロ化チロシンとブロモ化チロシンはハロゲン化チロシンの一種であり、タンパク質の構造安定化に重要である。
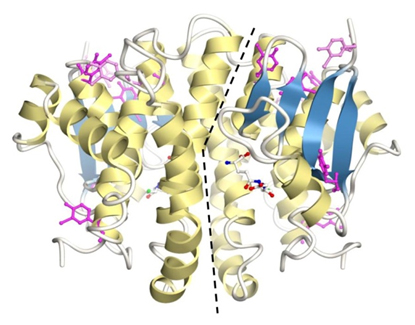
図3 構造が安定化したGST変異体の立体構造
ハロゲン化チロシンを紫で示した。点線は分子の境目を示している。1分子に7個のハロゲン化チロシンが組み込まれている。
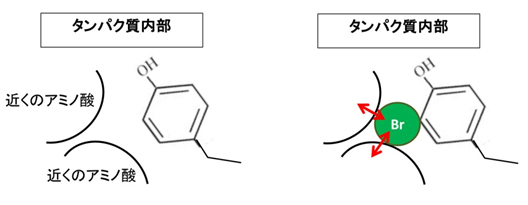
図4 グルタチオンS-転移酵素(GST)内部
- 左: 天然のグルタチオンS-転移酵素(GST)内部。
- 右: 構造が安定化した酵素GST変異体内部。ハロゲン化チロシンの近くの隙間をハロゲン原子(Br)が埋めている。また、ハロゲン原子を介してアミノ酸同士の新しい結合が生じる。この2つの要因により構造が安定化する。
