2015年9月15日
理化学研究所
革新的技術による脳機能ネットワークの全容解明プロジェクト
日本医療研究開発機構
アルツハイマー病の組織病変をズームイン
-老齢マウスやヒトの死後脳に適応可能な新しい透明化技術-
要旨
理化学研究所脳科学総合研究センター細胞機能探索技術開発チームの宮脇敦史チームリーダー、濱裕専門職研究員、並木香奈研究員らの共同研究グループ※は、生体組織を抗体や色素で染色し微細構造を保ちながら透明化する新しい技術を確立しました。この技術を使って、アルツハイマー病[1]モデルマウスの加齢脳やアルツハイマー病患者の死後脳におけるアミロイド斑[2]を、異なる空間解像度で定量的に観察することが可能となりました。
2011年、理研の細胞機能探索技術開発チームは、生物サンプルを透明にする尿素含有試薬ScaleA2を開発し、サンプルを傷つけることなく表面から数ミリの深部を高精細に観察できる技術Scaleを開発しました注1)。しかしScaleA2は、処理時間が長く組織が膨潤してしまうなどの問題点がありました。そこで、共同研究チームは、尿素とソルビトール[3]を主成分とする透明化試薬ScaleSを開発し、より速く透明化し、より本来の微細構造を保てるように改良しました。さらに、3次元組織を抗体や色素で染色する技術「AbScale」、「ChemScale」を開発し、ScaleSと併せることで、アルツハイマー病モデルマウスの加齢脳やアルツハイマー病患者の死後脳における組織病変をさまざまな空間解像度で定量的に観察することを可能にしました。その結果、アルツハイマー病の早期に生じるアミロイド斑の炎症性の特徴を明らかにしました。
これらの知見は、アルツハイマー病発症前の早期診断法の開発につながる可能性があります。また今回開発した透明化技術によって、多くの脳疾患の組織病変の詳細な解析が可能になると期待できます。
本研究成果は、文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構へ移管)の一環として行われ、国際科学雑誌『Nature Neuroscience』への掲載に先立ち、オンライン版(9月14日付け)に掲載される予定です。
注1)2011年8月30日プレスリリース「生体をゼリーのように透明化する水溶性試薬「Scale」を開発」
※共同研究グループ
理化学研究所
脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史(みやわき あつし)
専門職研究員 濱 裕(はま ひろし)
研究員 並木 香奈(なみき かな)
研究員 黒川 裕(くろかわ ひろし)
光量子工学研究領域
エクストリームフォトニクス研究グループ 生命光学技術研究チーム
テクニカルスタッフⅠ 星田 哲志(ほしだ てつし)
京都大学大学院医学研究科 高次脳形態学教室
助教 日置 寛之(ひおき ひろゆき)
背景
近年の蛍光タンパクの遺伝子導入技術により、サンプル表面からの深さに関わらず生体構造を蛍光標識[4]できるようになりました。蛍光標識した構造を高精細に観察する際、組織の切片の蛍光画像を何枚も連続的に取得し、それらを積み上げていく方法があります。このように画像を機械的に切り取る方法は、大変な労力を伴うだけでなく、3次元的に再構築すること自体が非常に難しいという問題を抱えています。そこで、理研の細胞機能探索技術開発チームは、2011年に、尿素をベースとして、生物サンプルを透明にする試薬ScaleA2を作製し、サンプルを傷つけることなく表面から数ミリの深部を高精細に観察できる技術Scaleを開発しました。
しかしながらScaleA2を使う透明化技術には、処理時間が長く組織が膨潤するといった問題点が指摘されてきました。共同研究グループは、尿素以外の成分を加えることでこうした問題点の解決を図りました。
また共同研究グループは、他の透明化技術との比較検討を重ねながら、透明化する能力と組織構造(蛍光シグナル)を保持する能力の間にあるトレードオフに注目し、この問題の実用的な解決に挑みました。さらに透明化技術と併せて、3次元組織を抗体や色素で蛍光標識する技術を開発し、ヒト組織への適用を試みました。
研究手法と成果
共同研究グループは、尿素にソルビトールを配合した試薬ScaleSを作製しました。尿素とソルビトールとの相乗効果で透明化能力の向上を図り、さらに、有機溶媒[5]あるいは高濃度の界面活性剤[6]を添加しないことで、蛍光シグナルの消失や組織構造の破壊を防ぐように工夫しました。
ScaleS技術をマウス成体の大脳半球に適用したところ、数日間で透明化がほぼ完了し顕著な組織膨潤は認められませんでした(図1)。次に、二枚刃かみそりを使って、透明脳半球からスライスを切り出しました(図1下)。そのスライスは直立するほど頑丈で、切り出し面は平坦かつ滑らかで、透明脳のトリミングが非常に簡単になりました。透明化したマウス脳の微細構造を電子顕微鏡観察によって確かめたところ、広範囲にわたって生体膜の連続性が保たれ、シナプス構造[7]を容易に同定できることが分かりました。
共同研究グループは以前から、Scale技術によってサンプルが生体高分子を取り込みやすくなることに注目していました。この現象を利用し、脳サンプルの内部構造を丸ごと抗体[8]および色素で染色する方法「AbScale」と「ChemScale」を開発しました。
次に共同研究グループは、ScaleSにAbScaleやChemScaleを組み合わせ、アルツハイマー病の脳組織の病変の観察を行いました。観察には、ヒトのアルツハイマー病患者の病理を忠実に再現するモデルマウス注2)を用いました。このモデルマウスの脳には、生後約40週齢を過ぎてから、アルツハイマー病の発症に関与するアミロイド斑が多く出現することが分かっています。ところで、加齢に伴って、マウスの脳組織は強固になり透明化が難しくなることが分かっています。実際、従来の透明化技術の検証実験では、ほとんどが約10週齢までの若年マウスの脳が使用されています。共同研究グループは、老年マウスの脳の透明化に挑みました。36、72週齢のモデルマウスの大脳半球を対象に、抗アミロイド抗体[2](緑色蛍光標識)を使ってAbScale法を行いアミロイド斑の局在を調べました。アミロイド斑は36週齢サンプルではほとんど検出されませんでしたが、72週齢サンプルにおいては皮質層のほぼ全体にわたって高密度に観察されました(図2)。さらにサンプルをアミロイド斑に特異的に結合する蛍光色素(PP-BTA-1)で染色したところ、72週齢の脳の大血管に沿って局所的に拡がる血管炎が描出されました(図2)。
次に、アミロイド斑が、脳内で免疫反応を担うミクログリア[9]とどのように相互作用しているのかを調べました。緑色蛍光標識と共に、ミクログリアを特異的に染色する抗体(赤色蛍光標識)を用いて2色AbScaleを行いました。3次元空間で物体間距離を計測するプログラムを作成し、ミクログリアの3次元における近さの程度から、各アミロイド斑の炎症性を評価しました(図3)。40~80週齢のマウス脳を使った実験データを比較検討したところ、加齢に伴ってアミロイド斑の総数は増大するものの、炎症性アミロイド斑の割合は減少することが分かりました。このように、今回の解析では、疾患早期に炎症が起きていることを示唆する実験データを再現性よく集めることができました。
透明化技術を用いることで、ほぼ全脳レベルでアミロイド斑の分布を調べたり、細胞レベルでアミロイド斑とミクログリアとの相互関係を調べることができました。しかし、疾患メカニズムを解明するためには、より空間分解能を高めてアミロイド斑に“ズームイン”する必要があります。そこで、AbScaleで染色されたアミロイド斑の中から任意の一つを選択し、脳サンプルを切りながら次第に小さなブロックにすることでズームインし、そのアミロイド斑を電子顕微鏡で観察することを試みました(図4)。こうした試みは、十分な透明化能力と組織構造保持能力の両方が揃って初めて可能となります。アミロイド斑の周囲の興奮性シナプスを観察したところ、大きなダメージはなく、神経組織が保存されていることが分かりました。
さらに共同研究グループは、こうした解析をヒトのアルツハイマー病患者の死後脳サンプルに適用しました。アミロイド斑のように3次元的に複雑な構造は、一方向のみから観察してもその全体像をつかめない場合があります。透明サンプルの強みは、機械的に切ることがないので、ある注目部位についていろいろな角度からいろいろな厚さで光学的スライスを作成できることです。通常の2次元画像や3次元表示画像では見えない構造を可視化できます。60歳以上の9患者の脳サンプルのアミロイド斑とミクログリアを緑色と赤色の蛍光標識抗体でそれぞれ染色した結果、境界不明瞭のびまん性[10]アミロイド斑を効率よく検出することができました(図5)。一般的に、びまん性アミロイド斑は非炎症性の構造体と考えられています。ところが、ミクログリアとの相互作用を指標に定量的解析を行ったところ、びまん性アミロイド斑のほうが一般のアミロイド斑(核化アミロイド斑)より有意に高い確率で炎症を思わせる所見を示しました。びまん性アミロイド斑がアミロイド斑の前駆体であるという通説に従えば、上記の研究データも疾患早期特有の炎症の所見と考えられます。
注2)2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
今後の期待
生体組織の透明化には様々な技術上のトレードオフが存在します。したがって、実験目的に応じて最良の手法を見つけ出すことが不可欠です。そのためには、他の透明化技術を同時に比較試行することが重要です。同じサンプルに複数の技術を試行する場合、ScaleSのようにサンプルに対するダメージがきわめて少ない方法は非常に有効です。
透明化による3次元的アプローチが台頭したからと言って、切片を用いる従来の2次元的アプローチが排除されるわけではありません。2次元的アプローチと3次元的アプローチ、さらに光学顕微鏡観察と電子顕微鏡観察を組み合わせることによって、観察対象を自在にズームイン・アウトすることが可能になります。神経回路の網羅的解析と個別研究とを柔軟に繋げることが出来るようになると期待されます。また、びまん性アミロイド斑のように、広く深い領域にひそむ複雑な組織構造に対する3次元的可視化技術が発展すれば、疾病メカニズムに対する我々の理解は増進し、薬剤評価の精度が飛躍的に向上などが期待できます。
原論文情報
- Hiroshi Hama, Hiroyuki Hioki, Kana Namiki, Tetsushi Hoshida, Hiroshi Kurokawa, Fumiyoshi Ishidate, Takeshi Kaneko, Takumi Akagi, Takashi Saito, Takaomi Saido & Atsushi Miyawaki, "ScaleS: an optical clearing palette for biological imaging", Nature Neuroscience, doi: 10.1038/nn.4107
発表者
理化学研究所
脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史(みやわき あつし)
専門職研究員 濱 裕(はま ひろし)
研究員 並木 香奈(なみき かな)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
AMED事業に関するお問い合わせ
日本医療研究開発機構 脳と心の研究課
Tel: 03-6870-2222 / Fax: 03-6870-2244
brain-pm [at] amed.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.アルツハイマー病
認知機能の低下などを症状とする認知症の一種。脳の神経細胞外にできるアミロイド斑や神経細胞内に生じる神経原線維変化が引き金となって、神経細胞死が起こり発症につながると考えられている。 - 2.アミロイド斑、抗アミロイド抗体
加齢によってアミロイドβと呼ばれるタンパク質が異常結集して形成される。老人斑ともよばれる。アミロイドタンパク質に結合する抗アミロイド抗体によって検出できる。 - 3.ソルビトール
グルコースの化学反応によって得られる糖アルコールの一種。甘味剤として広く使われている(ソルビット)。 - 4.蛍光標識
タンパク質を蛍光物質または蛍光タンパク質で標識すること。または標識に用いる蛍光物質やタンパク質のこと。 - 5.有機溶媒
水に溶けない物質を溶かす、常温常圧で液体の有機化合物の総称。エタノール、ベンゼンなど。 - 6.界面活性剤
分子内に水に親和性のある部分(親水基)と脂質に親和性のある部分(疎水基)の両方を持つ物質の総称。洗剤の主成分。 - 7.シナプス構造
神経細胞同士の間隙で、神経細胞内を伝わってきた電気信号が化学信号に変換されて、次の神経細胞に伝達される場である。シナプス構造の有無は電子顕微鏡でのみ直接判断することが可能である。 - 8.蛍光抗体
特定のタンパク質に結合する抗体を、蛍光物質で標識したもの。 - 9.ミクログリア
脳内に存在するグリア細胞の一種で、免疫反応に関わっており、マクロファージのような役割を果たす。 - 10.びまん性
一般に病変がはっきり限局しておらず、広範囲に広がっていること。
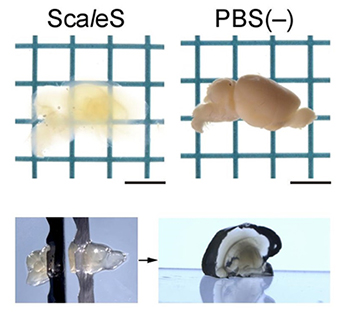
図1 ScaleSによるマウス成体脳の透明化
生後10週齢のマウスの大脳を2つの半球に分け、片一方にScaleS処理を施した(図上左)。図上右は、リン酸バッファ(PBS(-))に浸漬したままの半球。透明脳半球から切り出したスライスは歪むことなく直立した(図下)。
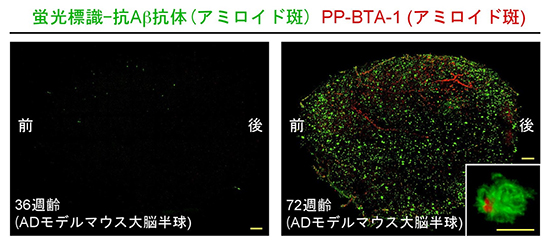
図2 アルツハイマー病モデルマウスの脳で観察されるアミロイド斑
36週齢(左)、72週齢(右)のモデルマウスの大脳半球にScaleS, AbScale, ChemScaleを適用し、アミロイド斑を抗Ab抗体とPP-BTA-1で蛍光標識して観察(それぞれ緑と赤で表示)。挿入図(右)は、1アミロイド斑の高倍率画像。
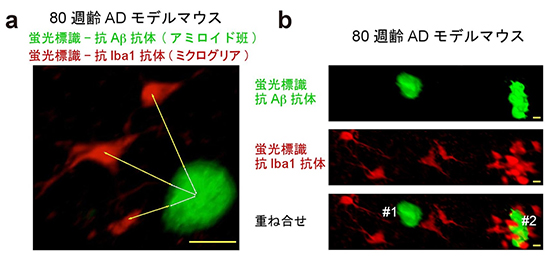
図3 アミロイド斑とミクログリアとの相互作用
80週齢のモデルマウスの脳にScaleS, AbScaleを適用。アミロイド斑を抗Ab抗体で、ミクログリアを抗Iba1抗体で蛍光標識(それぞれ緑と赤で表示)。(a) 両者間距離を3次元空間で計測するプログラムを作成。(b) 隣り合う2アミロイド斑。#2には多くのミクログリアが絡まっている。
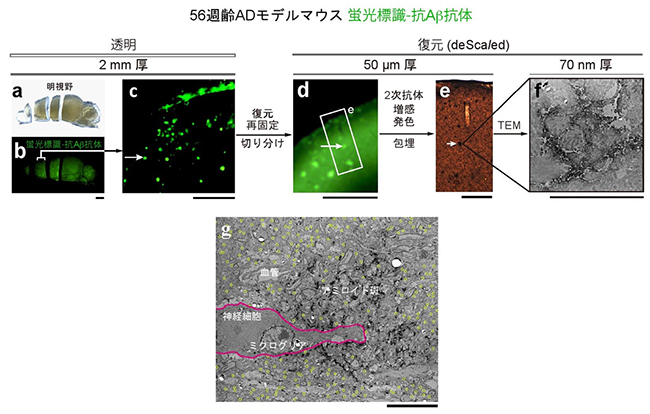
図4 1つのアミロイド斑をさまざまな空間解像度で観察
(a)~(f) 56週齢のアルツハイマー病モデルマウスの透明大脳半球において、蛍光標識したアミロイド斑を観察、そのうちの一つに照準設定。トリミングと復元(PBS(-)による浸漬)などを行って、光顕および電顕による高解像度観察を施行。(g) 電子顕微鏡画像。アミロイド斑(中央の黒ずんだ領域)の周囲に観察される興奮性シナプス(黄色の丸)は高密度で検出された。
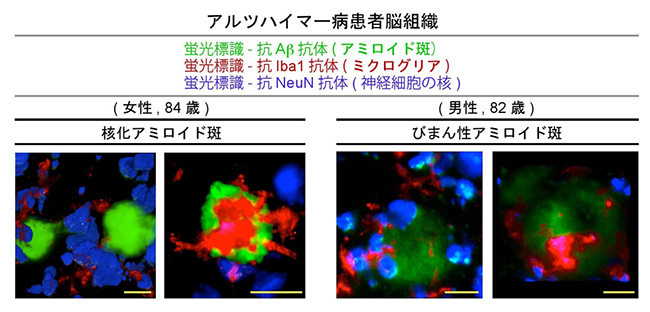
図5 ヒト死後脳における核化アミロイド斑とびまん性アミロイド斑
84歳(女性)の患者脳に検出された通常の核化アミロイド斑(ミクログリアとの相互作用無:左、有:右)。82際(男性)の患者脳に検出されたびまん性アミロイド斑(ミクログリアとの相互作用無:左、有:右)。びまん性アミロイド斑は、3次元画像データのre-sectioningによって検出された。統計的解析の結果、びまん性アミロイド斑が高確率でミクログリアと相互作用し、炎症を思わせる所見を示した。
