要旨
理化学研究所(理研)多細胞システム形成研究センター器官誘導研究チームの辻孝チームリーダー、東京医科歯科大学医歯学総合研究科顎顔面矯正学分野の森山啓司教授らの共同研究グループ※は、マウスをモデルにした研究で、歯のもととなる原基(歯胚)の分割操作を行うことにより、1つの歯胚から複数の歯胚を発生させる歯胚分割技術[1]を開発しました。
歯の喪失に対する治療として、入れ歯やブリッジ、インプラントといった人工物による代替治療が行われ、咀嚼(そしゃく)機能を回復する有効な医療技術として確立しています。しかし、これらの治療法だけでは、歯の生理的機能を完全に回復することが難しいため、より生物学的な機能を付加し、周囲の組織と連携して機能する「歯科再生治療」の開発が期待されています。現在行われている歯科再生治療として、自身の機能していない歯を歯の欠損部に移植し、歯の生理機能を回復する自家歯牙(しが)移植や幼弱な発生段階の自家歯胚を移植し、歯を発生させる歯胚移植治療が行われています。これらの治療法は、有用な歯科再生治療として注目されていますが、1つの個体が持つ移植可能な歯や歯胚には限りがあるため、歯胚の数を増やす技術の開発が望まれていました。
共同研究グループは、歯胚の分割操作を行うことにより、1つの歯胚から複数の歯胚を発生させる歯胚分割技術を開発しました。この技術を用いて実験を行ったところ、複数の歯胚が正常に発生し、天然の歯と同等の構造を持った歯が再生されました。これら再生歯は、矯正力(歯列矯正の際に加える力)を加えることによって、骨リモデリング[2]を介した歯の移動が可能で、また、中枢に伝達して痛みなども感知する神経機能を持っており、機能的にも天然歯と同等でした。
今回の技術を発展させ、ヒトへ応用することができれば、現在の自家歯牙移植や歯胚移植治療の課題である移植数の問題を解決できるかもしれません。また、歯胚分割技術は、歯胚だけでなく、その他の器官に対しても適用できる可能性があるため、新たな再生移植医療の技術開発へつながると期待できます。
本研究成果は英国のオンライン科学雑誌『Scientific Reports』(12月17日付け)に掲載されました。
※共同研究グループ
理化学研究所 多細胞システム形成研究センター
器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)(東京理科大学 総合研究機構 客員教授)
東京医科歯科大学 医歯学総合研究科 顎顔面矯正学分野
教授 森山 啓司(もりやま けいじ)
大学院生 山本 直(やまもと なおみ)
背景
咀嚼(そしゃく)や発音などの口腔機能は、健康やQuality of life(QOL)の維持・向上に重要な役割を果たしています。歯の先天性欠損や虫歯、歯周疾患による歯の喪失は、発音、咀嚼、咬合(噛み合わせ)などの口腔機能に重大な障害を引き起こすだけでなく、全身の健康状態にも影響を及ぼすと考えられており、現代の国民病ともいえます。
現在の歯科治療は、主に人工の歯科材料を利用して形態の修復と機能の回復を図る医療技術として発展してきています。しかし、これら治療法だけでは、歯の生理的機能を完全に回復させることが難しいため、生物学的な機能を保持し、周囲組織と親和性・適合性を持つ「歯科再生治療」の開発、臨床応用が期待されています。
現在行われている歯科再生治療に、自身の歯を欠損部へ移植する歯牙(しが)移植治療や、幼弱な発生段階の自家歯胚を利用する歯胚移植治療(図1)があります。これらの治療法は歯の生理的機能を回復可能であるとともに、免疫学的観点からも現実的、かつ有用な歯科再生治療として注目されています。
しかし、1人のヒトが持つ歯胚の数や、歯胚の発生時期は限られており、移植可能な歯や歯胚には制限があります。そのため、発生生物学に基づいた生物工学的技術を応用して、移植材料としての歯胚そのものの数を増やす技術の開発が望まれています。
研究手法と成果
歯は、歯の元となる原基(歯胚)から発生し、上皮細胞と間葉細胞の相互作用によって発生する外胚葉性器官の1つです。歯胚において歯の発生制御に重要なシグナルセンター[3]が形成される胎齢14.5日のマウス臼歯(きゅうし)歯胚(帽状期:発生段階で、歯胚が形成される時期)をナイロン糸で結紮(けっさつ)し、1つの歯胚を2つに分割しました。さらに、この分割した歯胚が口腔内で正常な歯に発生するかどうか、また、再生した歯が天然の歯と同等の生理的機能を持つかどうかを検証しました。
1)マウス臼歯歯胚の結紮による分割
実験では、まずマウスから摘出した胎齢14.5日の臼歯歯胚の真ん中を完全に分断されないところまで細いナイロン糸で結紮し、器官培養を行いました。すると、6日後には上皮組織に囲まれ、完全に分断された2つの歯胚が発生しました(図2)。
さらに、分割された歯胚が口腔内で正常な歯に発生するかを確認するため、結紮歯胚をマウス腎皮膜下に移植しました。その結果、30日後にはエナメル質、象牙質、歯槽骨を持ち、歯根膜や歯槽骨に囲まれた正常な組織構造を持つ独立した2つの歯が形成されました(図3)。また、これら分割歯は大きさや咬頭(こうとう)の数(歯冠上部の突起数)が天然歯のおよそ半分になりました。
2)結紮後の歯胚の分割過程の解析
結紮直後の歯胚の分割過程を時空間的に観察するため、全ての細胞核と染色体が緑の蛍光を発し、さらに、エナメルノット(細胞周期[4]がG0/G1期の細胞)が赤い蛍光を発するトランスジェニックマウスを作製しました。このマウスの臼歯歯胚を3.5日間器官培養しながら歯の形態形成を高感度共焦点顕微鏡で観察しました(図4)。その結果、結紮直後にはすでにシグナルセンターであるエナメルノットが2つに分断されており、そのエナメルノット周辺の上皮組織が増殖を続け、結紮面に陥入することによって歯胚が分断されていく様子が見られました。器官培養3日目には、各分割歯の咬頭が形成されていく様子が観察されました。
3)分割歯胚の遺伝子発現解析
歯の発生初期に重要なShh遺伝子、Fgf4遺伝子の発現をin situハイブリダイゼーション[5]で解析したところ、分割歯胚でも天然歯胚と同様の発現をしていることが分かりました(図5左)。また、歯胚の構成要素の1つである歯小嚢で発現するF-spondin(Spondin)遺伝子、および間葉組織と骨で発現するCollagen type 1,alpha 1 (Col1a1) 遺伝子の発現を解析したところ、分割歯胚それぞれに天然歯胚と同様の発現が認められました(図5右)。このことからも、分割歯胚は天然歯胚と同様の分子メカニズムで発生していることが示されました。
4)歯胚が分割される仕組み
器官形成において、反応拡散モデル[6]を基盤とした器官形成領域の形成理論が提唱されており、歯数の決定には、活性化因子としてのLef1タンパク質や抑制因子としてのEctodinタンパク質が形成する反応拡散波が寄与していることが報告されています。そのため、分割歯胚におけるそれらの遺伝子発現パターンをin situハイブリダイゼーションにより解析しました(図6)。天然歯胚では活性化因子としてのLef1遺伝子はエナメルノットとその周囲の間葉に発現し、抑制因子としてのEctodin遺伝子はLef1領域を囲んで発現していました。分割歯胚においても、それぞれの歯胚が天然歯胚と同様の遺伝子発現を示し、Ectodin遺伝子が歯の形成領域を負に制御することによって歯胚が分割されたと考えられます。このことから、歯数およびサイズは歯胚形成領域内における特定の活性化因子/抑制因子の発現によって決定され、結紮操作により人為的に反応拡散波を再領域化することによって、可塑的に歯の数および大きさが制御された可能性が示されました。
5)分割歯胚の口腔内移植と生理的機能の解析
歯の再生では、分割歯胚が天然歯胚と同等の組織構造を持つだけでなく、口腔内に移植したときに、レシピエント(移植を受ける個体)の顎骨と正常に生着し、さらに周囲組織と連携し機能することが重要です。そこで、マウスの口腔内に分割歯胚を移植し、歯の発生過程をマイクロCTで観察しました(図7)。その結果、移植約2か月後には反対側の歯と咬合し、機能していることが示されました。
さらに、分割歯に対して矯正力(歯列矯正の際に加える力)を加え、歯根膜の重要な機能である骨リモデリングによる歯の移動について解析しました。矯正力を加えることによって十分な歯の移動が認められ、骨リモデリングを介した歯の移動がなされていることから、歯根膜機能も天然歯と同等であることが示されました(図8)。
また、分割歯の歯髄(歯の神経組織)および歯根膜に神経が侵入し、機能を持つかを解析しました。その結果、分割歯の歯髄と歯根膜に神経線維が侵入し、矯正力や露髄刺激(歯髄が一部露出することによる刺激)による侵害刺激を与えると、刺激2時間後の三叉神経脊髄路核[7]の一部の神経細胞においてc-Fosタンパク質の産生が認められました(図9)これらの結果から、分割歯では神経が再生し、中枢と接続して機能的であることが分かりました。
今後の期待
共同研究グループが開発した歯胚分割技術を用いることにより、1つの歯胚から複数個の歯胚を発生させることが可能となりました。さらに、分割歯胚を口腔内に移植することにより、機能的な歯を複数、発生させることが可能であることが示されました。
今後、この方法をヒトに応用することで、先天性歯胚欠損や歯の喪失患者の自己歯胚を用いて免疫学的拒絶反応を受けることがなく、歯の数を増やせる可能性が示されました。本研究から、臨床応用に近い歯科再生療法へと発展することが期待できます。
原論文情報
- Naomi Yamamoto, Masamitsu Oshima, Chie Tanaka, Miho Ogawa, Kei Nakajima, Kentaro Ishida, Keiji Moriyama & Takashi Tsuji, "Functional tooth restoration utilising split germs through re-regionalisation of the tooth-forming field", Scientific Reports, doi: 10.1038/srep18393.
発表者
理化学研究所
多細胞システム形成研究センター 器官誘導研究チーム
チームリーダー 辻 孝 (つじ たかし)
(東京理科大学 総合研究機構 客員教授)
東京医科歯科大学 医歯学総合研究科 顎顔面矯正学分野
教授 森山 啓司 (もりやま けいじ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
国立大学法人東京医科歯科大学 広報部広報課広報係
Tel: 03-5803-5833 / Fax: 03-5803-0272
kouhou.adm [at] tmd.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.歯胚分割技術
細いナイロン糸で結紮(けっさつ)することによって物理的外力を歯胚に加え、ひとつの歯胚から複数の歯胚を発生させる技術。 - 2.骨リモデリング
骨を壊す働きをする破骨細胞が骨を吸収する一方で、骨を作る働きをする骨芽細胞が骨を形成することによって、骨が作り変えられること。歯に矯正力を加えると、圧迫側による周囲骨の吸収と牽引側における周囲骨の骨形成が生じることによって、歯が移動する。 - 3.シグナルセンター
歯の発生過程において、一部の上皮細胞の集団(エナメルノット)がシグナルセンターとして機能し、周囲の細胞の運命や歯の形態を調節している。エナメルノットでは細胞増殖が停止しており、周囲の細胞は増殖することによって、咬頭などの形態が形成される。 - 4.細胞周期
細胞分裂のサイクルを細胞周期という。細胞の核内でDNA合成の準備が行われるG1期、DNA合成が起こるS期、細胞分裂の準備が行われるG2期、細胞分裂が起こるM期の4段階に分かれる。 - 5.in situハイブリダイゼーション
遺伝子の発現を解析するために、組織の切片に遺伝子を検出させる試薬を入れて、その発言を解析する方法。 - 6.反応拡散モデル
2つの物質がある条件のもとで、反応し合いながら拡散するとき、そこに物質の濃淡の波ができ、その波が生物の形態や模様を作り出す。この原理を反応拡散系という。自然界には多種多様なパターン(模様)が存在し、パターン形成が反応拡散モデルによって再現されることが分かってきている。 - 7.三叉神経脊髄路核
顎顔面領域の痛みを中継する核。末梢への侵害刺激(本実験では矯正的歯の移動や露髄)により三叉神経脊髄路核においてc-Fos陽性細胞が発現することが知られている。
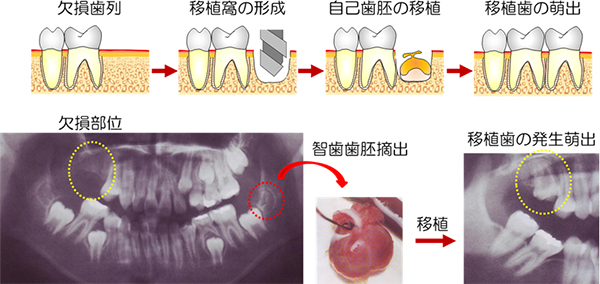
図1 自家歯胚移植による歯の再生治療
非機能歯である自己歯胚を、欠損部位に移植することによって、機能的な歯を再生可能であることから、実際に行われてきている治療法である。智歯とは親知らずのこと。
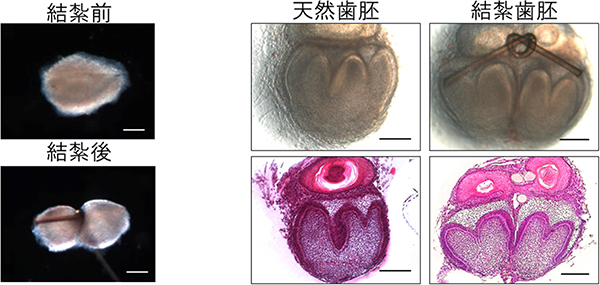
図2 胎齢14.5日のマウス臼歯歯胚の結紮による分割操作と器官培養6日目の写真
- 左: 胎齢14.5日のマウス臼歯歯胚の真ん中を、完全に分断されないところまで細いナイロン糸で結紮した。
- 右:
器官培養6日目の天然歯胚および結紮歯胚の実体写真とHE(ヘマトキシリン・エオジン)で染色した画像。結紮歯胚には2つに分断された歯胚が認められる。
※μm:マイクロメートル、100万分の1メートル。スケールバー:100μm。
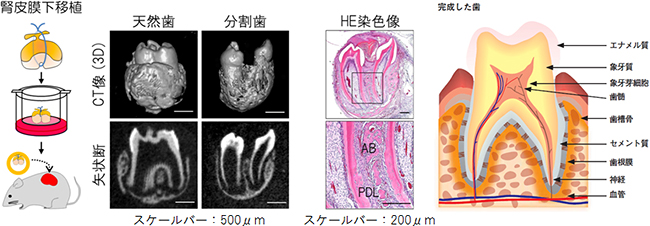
図3 腎皮膜下に移植し発生した分割歯の解析
- 左: 結紮歯胚を4日間器官培養した後、マウス腎皮膜下へ移植し正常な歯へ発生するか解析した。
- 中: 腎皮膜下移植30日後、分割歯では、天然歯と同等の組織構造を持つ2本の完全な歯が発生した。また、2本の周囲には歯根膜や歯槽骨が認められ、それぞれ独立した歯が形成された。AB:歯槽骨、PDL:歯根膜。
- 右: 歯の構造。
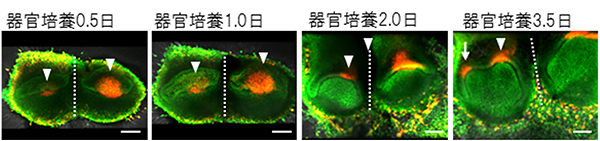
図4 結紮歯胚の細胞動態解析
エナメルノットを標識したトランスジェニックマウス(H2B-GFP×Fucci)由来の臼歯歯胚を用いて、3.5日間器官培養しながら共焦点顕微鏡で細胞動態を解析した。結紮直後にはすでにエナメルノット(赤)が2つに分断されていることが認められた(器官培養0.5日)。培養が進むにつれて、エナメルノット周囲の上皮組織が陥入し(器官培養2.0日)、歯胚が完全に2つに分断され、さらには2ndエナメルノットが形成される様子が観察された(器官培養3.5日)。※スケールバー:100μm
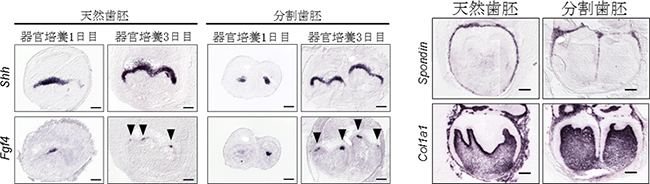
図5 天然歯胚および分割歯胚の遺伝子発現解析
- 左: 器官培養1日目には1st エナメルノットにShh遺伝子およびFgf4遺伝子が発現した。3日目には歯冠幅に一致して内エナメル上皮にShh遺伝子および2nd エナメルノット にFgf4遺伝子が発現していた。
- 右:
分割歯胚それぞれの周囲には、歯小嚢で発現するSpondin遺伝子および歯胚間葉と骨に発現するCol1a1遺伝子の発現が認められ、分割歯胚は正常な遺伝子発現を伴った独立した歯周組織を持つことが示された。
※黒く見える部分が遺伝子が発現している個所。スケールバー:100μm。
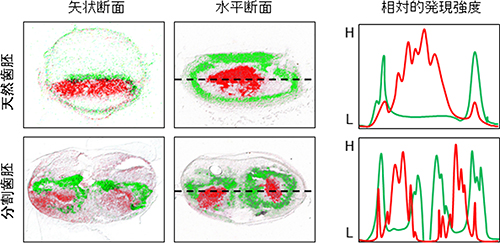
図6 歯胚形成領域に関連する遺伝子発現解析
緑の疑似カラーが抑制因子Ectodin遺伝子の発現領域、赤が活性化因子Lef1遺伝子の発現領域であり、水平断面の黒い破線部分の遺伝子発現強度をグラフ化したものが右図。分割歯胚は天然歯胚の発現パターンをおよそ半分にしたものとなっており、歯数と大きさは、特定の活性化因子と抑制因子の発現のバランスによって決定されていることが示された。
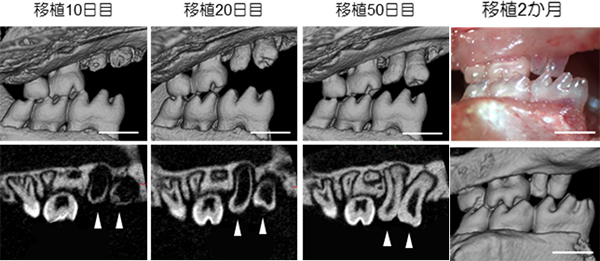
図7 分割歯胚の口腔内移植後の経過像
分割歯胚をマウスの口腔内に移植しマイクロCTにて萌出過程を観察した。移植約2か月後には反対側の歯と咬合していることが認められた。※スケールバー:50μm。
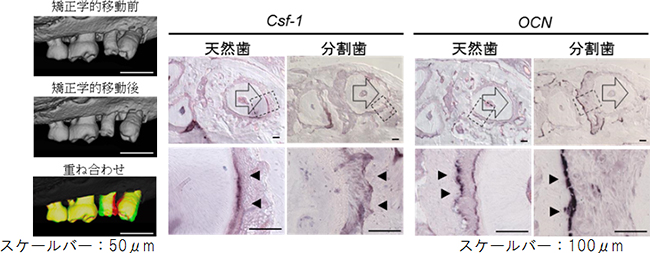
図8 分割歯に対して矯正力を加えた際の歯の移動
- 左:
分割歯にコイルを装着し、矯正力を加えて歯の移動を解析したところ、十分な移動量が認められた。
赤:矯正前、緑:矯正後 - 右: 分割歯に矯正学的力を加えたところ、圧迫側には破骨細胞関連マーカーであるCsf-1遺伝子、牽引側には骨芽細胞関連マーカーであるOcn遺伝子の発現が認められたことから(下段:矢頭)、骨リモデリングを介した歯の移動が可能であることが示された。上段の矢印は歯の移動方向を示す。
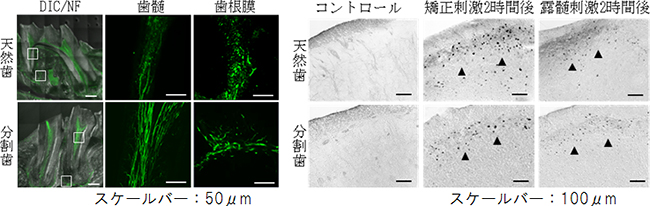
図9 神経侵入の解析および侵害刺激の中枢への伝達機能の解析
- 左: 天然歯および分割歯の歯髄、歯根膜へ、NF(ニューロフィラメント)陽性の神経が侵入していることを示す。
- 右: 延髄三叉神経脊髄路核にc-Fosタンパク質の発現(矢頭が示す黒い点)が認められたことから、歯に対する矯正力や露髄刺激による侵害刺激を歯髄や歯根膜の知覚神経が受容し、中枢神経へ伝達する機能を持つことが示された。
