要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、小椋章弘特別研究員らの国際共同研究グループ※は、タンパク質であるアルブミン[1]に対して、さまざまな構造を持つ「アスパラギン結合型糖タンパク質糖鎖(N-結合型糖鎖)[2]」をクラスター[3]化することにより、マウス内での排出経路を制御したり、肝臓の特定の細胞を高度に認識したりすることに成功しました。
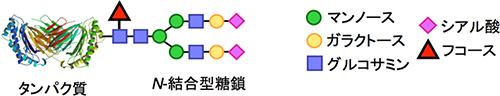
タンパク質や細胞表面に存在するN-結合型糖鎖は、生体内で特定の器官や細胞を高度に認識する役割を担っており、生命の維持活動に欠かせません。しかし、糖鎖は水溶性で、かさ高い(空間に占める体積が大きい)ため扱いにくく、しかも生体内ではたくさんの種類の糖鎖分子が混在しています。さらに、生体内のタンパク質や細胞の表面では、多数の糖鎖分子がクラスターを形成して、複数の分子が複数の受容体と対応する「パターン認識」[4]を行うことで高度な相互作用を実現しています。このため、糖鎖の相互作用を詳しく解析し、生体内で特定の器官や細胞を認識させる分子として活用することは困難でした。
国際共同研究グループは、独自に開発した「理研クリック反応」(6π-アザ電子環状反応)[5]を利用することで、アルブミンに対して複数のN-結合型糖鎖を効率的に導入し、アルブミン表面に生体内で実際に起きている糖鎖クラスター環境を初めて構築することができました。これら糖鎖クラスターの挙動をマウス内で詳しく解析することにより、糖鎖構造によって糖鎖の排出経路や臓器細胞選択的な集積を高度に制御できることを見出しました。
理研クリック反応を利用すると、さまざまな糖鎖構造を用いて自在に糖鎖クラスターを構築することができるため、今後、糖鎖を用いた創薬研究や医療診断分子の開発に貢献すると期待できます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。
本成果は、英国のオンライン科学雑誌『Scientific Reports』(2月23日付け:日本時間2月23日)に掲載されます。
背景
糖鎖とは、最も単純な糖である単糖(ガラクトースなど)が数個、ときには数百個以上も枝分かれしながら連なったものです。単糖の種類や数、並び方、枝分かれの違いによって、糖鎖はとても多くの種類に分けられます。生体内にある糖鎖の大部分は、細胞膜上のタンパク質や脂質に結合しています。細胞膜にないタンパク質にも、その半数以上に糖鎖が付いています。
特に「アスパラギン結合型糖タンパク質糖鎖(N-結合型糖鎖)」は、特定の器官や細胞を高度に認識する役割を担っており、生命の維持活動に欠かせません。しかし、糖鎖が関わる生体内動態や臓器選択的な集積、その標的受容体などについてはほとんど研究されていませんでした。その要因として、糖鎖が水溶性で嵩(かさ)高く(空間に占める体積が大きい)取り扱いにくい分子であり、生体内では無数の糖鎖分子が混在することが挙げられます。さらに、生体内のタンパク質や細胞表面では、多くの糖鎖分子がクラスターを形成して、複数の分子が複数の受容体と対応する「パターン認識」を行うことで、高度な相互作用を実現しています。このため、糖鎖の相互作用を詳しく解析し、生体内で特定の器官や細胞を認識させる分子として利用することは困難でした。
国際共同研究グループはこれまでに、人工のポリリジン[6]を基盤としたデンドリマー担体[7](輸送体)に糖鎖クラスターを構築し、生体内でのイメージングによる動態や集積の解析に取り組みました注1)。しかし、生体内での安定性に問題があり、ポリリジンを基盤としたデンドリマー担体が生体内酵素で速やかに分解される場合が多いため、厳密な解析ができませんでした。
注1)2010年9月21日プレスリリース「世界最大のN-結合型糖鎖クラスターの開発と体内動態解析に成功」
研究手法と成果
今回、国際共同研究グループは、糖鎖クラスターを構築する新たな担体として、血中での安定性が見込めるとともに、修飾可能なリジン残基が30個程度存在するヒト血清アルブミンを用いました。従来のイソチオシアナートや活性エステルを使ってクラスターを作る方法では、アルブミン1分子に2~3分子の糖鎖しか導入できませんでした。そこで、アルブミンのリジン残基に対して、効率的にN-結合型糖鎖を導入する方法を検討しました。その結果、「理研クリック反応」(6π-アザ電子環状反応)を用いた新たな糖鎖クラスターの作製法を開発しました(図1上)。
この手法により、10分子もの、さまざまなN-結合型糖鎖を容易に導入することが可能になり、10分子とも同一のN-結合型糖鎖を導入した均一糖鎖クラスター(図1左下)や異なるN-結合型糖鎖を任意の割合で導入した不均一糖鎖クラスターを合成することに初めて成功しました(図1右下)。
そこで、図1で調製したさまざまな糖鎖クラスターをヌードマウス[8]に静脈注射し、非侵襲的な蛍光イメージング[9]により動態解析を行いました。糖鎖を全く導入しないアルブミンを注射した場合は、血流を巡ってマウスの体全体に広く分布します(図2A、赤黄色に写っている箇所が蛍光を示す)。一方、α(2-6)シアル酸を末端に持つ糖鎖クラスター(図2中の4a)の場合は、肝臓を経て膀胱から尿として速やかに排出されました(図2B)。一方、糖鎖末端のシアル酸部分を切断し、ガラクトースを末端に持つ糖鎖クラスター(図2中の4c)の場合には、まず肝臓へ移行した後、選択的に胆嚢・腸管を経て速やかに排出されました(図2C)。このように、アルブミン表面にクラスター化したN-結合型糖鎖の違いにより、排出経路を制御することに初めて成功しました。
さらに、シアル酸とガラクトース糖鎖の割合を変化させた不均一糖鎖クラスター(図1右下)の排出を詳しく検討した結果、ガラクトース糖鎖の割合が増えるにつれて腸管排出の割合が向上することが分かりました(図2D)。
血中内の糖タンパク質はシアル酸がしだいに切断され、ガラクトースが露出するとアシアロ糖タンパク質受容体[10]へ認識されやすくなり、排出が促進されることが知られています。今回、この現象を不均一糖鎖クラスターにより模倣することで、ガラクトース糖鎖の胆嚢・腸管への排出が、生体内でタンパク質の速やかな排出に寄与していることが明らかになりました。
さらに、N-結合型糖鎖を末端から順に切断して、グルコサミンやマンノースを末端に持つ糖鎖クラスター(図3中の4d-4f)の場合では、排出が著しく抑えられ、肝臓に強く集積しました(図3A-C)。マウスから摘出したそれらの肝臓切片を詳しく調べた結果、糖鎖クラスターは、肝臓の主要細胞である肝実質細胞[11]には移行しておらず、類洞内皮細胞などから構成される非肝実質細胞[11]に選択的に集積していることが判明しました(図3D-F)。特にグルコサミンや非対称な糖を末端に持つ糖鎖クラスター(図3中の4dや4f)は、星細胞表面のデスミンやビメンチン分子[12]と相互作用して、肝星細胞に集積することが分かりました(図3G、I)。星細胞が活性化されると、肝繊維化や肝硬変を引き起こす原因となることが分かっていますが、医療分野で有効なトレーサーや診断法は見出されていません。したがって。今回開発した糖鎖アルブミンが、初めての有効な分子となる可能性があります。
また、マンノースを末端に持つ糖鎖クラスター(図3中の4e)は、主に類洞内皮細胞や免疫細胞であるクッパー細胞に捕捉されていることが判明しました(図3H)。糖鎖構造によって生体内で肝臓の細胞を高度に見分けることを明確に示した成果です。
このように、糖鎖クラスターの構造により、動態や集積を著しく制御できることを示しましたが、アルブミンに対して数分子しか糖鎖を導入しない場合や、糖鎖末端の単糖のみでクラスターを作製した場合には同様の効果を得ることができませんでした。「理研クリック反応」を駆使して、アルブミン上にN-結合型糖鎖の全構造を用いてクラスター化することで、生体内で実際に起きている糖鎖クラスター環境を初めて疑似化できました。その結果、細胞集積や排出経路の変化観察を実現しました。
今後の期待
国際共同研究グループが開発した「理研クリック反応」により、タンパク質や細胞表面など、さまざまなアミノ基担体に糖鎖クラスター構造を効率的に構築することができます。また、同じ「理研クリック反応」を用いることにより、本報告で活用した蛍光色素に限らず、PETやMRI、あるいは放射線治療に適応できる核種で標識することも可能です。
今回開発した糖鎖アルブミンは、生体内でのさまざまな器官やがんを代表とする疾患部位に対するドラッグデリバリーシステム(DDS)[13]として、今後、創薬研究や医療診断分子の開発に貢献すると期待できます。
※共同研究グループ
理化学研究所
田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 小椋 章弘(おぐら あきひろ)
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
イメージング応用研究グループ 健康・病態科学研究チーム
研究員 野崎 聡(のざき さとし)
センター長 渡辺 恭良(わたなべ やすよし)
イメージング機能研究グループ 生体機能評価研究チーム
研究員 田原 強(たはら つよし)
グループディレクター 尾上 浩隆(おのえ ひろたか)
イメージング応用研究グループ 微量シグナル制御技術開発特別ユニット
リサーチアソシエイト 原 詳子(はら みつこ)
特別ユニットリーダー 小嶋 聡一(こじま そういち)
グローバル研究クラスタ 理研-マックスプランク連携研究センター
システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
特別研究員 木塚 康彦(きづか やすひこ)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
チームリーダー 谷口 直之(たにぐち なおゆき)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
大阪女子短期大学 生活科学科
教授 盛本 浩二(もりもと こうじ)
原論文情報
- Akihiro Ogura, Tsuyoshi Tahara, Satoshi Nozaki, Koji Morimoto, Yasuhiko Kizuka, Shinobu Kitazume, Mitsuko Hara, Soichi Kojima, Hirotaka Onoe, Almira Kurbangalieva, Naoyuki Taniguchi, Yasuyoshi Watanabe, and Katsunori Tanaka, "Visualizing Trimming Dependence of Biodistribution and Kinetics with Homo- and Heterogeneous N-Glycoclusters on Fluorescent Albumin", Scientific Reports
発表者
理化学研究所
准主任研究員研究室 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 小椋 章弘(おぐら あきひろ)
 左から田中 准、小椋 章弘
左から田中 准、小椋 章弘
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.アルブミン
血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、機能性低分子を付着させる生体高分子としても良く使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。血流の状態を良く反映するため、MRIなどを用いた疾患の診断薬として利用される。また、ガラクトース単糖で修飾したアルブミンは、アシアロ糖タンパク質(下記[7]参照)の機能、すなわち排出など肝機能の診断薬としても利用されている。 - 2.アスパラギン結合型糖タンパク質糖鎖( N-結合型糖鎖)
タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内では、タンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。一方、細胞外では、タンパク質の血中内安定性、タンパク質/タンパク質相互作用、免疫調節、細胞増殖、がんの浸潤など多くの生物学的現象に重要な役割を果たしていると考えられるが、その標的については未知な点が多く、詳細な機能解明については今後の研究成果が待たれる。
特に、糖鎖末端のシアル酸やフコースが重要な意味を持つ可能性が知られていたが、国際共同研究グループの成果によって、全ての糖鎖の部分構造が動物内での臓器選択性や動態、あるいは血中安定性に著しい影響を及ぼしていることが明らかとなった。
- 3.クラスター
本プレス発表では、同一、あるいは数種類の単分子糖鎖が、ある基盤上に複数個並べられた構造をクラスターと呼ぶ。同一の糖鎖がクラスターを構築するとき、「均一な糖鎖クラスター」、数種類の糖鎖がクラスターを構築する場合に、「不均一な糖鎖クラスター」と呼ぶ。 - 4.パターン認識
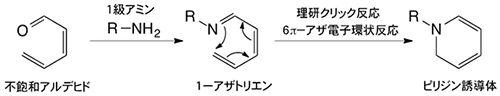
本プレス発表では、ある1つの分子が特定の受容体を認識する場合において、糖鎖クラスターのような複数個の分子が2つ以上の受容体を「パターン」で認識する場合を指す。複数個と複数個の認識である。 - 5.理研クリック反応(6π-アザ電子環状反応)
不飽和アルデヒドとリジン残基のような1級アミンが反応すると、1-アザトリエンが生成する。1-アザトリエンは、末端炭素原子と窒素原子が結合してピリジン誘導体を与える(アザ電子環状反応)。この反応は古くから良く知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率も良くなかったことから積極的に有機合成に利用されることはなかった。しかし1998年に、発表者らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、「理研クリック反応」として、国際研究グループが中心となり診断や放射線治療に向けた研究を展開している。
- 6.ポリリジン
アミノ酸の1種であるリジンが直鎖状、または分岐状に重合したポリペプチドの総称。 - 7.デンドリマー担体
デンドリマーは分岐状を、担体は分子を付着させる(並べる)基盤を指す。 - 8.ヌードマウス
先天的に胸腺を欠くマウス。胸腺を欠損するためにT細胞がつくられず、免疫不全を呈する。他の動物種の細胞を拒絶する力も弱いので、ヒトの組織やがん細胞の移植実験によく用いられる。 - 9.非侵襲的イメージング
動物を生きたままで動態や集積をイメージングにより可視化する方法。本プレス発表で実施した近赤外線領域に吸収を持つ蛍光イメージングや、PET、SPECT ( Single Photon Emission Computed Tomography )、あるいはMRIが代表例である。 - 10.アシアロ糖タンパク質受容体
肝臓の実質肝細胞(下記[11]参照)に高発現し、ガラクトースを末端に持つ糖タンパク質(アシアロ糖タンパク質)を強く認識して排出機構に関与する。シアル酸を末端に持つ糖鎖でも、クラスター化することにより認識されることが知られている。 - 11.実質肝細胞、非実質肝細胞
実質肝細胞は肝臓の大部分を占める細胞群であり、主な肝機能を担う。一方、類洞内皮細胞やクッパー細胞、星細胞(伊東細胞)は非実質肝細胞と呼ばれ、肝臓での異物認識・排除や免疫調節、または肝繊維化過程などに関与する。 - 12.デスミン、ビメンチン
どちらも主に細胞骨格を形成するタンパク質であるが、表面にも発現し、グルコサミンを持つ糖鎖を認識することが報告されている。 - 13.ドラッグデリバリーシステム(DDS)
体内の薬物分布を量的・空間的・時間的に制御し、コントロールする薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。
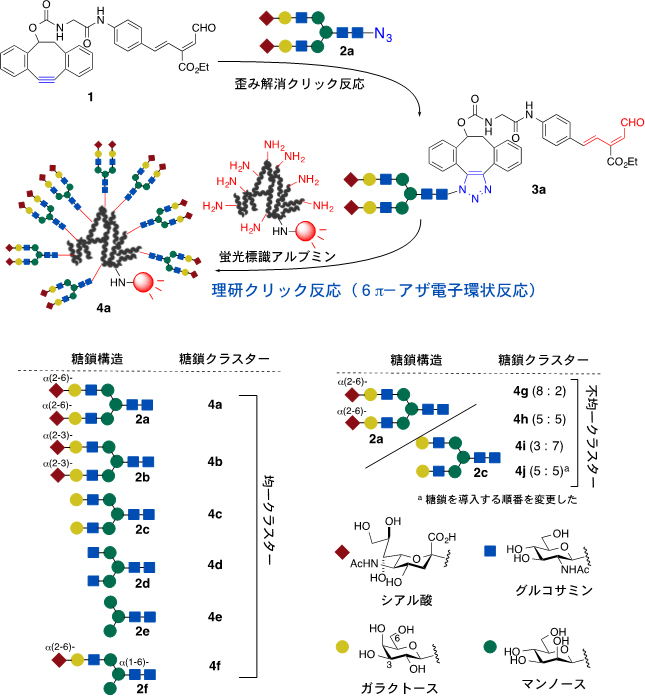
図1 N-結合型糖鎖の構造とアルブミン表面への糖鎖クラスター作製
上:不飽和アルデヒド分子(1)に対して、N-結合型糖鎖(2a)を結合させた(歪み解消クリック反応)後、アルブミンのリジンと理研クリック反応させることにより、室温条件下で均一糖鎖クラスター(4a)を効率的に構築できる。
下:さまざまなN-結合型糖鎖(2a~2f)を用いて均一糖鎖クラスター(4a~4f)、あるいは2種類以上の糖鎖からなる不均一糖鎖クラスター(4g~4j)を効率的に得ることができる。4gは2aと2cを8:2、4hは5:5、4iは3:7、4jは5:5(但し、糖鎖の導入順番を変えたもの)の各割合で持つ不均一糖鎖クラスターを示す。
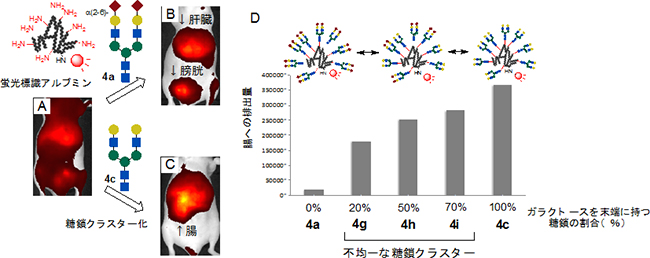
図2 マウスにおけるアルブミン表面の糖鎖クラスター構造による排出経路の制御
左:赤黄色に写っている箇所がアルブミンの蛍光を示す。糖鎖を導入しないアルブミンは体全体に広く分布するが(A)、α(2-6)シアル酸糖鎖(4a)を導入すると、肝臓を経て膀胱から排出される(B)。一方、ガラクトースを末端に持つ糖鎖(4c)は、腸管排出を著しく促進する(C)。
右:不均一な糖鎖クラスターの糖鎖の割合において、α(2-6)シアル酸糖鎖100%(4a)からガラクトース糖鎖の割合を、20%(4g)、50%(4h)、70%(4i)、100%(4c)と徐々に増加させると、腸管排出がしだいに増大する。
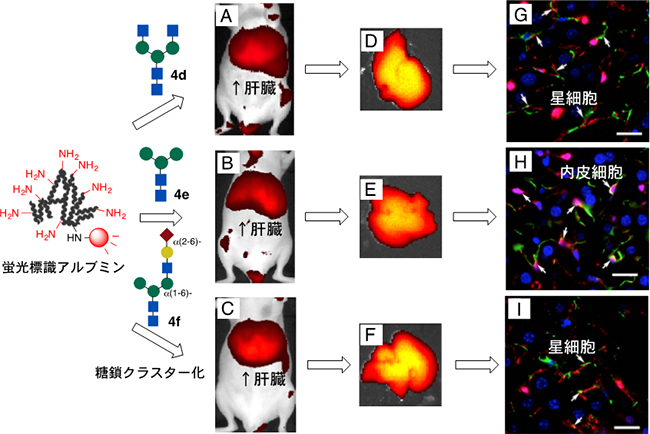
図3 マウスにおける糖鎖クラスター構造による非実質肝細胞への選択的な集積と組織解析
グルコサミン(4d)やマンノース(4e)、または非対称な糖を末端に持つ(4f)糖鎖クラスターは排出されず、肝臓の星細胞(G、I)や類洞内皮細胞(H)に選択的に集積する。赤は糖鎖クラスター、緑は星細胞もしくは類洞内皮細胞、青は核、棒線は20nmを示す。
