要旨
理化学研究所(理研)統合生命医科学研究センター疾患遺伝研究チームの吉田尚弘チームリーダー(研究当時)、安田琢和研究員(研究当時)らの共同研究グループ※は、遺伝子変異誘導によりアトピー性皮膚炎モデルマウス(Spadeマウス)を開発し、このモデルマウスにおけるアトピー性皮膚炎発症のメカニズムを解明し、発症の予防方法を発見しました。
アトピー性皮膚炎は、日本を含めた先進国の乳幼児でよくみられる炎症性皮膚疾患であり、遺伝要因と環境要因の複合によって発症すると考えられています。共同研究グループは、遺伝要因を明らかにするため、マウスに「化学変異原」を投与し、その中から、かいたり擦ったりする掻破(そうは)行動の強い皮膚炎を発症するマウスを選別しました。このマウスは清潔な環境で飼育しても、生後8~10週間でアトピー性皮膚炎を発症します。病気の原因となる遺伝子変異を調べたところ、さまざまな細胞の増殖や分化に重要なサイトカイン[1]のシグナル伝達因子である「JAK1」分子の遺伝子配列に点突然変異[2]が生じ、JAK1のリン酸化酵素であるキナーゼ活性が増加していることを突き止めました。これにより、発症前から表皮細胞の古い角質が剥がれるときに発現するプロテアーゼ(ペプチドの加水分解酵素)群の遺伝子発現が上昇し、角質による皮膚バリア[3]に機能障害が起こっていることも分かりました。
このマウスの皮膚にJAK阻害因子を塗ったところ、プロテアーゼの発現は抑制され、アトピー性皮膚炎の発症を遅らせることができました。軟膏基質として使われるワセリンを塗ることでも、発症の予防ができました。このとき、皮膚バリア機能も正常と同等に保たれるだけでなく、真皮(表皮の下にある線維性結合組織)の炎症発生も抑制されることが明らかとなりました。
共同研究グループでは、ヒトのアトピー性皮膚炎でも同じことが起こっているのかどうかを調べるために、アトピー性皮膚炎の患者の皮膚組織を調べたところ、6例中4例の表皮細胞でJAK1が活性化していることを発見しました。
ヒトにおいてアトピー性皮膚炎患者は、発症後にならないと診断がつきませんが、未発症の皮膚でJAK1を含む信号伝達経路の活性化が起こっている場合、アトピー性皮膚炎を発症する可能性のあること、ワセリンを塗ることで発症が予防できる可能性が示されました。また、今回作製したSpadeマウスを用いることによって、アトピー性皮膚炎発症に関わる複数の要因を分子レベル、細胞レベルで明らかにし、それぞれのターゲットを決めた発症予防法や治療法の確立が期待できます。
本研究は米国の科学雑誌『Journal of Clinical Investigation』に掲載されるのに先立ち、オンライン版(4月25日付:日本時間4月26日)に掲載されます。
※共同研究グループ
理化学研究所
統合生命医科学研究センター
疾患遺伝研究チーム
チームリーダー(研究当時) 吉田 尚弘(よしだ ひさひろ)(免疫器官形成研究グループ 研究嘱託・医師)
研究員(研究当時) 安田 琢和(やすだ たくわ)(免疫器官形成研究グループ 研究員)
免疫器官形成研究グループ
グループリーダー 古関 明彦(こせき はるひこ)
上級技師 長谷川 孝徳(はせがわ たかのり)
技師 松田 正史(まつだ まさし)
サイトカイン制御研究チーム
チームリーダー 久保 允人(くぼ まさと)
粘膜システム研究グループ
グループリーダー 大野 博司(おおの ひろし)
バイオリソースセンター
マウス表現型解析開発チーム
チームリーダー 若菜 茂晴(わかな しげはる)
開発技師 三浦 郁生(みうら いくお)
徳島文理大学 薬学部 病態分子薬理学
教授 深田 俊幸(ふかだ としゆき)
鈴鹿医療科学大学 薬学部 免疫学
准教授 西田 圭吾(にしだ けいご)
かずさDNA研究所 ゲノム医学研究室
室長 小原 収(おはら おさむ)
研究員 中山 学(なかやま まなぶ)
京都大学大学院医学研究科 皮膚科学
教授 椛島 健治(かばしま けんじ)
講師 大日 輝記(だいにち てるき)
東京大学大学院医学系研究科国際保健政策学専攻
助教 中岡 慎治(なかおか しんじ)
慶応義塾大学先端生命科学研究所
特任准教授 福田 真嗣(ふくだ しんじ)
バイオリサーチ研究所 Amorepacific Corporation R&D Center
研究員 Bin Bum-Ho(ビン・ボムホー)
背景
アトピー性皮膚炎は、日本を含めた先進国の乳幼児によくみられる炎症性皮膚疾患であり、繰り返す掻痒(そうよう)感の強い湿疹と免疫グロブリン(IgE)[4]産生上昇などによるアレルギー様反応が問題となります。遺伝的に皮膚バリア機能に障害がある人でアトピー性皮膚炎が発症しやすいことから、それが発症の遺伝的背景因子となることが示唆されていました。
しかし、遺伝的背景因子を持つヒトが、どうしてアトピー性皮膚炎を発症するのか、詳しいメカニズムは分かっておらず、モデル動物を用いた発症のメカニズムの解析が望まれていました。ところが、そのような発症経過を忠実に再現するモデルマウスはこれまで存在していませんでした。
研究手法と成果
共同研究グループはエチルニトロソウレア[5]という「化学変異原」をマウスに投与し、ゲノムに変異を起こすことにより、突然変異マウスを作製しました。50家系、3,000匹のマウスの表現型解析の結果、アトピー性皮膚炎を自然発症するマウスを発見しました(図1)。
このマウスは清潔な環境で飼育しても、生後8~10週でアトピー性皮膚炎を自然発症し、その3週間後に血清IgEやヒスタミン[6]などの痒みに関係する免疫系の物質の血中濃度が上昇しました。さらに4~5週間後には、慢性炎症時に上昇する炎症物質の血中濃度が上昇するという、段階を追った発症経過をたどりました。このことから共同研究グループは、この突然変異マウスを「Stepwise Progressive Atopic Dermatitis(Spade)マウス(多段階進行性アトピー性皮膚炎マウス)」と命名しました(図1)。
遺伝子マッピング手法で原因となる遺伝子座を特定し、候補遺伝子の遺伝子配列を調べたところ、「JAK1」という細胞内信号伝達分子[7]のアミノ酸配列に変異を起こす変異を発見しました(図2上)。
JAK1はさまざまなサイトカイン受容体[1]の下流で機能する分子であり、免疫系細胞の増殖・分化や機能発現に重要であることが知られています。しかし、骨髄移植実験[8]でSpadeマウスと野生型マウスの骨髄細胞を入れ替える実験を行ったところ、アトピー性皮膚炎を引き起こす原因は皮膚組織の側にあり、免疫系にはないことが明らかになりました。
JAK1はチロシンキナーゼ(チロシンリン酸化酵素)活性を持ち、それが活性化することでさらに下流の信号伝達分子を活性化し、さまざまな遺伝子発現を誘導します。SpadeマウスのJAK1の遺伝子変異は“機能獲得型”の変異であり、JAK1を介したシグナルが強く入ることによってアトピー性皮膚炎が起こると予想できました。そこで、JAK阻害剤をマウスの皮膚に塗ってみたところ、実際に発症を遅らせることができました(図2下)。このことから、皮膚でのJAK1の活性化変異がアトピー性皮膚炎を引き起こすことが確認できました。
次に、アトピー性皮膚炎の遺伝的な背景因子とされる皮膚バリア機能の低下があるか調べたところ、Spadeマウスではアトピー性皮膚炎発症の数週間前から皮膚バリア機能が低下していることが明らかになりました(図3上)。
以上のことから、Spadeマウスのアトピー性皮膚炎発症の原因は皮膚バリア機能の低下にあると考えられ、それを改善する目的でアトピー性皮膚炎が発症する4週間前からワセリンを1日おきに塗布してみました。すると、ワセリン塗布により2カ月以上にわたってアトピー性皮膚炎発症を予防することができました(図3下)。
ワセリンを塗った皮膚ではバリア機能が改善しているだけでなく、アトピー性皮膚炎発症前の真皮に炎症細胞が集まるのを防いでいることも明らかになりました。
皮膚での遺伝子発現を比較した結果、Spadeモデルマウスの皮膚では複数のセリンプロテアーゼ[9]の発現が増加していることが明らかになりました。
皮膚は常に新しい細胞と角質を作り出すために、生まれ変わりを続けています。皮膚に発現するセリンプロテアーゼは、古い角質を剥がすために適切な量が毎日作られ続けています。ところがSpadeマウスでは、セリンプロテアーゼの発現量が増加しているために角質が剥がれやすい状態になっており、バリア機能が低下していると考えられました。実際にSpadeマウスのJAK1変異は、複数のセリンプロテアーゼの発現を増加することが細胞実験でも確かめられました。
以上の研究結果から、Spadeマウスのアトピー性皮膚炎がなぜ発症するのか、どうすればそれを予防できるかをまとめたものが図4です。
また、ヒトにおいてもJAK1の活性化がアトピー性皮膚炎と関連しているのかどうかを調べる目的で、患者の皮膚でのJAK1活性化を調べたところ、6人の患者のうち4人の患者の表皮細胞でJAK1活性化が起こっていることが明らかになりました。
今後の期待
ヒトにおいても皮膚バリア機能の破たんが、一部のアトピー性皮膚炎の原因であると考えられています。しかし同じ変異を持ち、同じ環境に住んでいながら発症する人と発症しないヒトが存在します。その違いが皮膚の問題なのか、免疫の問題なのか、遺伝的問題なのか、環境の問題なのか、複数の要因が考えられますが、ヒトではそれを調べることは困難です。特に、発症前の未病[10]の状態のヒトの皮膚の状態を継続的に研究することはほぼ不可能です。
今回報告したSpadeマウスでは、JAK1の活性型変異という遺伝素因を基にアトピー性皮膚炎を発症するまでに生後8週間を要し、ワセリン塗布などの環境変化によってその発症が予防できるというユニークな表現型を呈します。つまりこのマウスを用いて研究することで、遺伝的な発症素因を持つ個体が未病の状態のときに何が起こっているのかを観察することが可能になります。これにより、アトピー性皮膚炎発症に関わる複数の要因を分子レベル、細胞レベルで明らかにし、それぞれのターゲットを決めた発症予防法や治療法を確立することができると考えられます。
また、このSpadeモデルマウスではアトピー性皮膚炎発症の数週間後からIgEやヒスタミンなど、アレルギー疾患患者で血中レベルが増加する物質の血中レベルも増えており、アトピー性皮膚炎発症を契機として段階的にさまざまなアレルギー性疾患が発症する、“アトピックマーチ(1つのアレルギー疾患を契機に誘導される一連のアレルギー疾患群)”の研究につなげることが期待できます。
原論文情報
- Takuwa Yasuda, Toshiyuki Fukada, Keigo Nishida, Manabu Nakayama, Masashi Matsuda, Ikuo Miura, Teruki Dainichi, Shinji Fukuda, Kenji Kabashima, Shinji Nakaoka, Bum-Ho Bin, Masato Kubo, Hiroshi Ohno, Takanori Hasegawa, Osamu Ohara, Haruhiko Koseki, Shigeharu Wakana, and Hisahiro Yoshida, "Hyperactivation of JAK1 tyrosine kinase induces stepwise progressive pruritic dermatitis", Journal of Clinical Investigation
発表者
理化学研究所
統合生命医科学研究センター 疾患遺伝研究チーム
チームリーダー(研究当時) 吉田 尚弘 (よしだ ひさひろ)
(免疫器官形成研究グループ 研究嘱託・医師)
研究員(研究当時) 安田 琢和 (やすだ たくわ)
(免疫器官形成研究グループ 研究員)
 吉田 尚弘
吉田 尚弘
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.サイトカイン、サイトカイン受容体
サイトカインとはさまざまな細胞が分泌する液性因子であり、ほかの細胞に働きかけて細胞の増殖や分化に関わる。働きかけられる細胞に発現している鍵穴と呼べる構造がサイトカイン受容体であり、特定の受容体は特定のサイトカインとしか結合しない。 - 2.点突然変異
化学物質などを使って、ゲノム遺伝子上に誘発するランダムな1塩基の変異。 - 3.皮膚バリア
皮膚の表面を覆っている表皮細胞とその細胞核が抜けて変化した角質とで構成される、体の表面のバリアのことを指す。皮膚からの水分蒸発を適正に保ち、外敵の侵入を防ぐが、動きを妨げない柔軟性も兼ね備えている。さまざまな分子の複合であり、常に生まれ変わりをして恒常性が保たれている。 - 4.免疫グロブリンE(IgE)
アレルギー性疾患の原因となっている抗体。極めて低濃度で血中に存在するが、アトピー性疾患や寄生虫感染で増加する。 - 5.エチルニトロソウレア
分裂中の細胞に投与することでゲノムの遺伝子配列に点変異をランダムに引き起こすことが知られている化学変異原。この研究では1ゲノムあたりに3,000か所の点突然変異が引き起こされる推定量を投与した。 - 6.ヒスタミン
体内で過剰に遊離するとアレルギーを引き起こす物質。市販の抗アレルギー薬の一部は、この物質を標的にしたものである。 - 7.信号伝達分子
主に細胞内で信号を伝える分子で、例えば、あるサイトカインが対応するサイトカイン受容体に結合した場合に、その組み合わせに応じた信号伝達経路が活性化する。そのときにその信号を伝える役割をする。1つの信号伝達分子が複数の信号伝達経路でしばしば共有される。 - 8.骨髄移植実験
科学研究に用いるマウスは遺伝的に均一であるものが多く、そのようなマウスでは臓器移植を行っても拒絶反応が生じない。この特性を活かして、骨髄を入れ換える研究を行うことができる。病気の原因が骨髄細胞、つまり血液系の細胞にある場合には、骨髄を移植するだけで健康なマウスに病気を発症させることができる。逆に、病気になる遺伝子変異を持つマウスの骨髄を健康なマウスの骨髄と入れ替えても発症した場合、その原因は骨髄細胞以外の組織での遺伝子変異にあることが分かる。 - 9.セリンプロテアーゼ
体内のさまざまな組織でさまざまな細胞が発現しているセリン残基を持つ酵素であり、特定のタンパク配列を認識して切断する。組織の恒常性の維持や炎症の制御のために、発現量は適正な範囲に保たれている必要がある。 - 10.未病
病気を発症する遺伝的素因を持っている、あるいは生活習慣などの環境変化により病気を発症する原因となる変化が体内に蓄積しつつあるけれども、まだ病気が発症していない状態。
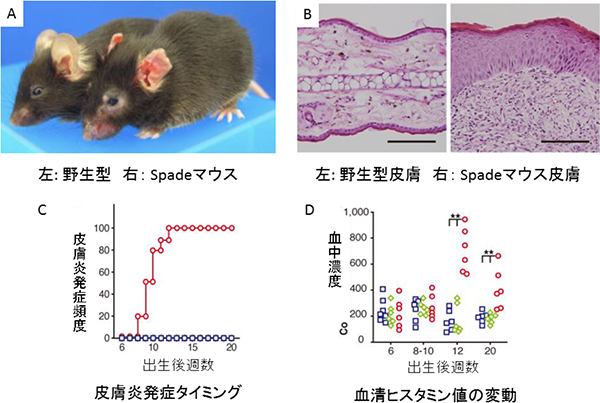
図1 新たに作製したアトピー性皮膚炎モデルマウス(Spadeマウス)
- A.野生型マウスとSpadeマウスの外見。
- B.アトピー性皮膚組織の顕微鏡画像。左の野生型に比べて、右のSpadeマウスでは、表皮の肥厚と真皮への炎症細胞浸潤が起こっている。各スケールバーは100マイクロメートル(μm、1μmは100万分の1メートル)。
- C.アトピー性皮膚炎発症タイミングを示したグラフ。青い丸は野生型、赤い丸がSpadeマウス(ホモ型)を示す。Spadeマウスでは、多段階的にアトピー性皮膚炎が進行していることが分かる。
- D.血中ヒスタミン値の変動を示したグラフ。青い丸は野生型、緑色の丸はヘテロ型、赤い丸がSpadeマウス(ホモ型)を示す。Cと同様に、血清ヒスタミン値が段階的に上昇している。つまり、Spadeマウスでは、多段階的にアトピー性皮膚炎が進行していることが分かる。
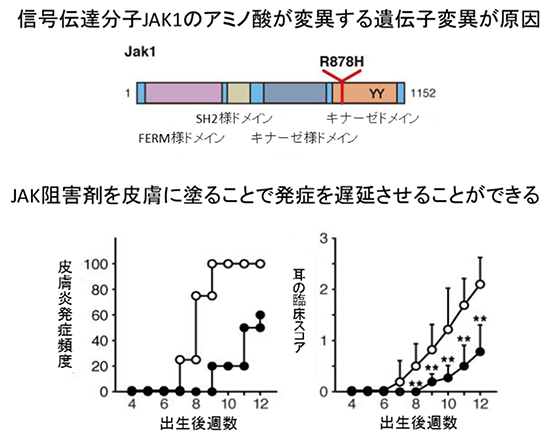
図2 SpadeマウスにおけるJAK1分子の突然変異とJAK阻害剤での治療
上図:JAK1分子のアミノ酸1つの変化により、JAK1を介した信号伝達が活性化される。このアミノ酸変異は、信号伝達に重要なキナーゼドメインのATP(アデノシン三リン酸)結合領域のそばで、アルギニン(R)がヒスチジン(H)に変異したもの(R878H)であり、キナーゼ活性に影響を及ぼすことが推測できる。
下図:JAK阻害剤を塗った場合のアトピー性皮膚炎の発症頻度(左)と、耳の臨床スコア(右)のグラフ。耳の臨床スコアとは、耳の皮膚炎の臨床症状を掻破行動および外見でスコアリングしたもので、Spadeマウスの皮膚炎進行度を点数化したものである。○が無処置群、●はJAK阻害剤塗布群を表している。JAK阻害剤を塗ると、発症を遅らせることができることが分かる。
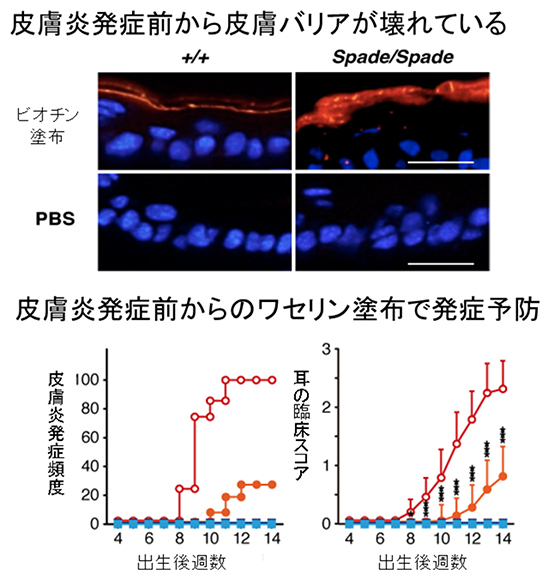
図3 Spadeマウスにおける皮膚バリア異常とワセリンでの発症予防
上図:皮膚にビオチン(ビタミンB群)を塗った直後の浸透性をみると、野生型マウス(左)では角質表面にビオチン(赤い色)がとどまるのに対し、Sapdeマウス(右)では角質の中に浸透してしまう。つまり、バリア機能が低下する。青い色は真皮細胞。PBSはリン酸緩衝生理食塩水で、皮膚に何も塗らなかった場合を示す。スケールバーは20μm。
下図:発症前からのワセリンを隔日塗布した場合のアトピー性皮膚炎の発症頻度(左)と、耳の臨床スコア(右)のグラフ。赤色の○が無処置群、オレンジ色の●がワセリン塗布群を示す。図2の場合と同様に、ワセリンを塗ることで発症を予防できることが分かる。
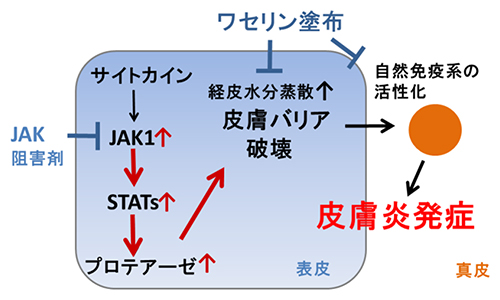
図4 Spadeマウスのアトピー性皮膚炎発症メカニズム
表皮の中で通常は、JAKとSTATの信号伝達分子がプロテアーゼ発現を適正に保つことで、皮膚バリアの恒常性を維持している。ところが、JAK1シグナルが強く入ることで皮膚バリアが破壊され、真皮の自然免疫系の活性化も招いてアトピー性皮膚炎発症に至る。しかし、それぞれJAK阻害剤やワセリンを塗ることで発症を予防できる。
