要旨
理化学研究所(理研)生命システム研究センター集積バイオデバイス研究ユニットの船野俊一特別研究員、田中信行研究員、田中陽ユニットリーダーの研究チームは、細胞の簡単な区画培養方法を開発しました。
生命科学分野において細胞培養は基本的な実験の一つです。培養されている細胞にさまざまな刺激を与えて、その細胞がどのように反応・変化するかなどを研究します。細胞の振る舞いや連携を研究する際、細胞をある区画内にとどめて培養する場合があります。この際に重要なことは、区画内では細胞が定着し、区画外では細胞が定着しないことです。従来の方法では、細胞は培養当初は区画内にとどまりますが、10日もすれば細胞が区画外にはみ出してしまうことがありました。この理由は、区画内へ細胞定着試薬[1]、区画外へ細胞定着防止試薬[2]をそれぞれ単にコーティングしているだけだからです。そのため、それぞれの試薬は培養容器から剥がれやすく、特に細胞定着防止試薬の剥がれが細胞の区画外へのはみ出し要因になっていました。
今回、研究チームは、培養区画をより長期安定に保つ方法として、区画外領域への細胞定着を防ぐ細胞定着防止試薬として撥水性試薬[3]を使用し、これを“培養容器に結合する”ことを考えました。撥水処理区画と非処理区画の区分には、印章のような凹凸構造をしたカバーを作製し、その凸構造と培養容器の表面が密着した部分には撥水性試薬が到達せず、凹構造の部分に撥水性試薬が結合するようにしました。その培養容器に筋芽細胞を含む培養液を流し込み、細胞の定着具合を観察したところ、培養区画に応じた区分が観察され、その区分が1カ月以上の間、維持されることを確認しました。そして筋芽細胞は、複数の細胞が融合し、細く長く筋繊維のような組織になることも分かりました。
本方法は、一般的な生命科学分野の研究室内にある機器を用いれば実現できるため、今後生命科学分野における細胞の区画培養で広く利用されることが期待できます。
本研究は、内閣府革新的研究開発推進プログラム(ImPACT)(合田圭介PM)の助成によるものです。
本成果は、英国の科学雑誌『RSC Advances』オンライン版(10月11日付け)に掲載されます。
背景
生命科学分野において細胞培養は基本的な実験の一つです。培養されている細胞にさまざまな刺激を与えて、その細胞がどのように反応・変化するかなどを研究します。一方、細胞の振る舞いや連携を研究する際、細胞をある区画内にとどめて培養する場合があります。この際に重要なことは、区画内では細胞が定着し、区画外では細胞が定着しないことです。しかし細胞を培養すると、通常は培養容器一面に細胞が広がります。これは、パンにカビが生える様子と同じで、最初は一部分に見えたカビも数日後には全面に広がります。
従来の細胞の区画内培養を行う方法では、細胞は培養当初は区画内にとどまりますが、10日もすれば区画外にはみ出してしまうことがありました。この理由は、区画内へ細胞定着試薬、区画外へ細胞定着防止試薬がそれぞれ単にコーティングされているだけだからです。そのため、試薬は培養容器から剥がれやすく、特に細胞定着防止試薬の剥がれが細胞の区画外へはみ出す要因になっていました。
研究手法と成果
研究チームは培養区画をより長期安定に保つ方法として、細胞培養区画外に細胞定着防止試薬として撥水性試薬を使用し、これを“培養容器に結合する”ことにしました。“培養容器に結合する”ことで細胞定着防止試薬が培養容器へ従来の方法より強固に固定されます。そのため、長期間、細胞定着防止機能が維持され,もって長期間の区画内細胞培養が可能になると考えました。
まず、撥水処理区画と非処理区画を区分するために、印章のような凹凸構造を持つカバーを作製しました(図1)。印章の印影を写す部分に相当する凸構造と培養容器の表面が密着した部分には撥水性試薬が到達せず、その部分に撥水性試薬が結合することを防ぎます。次に、カバーを撥水処理したい培養容器の表面に密着させ、撥水性試薬とともに耐圧容器内へ入れ、容器内を真空にしました。この操作によって、撥水性試薬が気化し、カバーが密着していない部分、つまり印影でいうと朱肉が付いていない部分が撥水処理されました(図1)。
続いて、撥水処理の効果を確認するために、光る機能が付与されたタンパク質の溶液を培養容器へ流し込み、タンパク質からの光を観察しました。その結果、カバーとの非密着部分は暗く、密着部分は明るく、最小800ナノメートル(nm、1nmは10億分の1メートル)の間隔で光の明暗が観察されました(図2)。このことから、カバーの設計どおりに撥水処理ができ、撥水処理部分ではタンパク質の吸着防止ができることが確認されました。
さらに、筋肉の元となる筋芽細胞を含む培養液を培養容器へ流し込み、細胞の定着具合を観察しました。その結果、カバーとの非密着部分には細胞が定着せず、密着部分には細胞が定着しました。これによって細胞定着区画の区分が観察され、この区分は1カ月以上維持されました(図3)。このことから、撥水性試薬の培養容器への強固な固定によって、長期安定な区画内細胞培養が実現されました。また、長期間培養の結果、筋芽細胞は複数の細胞が融合し、細く長い筋繊維のような組織になることも分かりました。
今後の期待
本成果の利点は、一般的な生命科学分野の研究室において特別な機器を用いることなく細胞の区画培養が実現できることです。今後、例えば幹細胞の研究分野において細胞の相互作用に基づく分化の研究、再生医療の研究において細胞の整列状態での培養などへ応用されると考えられます。
原論文情報
- Shunichi Funano, Nobuyuki Tanaka, Yo Tanaka, "Vapor-based micro/nano-partitioning of fluoro functional group immobilization for long-term stable cell patterning", RSC Advances, doi: 10.1039/c6ra16906f
発表者
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ 集積バイオデバイス研究ユニット
特別研究員 船野 俊一(ふなの しゅんいち)
研究員 田中 信行(たなか のぶゆき)
ユニットリーダー 田中 陽(たなか よう)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.細胞定着試薬
細胞が培養容器に定着するために必要な足場となるコラーゲンやフィブロネクチンなどのタンパク質。 - 2.細胞定着防止試薬
細胞定着の足場となる培養液中に含まれるタンパク質が付着することを防ぐ試薬。 - 3.撥水性試薬
ここではフッ素系試薬を指す。身の回りでは撥水スプレーが同様の効果を持つ。
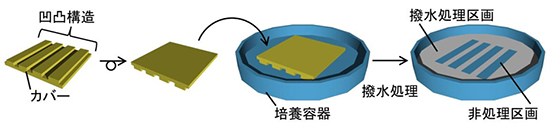
図1 カバーの外観と撥水処理の流れ
凹凸構造を持つカバーを作製し、その凹凸面を培養容器に密着させ、撥水性試薬で処理をした。カバーと培養容器が密着していない部分に撥水性試薬が流れ込み、その部分が撥水処理される。

図2 カバーの凹凸構造と光るタンパク質の写真
右側は、カバーで撥水処理をした培養容器に光るタンパク質を流した後の写真。左側のカバーの凹凸構造に応じた光の明暗が観察された。光っている部分が細胞培養区画内に相当する。
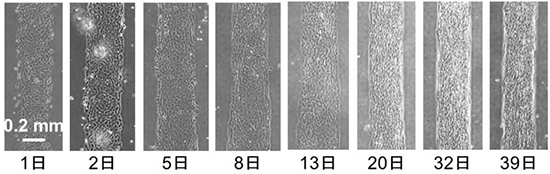
図3 筋芽細胞の区画内培養の写真
1カ月以上の間、筋芽細胞は区画内にとどまり、複数の細胞が融合し細く長い筋繊維のような組織になった。写真下の日数は培養日数を示す。
