要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、ケンワード・ヴォン特別研究員らの共同研究チーム※は、プロパルギルオキシ基[1]を持つ電気的中性のエステル(プロパギルエステル[1])と疎水性の1級アミン(RNH2)[2]を混ぜ合わせると、水中または有機溶媒中で、触媒を用いずに室温で「アミド結合(-NHCO-)」が形成されることを発見しました。
ペプチドやタンパク質を構成するアミノ酸をつないでいるアミド結合は、薬剤や高分子などのさまざまな有機分子に欠かせない基本的な構造です。多くの場合、まず縮合剤などを用いて、ハロゲン原子[3]や電子不足状態のアルコキシ基[4]を結合させることで、カルボン酸を酸ハロゲン化物や活性化されたエステルに変換し、続いて1級アミンと反応させることでアミド結合は形成されます。最近では、活性化されていない電子的中性[5]のエステルに特殊な酸または塩基触媒を用いることでアミド結合の形成が可能になりましたが、一般的には電子的中性のエステルとアミンを室温で混ぜても、全く反応しない、アミド結合を形成することはできないと考えられていました。
今回、共同研究チームは、水中または有機溶媒中で、触媒を用いずに室温でアミド結合を形成する反応(アミド化反応)が起こることを発見しました。ただし、①基質のエステルに三重結合を持つプロパルギルオキシ基があること、②エステルのα位にアミノカルボニル基があること、③反応させる1級アミンには直鎖で疎水性の置換基があること、の3条件が揃った場合にのみ効率的に反応が進行しました。また、計算化学の手法によって、この反応が起こるメカニズムを突き止めました。さらに、ペプチドの末端を選択的にアミド化反応で修飾することや蛍光標識することにも成功しました。
本成果は、ペプチド合成やペプチドの選択的な修飾だけでなく、分子同士を選択的につなぐ新しい方法としての利用が期待できます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。
成果は、ドイツの科学雑誌『Chemistry - A European Journal』のオンライン版(10月12日付け)に掲載されました。
※共同研究チーム
理化学研究所 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 ケンワード・ヴォン(Kenward Vong)
北海道大学大学院 理学研究院
准教授 前田 理(まえだ さとし)
背景
「アミド結合(-NHCO-)」は、ペプチドやタンパク質などの生体分子を構成するアミノ酸をつないでいる構造です。薬剤、高分子、材料分子など、さまざまな分子の構造に含まれており、有機分子を形成する上で非常に重要な結合の一つです。研究室レベルから工業レベルに至るまで、さまざまなアミド結合を形成する反応(アミド化反応)が使われています。
多くの場合、まず縮合剤などを用いてハロゲン原子や電子不足状態のアルコキシ基(-OR)などのよい脱離基を結合させることで、カルボン酸を酸ハロゲン化物や活性化されたエステルに変換し、続いて1級アミン(RNH2)と反応させることでアミド結合は形成されます(図1A)。最近では、活性化されていない電子的中性のエステルの場合でも、特殊な酸(ルイス酸[6])、または塩基触媒を用いれば1段階でアミド結合の形成が可能になりました(図1B)。
しかし、一般的には電子的中性のエステルと1級アミンを室温で混ぜると、全く反応しないか、あるいは反応系内に存在する微量の水でエステルの加水分解が起こるだけで、アミド結合を形成することはできないと考えられていました(図1C)。
研究手法と成果
今回、共同研究チームは、アルコキシ基を持つ電気的中性のエステルのうち、プロパルギルオキシ基を持つエステル(プロパルギルエステル)を基質として使った場合にのみ、1級アミンと混ぜ合わせると、触媒を用いずに室温でアミド結合が形成されることを発見しました(図2)。この反応では有機溶媒中だけでなく“水中”でもエステルが加水分解されることなく、80~90%の高収率でアミド結合が形成されます。
一方、電子不足状態の程度を示す酸解離定数pKa[7](値が小さいほど脱離基として反応しやすい)がプロパルギルエステル(pKa=13.6)に近い値を持つ、他の中性のエステルで反応を行ったところ、アミド結合は形成されないことが分かりました。
そこで数10種類の電子的中性のエステルと1級アミンを用いて、このアミド化反応を詳細に検討したところ、次の三つの条件を満たした場合に限り、反応が効率的に進むことが分かりました(図2)。
(1)反応基質のエステルに結合しているアルコキシ基は、三重結合を持つプロパルギルオキシ基であること。
(2)エステルのα位に、アミノカルボニル基を持つこと。
(3)反応させる1級アミンは、直鎖で疎水性の置換基を持つこと。
さらに、今回発見したアミド化反応に、一般的なアミド化反応促進剤である塩基触媒を用いると、逆に反応が阻害されることが分かりました。
以上の実験結果をもとに、なぜアミド化反応が起こるのかを計算化学の手法を用いて調べました。その結果、2分子の直鎖疎水性の1級アミンが疎水性相互作用によって近づくとともに、反応基質のエステルと複数の水素結合を作ることが分かりました。これによって、1級アミンによるエステルのカルボニル基への求核置換反応[8]を活性化していることが分かりました(図3)。
次に、ペプチドの末端にプロパルギルオキシ基を持つさまざまなエステルに対して1級アミンを水中・室温で反応させました。その結果、リジンの側鎖のアミノ基、スレオニンやチロシンの水酸基、グルタミンのアミノカルボニル基など、ペプチドに含まれるさまざまなアミノ酸の置換基に邪魔されることなく、アミド化反応によりペプチドの末端を選択的に高収率で修飾することに成功しました(図4)。
また、複数個のカルボキシル基(-COOH)を持つペプチドにおいて、従来法ではそれぞれのカルボキシル基を区別してアミド化することは困難でした。しかし、今回発見したアミド化反応を用いることで、末端のカルボキシル基に蛍光基を選択的に高収率で標識することができました(図5)。
今後の期待
本研究のアミド化反応は、ペプチドのアミノ酸主鎖のカルボン酸を選択的にアミド結合に変換できることから、ペプチドの合成や修飾だけでなく、分子を選択的につなぐ新しい方法としての利用が期待できます。
アミド化反応はこれまでに膨大な種類が報告されていますが、本反応は、これまで考えられていなかった反応です。基本的な有機反応であっても、未だに知られていない方法が残されていることを示しています。
原論文情報
- Kenward Vong, Satoshi Maeda, Katsunori Tanaka, "Propargyl-assisted selective amidation applied in C-terminal glycine peptide conjugation", Chemistry - A European Journal, doi: 10.1002/chem.201604247
発表者
理化学研究所
准主任研究員研究室 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 ケンワード・ヴォン(Kenward Vong)
 左から田中准主任研究員、ヴォン特別研究員
左から田中准主任研究員、ヴォン特別研究員
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.プロパルギルオキシ基、プロパルギルエステル
プロパルギルオキシ基は、-O-C2H2C≡CHで表される三重結合を持つアルコキシ基。プロパルギルエステルは、カルボン酸(R-CO-OH)のOHがプロパルギルオキシ基で置換されたR-CO-O-C2H2C≡CHの構造式で表されるエステル。 - 2.1級アミン(NH2R)
アミンは窒素原子(N)に3個の原子または置換基が結合した化合物(NR3)のことで、そのうち、Nに水素原子(H)が2個、アルキル基(R)が1個結合したものを1級アミン(NH2R)と呼ぶ。 - 3.ハロゲン原子
第17族のフッ素(F)、塩素(Cl)、臭素(Br)、ヨウ素(I)のこと。カルボン酸のハロゲン化物(R-CO-X、X=ハロゲン原子)中のハロゲン原子はアミド化反応で脱離基として効率的に働く。 - 4.アルコキシ基
アルコキシ基はアルキル基に酸素原子が結合した-ORで表される官能基。エステル(R-CO-OR)に含まれる構造で、アミド化反応の際に脱離する。 - 5.電子的中性
有機化合物の分子内で、電子的に過剰状態にも不足状態にもなっていない状態のこと。 - 6.ルイス酸
電子対を受け取る物質のこと。外殻が閉殻構造をとるのに少なくとも2電子不足している化学種のことで、電子を受け取ることで安定構造となる。 - 7.酸解離定数pKa
酸の強さを定量的に示す指標の一つ。酸から水素イオンが放出される解離反応において、pKaが小さいほど強い酸であることを示す。本研究では電子が不足している尺度を表し、値が小さいほど脱離基として反応しやすいことを表している。 - 8.求核置換反応
反応の中心となる求電子剤に対して求核剤が求核攻撃し、脱離基が脱離する反応。本研究のアミド化反応では、求電子剤はエステルのカルボニル基(-C=O)の炭素原子(C)で、それに対して求核剤は1級アミンの窒素原子(N)である。Nの電子対がCを攻撃し、アルコキシ基が脱離することにより、アミド結合が形成される。
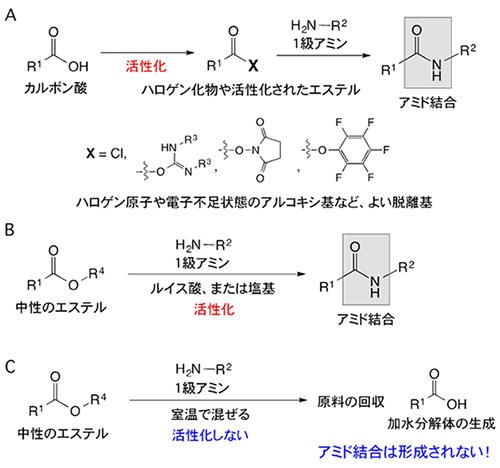
図1 アミド結合を形成する一般的なアミド化反応
A:縮合剤などを用いて、まずカルボン酸を酸ハロゲン化物や電子不足状態のアルコキシ基などのよい脱離基を持つ活性化されたエステルへ変換する。続いて、それを1級アミンと反応させることでアミド結合が形成される。カルボン酸の活性化法と呼ばれる。
B:ルイス酸または塩基触媒を用いて、電子的中性のエステルを活性化し、直接1級アミンと反応させるとアミド結合が形成される。
C:一般的には触媒を用いない限り、電子的中性のエステルと1級アミンを反応させてもアミド結合は形成されない。反応が全く進行しないか、あるいは反応系内に存在する水でエステルが加水分解されてカルボン酸が生成されるためである。
なお、図中のR1、R2、R3、R4は、アルキル基またはフェニル基を示す。
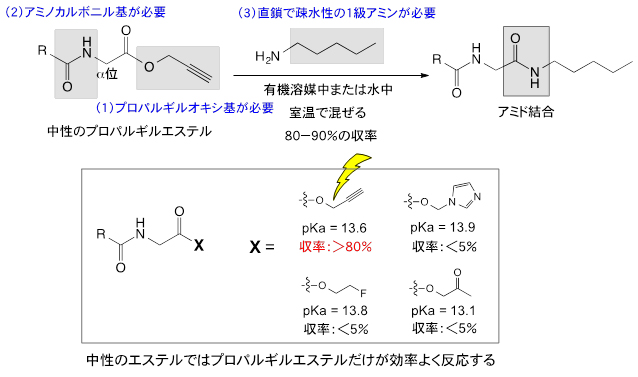
図2 プロパルギルエステルと1級アミンとの反応によるアミド結合の新しい形成反応
水中または有機溶媒中で、プロパルギルエステル(Rはアルキル基)と1級アミンを室温で混ぜ合わせるだけで、80~90%の収率でアミド結合が形成される。酸解離定数(pKa)がプロパルギルエステル(pKa=13.6)に近い値を持つ他の中性のエステルでは、アミド化反応はほとんど進行しない。
効率よく反応させるためには、(1)エステルに結合しているアルコキシ基は三重結合を持つプロパルギルオキシ基であること、(2)エステルのα位にアミノカルボニル基を持つこと、(3)直鎖で疎水性置換基を持つ1級アミンを用いること、の3条件を満たす必要がある。
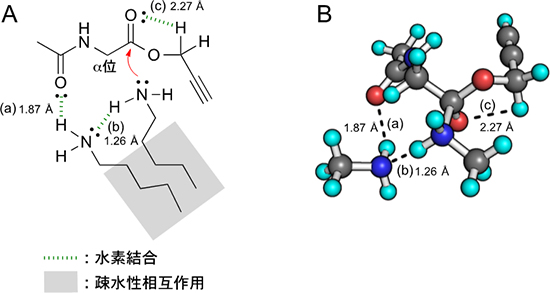
図3 計算化学によって解析した新しいアミド化反応の反応機構
A:2分子の直鎖1級アミンが疎水性相互作用によって近づくとともに、反応基質のプロパルギルエステルと複数の水素結合を作ることによって、1級アミンによるエステルカルボニル基への求核置換反応(赤い矢印)を活性化している。この際に、1級アミンとエステルのα位のアミノカルボニル基との水素結合(a)は、1級アミンとエステルを近づけている。また、1級アミン同士の水素結合(b)は2分子の1級アミンを近づけると同時に、反応に関わる1級アミンの窒素原子求核性(赤い矢印)を向上させている。さらにエステルのカルボニル基とプロパルギル基の水素結合(c)も、カルボニル基の炭素の求電子性を上げてアミド化反応を活性化させている。なお、Å(オングストローム)は長さを示す単位で100億分の1メートルである。この距離が短いほど水素結合が強いといえる。
B:アミド化反応の活性化機構(A図)について、原子を球で表現し、立体構造をより分かりやすくした分子モデル。黒玉は炭素原子、赤玉は酸素原子、青玉は窒素原子、水色玉は水素原子を示している。
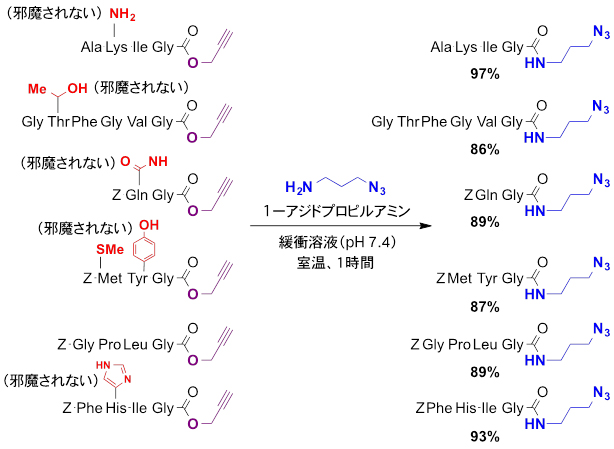
図4 新しいアミド化反応によるペプチド末端へのアミド化反応
2~6個のアミノ酸が結合したペプチドの末端に導入したプロパルギルエステルに対して、水中・室温で1級アミンである1-アジドプロピルアミン(青色)を反応させることにより、ペプチドの末端を選択的に高収率で修飾できた。この反応は、ペプチドを構成するさまざまなアミノ酸の側鎖の置換基(赤色)に邪魔されなかった。
Alaはアラニン、Lysはリジン、Ileはイソロイシン、Glyはグリシン、Thrはスレオニン、Pheはフェニルアラニン、Valはバリン、Glnはグルタミン、Metはメチオニン、Tyrはチロシン、Proはプロリン、Leuはロイシン、Hisはヒスチジン、Zはベンジルオキシカルボニル基(アミノ酸の保護基)を示す。
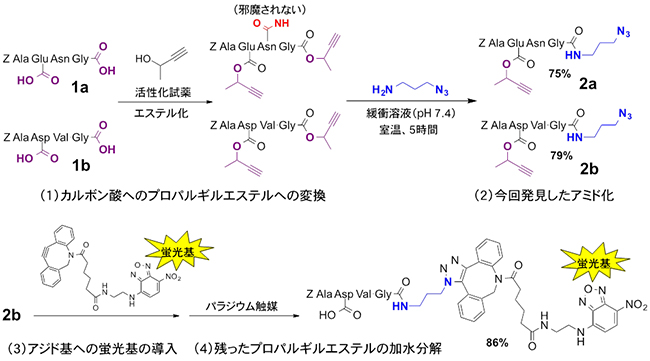
図5 新しいアミド化反応によるペプチド末端への選択的な蛍光標識
4個のアミノ酸が結合したペプチド1aや1bには、同じ反応性を持つ2個のカルボキシル基が含まれるが、従来法ではそれらを区別してアミド化することは難しかった。次の手順で末端のカルボン酸に選択的に蛍光基を導入できた。(1)ペプチド中の全てのカルボキシル基をプロパルギルエステルに変換した後、(2)今回発見した反応により末端のプロパルギルエステルのみをアミド化、(3)クリック反応によるアジド基への選択的な蛍光基の導入、(4)パラジウム触媒を用いて残ったアミノ酸側鎖のプロパルギルエステルを加水分解する。
Alaはアラニン、Gluはグルタミン酸、Glyはグリシン、Asnはアスパラギン、Aspはアスパラギン酸、Valはバリン、Zはベンジルオキシカルボニル基(アミノ酸の保護基)を示す。
