要旨
理化学研究所(理研)脳科学総合研究センター発生神経生物研究チームの御子柴克彦チームリーダー、菅原健之研究員、久恒智博研究員らの研究チーム※は、運動をつかさどる小脳内の神経回路を正しく維持するために必要な分子メカニズムを発見しました。
私たちの脳では、数千億個の神経細胞がシナプス[1]を介して互いに結合し、神経回路を形成しています。神経細胞の樹状突起には、「スパイン[2]」と呼ばれる小さな突起が無数にあり、ここに他の神経細胞との連絡場所であるシナプスが形成されます。スパインは生後の発達過程で活発に形成され、成熟後の神経細胞では比較的安定に存在して、機能的な神経回路を維持しています。しかし、成熟後の神経細胞のスパインがどのようにして制御されるのか、そのメカニズムについては未だ多くの謎が残されています。
研究チームは、「カルシウム/カルモジュリン依存性タンパク質キナーゼβサブユニット(CaMKIIβ)[3]」が、運動の学習・記憶を担う小脳[4]の神経細胞の一つであるプルキンエ細胞[5]におけるスパインの形成と伸長を促すことを発見しました。また、このCaMKIIβのスパインに対する効果は、タンパク質リン酸化酵素の一つであるプロテインキナーゼC(PKC)[6]によるCaMKIIβの「リン酸化[7]」により制御されていることが分かりました。さらに、このPKCによるCaMKIIβのリン酸化反応が障害されると、成熟したプルキンエ細胞に過剰なスパインの形成と伸長が生じることを明らかにしました。これらの結果は、PKCによるCaMKIIβのリン酸化反応により、プルキンエ細胞のスパインの形態が制御されており、これが成熟後の小脳神経回路を正常に維持するのに極めて重要な役割を果たしていることを示しています。
自閉症をはじめとする種々の精神・神経疾患において、スパインの密度や形態に異常が生じることが近年知られるようになり、正しく神経回路を形成・維持できなくなることが疾患の発症に関わっていると考えられています。本研究の成果は、高次脳機能を支える構造的基盤であるスパインを制御する仕組みについて新たな知見をもたらすものであり、精神・神経疾患の原因解明や治療法の確立につながると期待できます。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Science of the United States of America(PNAS)』のオンライン版へ6月12日の週に掲載されます。
※研究チーム
理化学研究所 脳科学総合研究センター
発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
研究員 菅原 健之(すがわら たけゆき)
研究員 久恒 智博(ひさつね ちひろ)
テクニカルスタッフⅠ 小川 直子(おがわ なおこ)
神経遺伝研究チーム
研究員 宮本 浩行(みやもと ひろゆき)
背景
私たちの脳では、数千億個の神経細胞がシナプスを介して互いに結合し、神経回路を形成しています。神経細胞の樹状突起には、「スパイン」と呼ばれる小さな突起が無数にあり、ここにシナプスが形成されます(図1)。スパインはシナプスの後部構造であり、グルタミン酸などの神経伝達物質に対する受容体を介して他の神経細胞から情報を受け取る部位で、学習や記憶、運動のコントロールなどの高次脳機能にとって非常に重要な役割を果たしています。
スパインは生後の発達過程で活発に形成され、成熟後の神経細胞では比較的安定に存在し、機能的な神経回路を維持しています。また近年、自閉症や精神発達障害、統合失調症などの種々の精神・神経疾患ではスパインの形や数に異常が生じることが報告されており、疾患の病態とスパインとの関連が注目されています。
小脳は歩行などの運動や平衡感覚をつかさどる部位で、小脳に異常があるとスムーズな動作ができなくなり、歩行障害などを引き起こすことが知られています。また、小脳は自転車の乗り方やピアノの弾き方を覚えるといった運動の学習・記憶にも関わっています。小脳の主要な神経細胞の一つであるプルキンエ細胞のスパインは、顆粒細胞[8]の軸索である平行線維とシナプスを形成しており、このシナプスで起こる神経可塑性[9]は運動の学習・記憶のメカニズムであると考えられています(図2)。そのため、プルキンエ細胞のスパインの数や形がどのように制御されているのかを知ることは、高次脳機能のメカニズムや精神・神経疾患の病態の解明において重要な課題となっていますが、そのほとんどが未解明のままでした。
研究手法と成果
スパインの形態は、主としてアクチン細胞骨格[10]により制御されています。スパイン内にはさまざまなアクチン結合タンパク質が存在しており、アクチンの動態を変化させています。研究チームは、アクチンに結合するタンパク質の一つである「カルシウム/カルモジュリン依存性タンパク質キナーゼβサブユニット(CaMKIIβ)」に着目しました。CaMKIIβは、アクチン細胞骨格を安定化させることで、海馬の神経細胞のスパインの安定性を制御することが報告されています。しかし、小脳プルキンエ細胞のスパインの制御にどのような役割を果たしているのかは明らかにされていませんでした。
まず、CaMKIIβをプルキンエ細胞に過剰に発現させ、スパインの形態にどのような影響を及ぼすのかを調べたところ、スパインが過剰に増え、また異常に長くなることを発見しました。これにより、CaMKIIβはプルキンエ細胞のスパインの形成と伸長を促進する機能があることが示されました。
次に、このCaMKIIβのスパイン形態に対する機能がプルキンエ細胞内でどのように制御されているのかを調べました。タンパク質の機能を調節する生体内の重要な修飾反応として、「リン酸化」と呼ばれる化学修飾があります。プルキンエ細胞内でCaMKIIβがどのようにリン酸化されているのかを調べた結果、CaMKIIβタンパク質の315番目のセリン残基(Ser315)がリン酸化されていることが分かりました。このSer315は、CaMKIIβがアクチン細胞骨格と結合するために不可欠な領域のすぐ近くに位置しているため、Ser315のリン酸化がアクチン細胞骨格との相互作用に及ぼす影響も調べました。その結果、Ser315がリン酸化されたCaMKIIβはアクチン細胞骨格に結合しにくくなり、これを安定化させる効果が弱いことが分かりました。また、このCaMKIIβのSer315のリン酸化がプルキンエ細胞のスパインの数や形に及ぼす影響を調べました。すると、リン酸化部位であるSer315をリン酸化されないように変異させた非リン酸化型CaMKIIβがプルキンエ細胞のスパインの過剰な形成や伸長を促進させたのに対し、Ser315がリン酸化された状態に変異させたリン酸化型CaMKIIβではこの効果は観察されませんでした(図3)。これらの結果は、CaMKIIβのSer315のリン酸化状態がプルキンエ細胞のスパインの数や形を制御するのに重要な因子であることを示しています。
さらに、スパインの制御に関わるCaMKIIβのSer315のリン酸化がプルキンエ細胞内でどのように調節されているのかを、マウスの小脳から作製した培養神経細胞や脳切片を用いて調べました。興奮性シナプスの神経伝達物質であるグルタミン酸でプルキンエ細胞を刺激したところ、CaMKIIβのSer315のリン酸化が著しく亢進したことから、CaMKIIβのSer315のリン酸化状態は神経活動に依存して調節されていることが分かりました。そして、その詳細な細胞内シグナル経路として、神経活動に応じた代謝型グルタミン酸受容体(mGluR)[11]の活性化により起こる、タイプ1型イノシトール3リン酸受容体(IP3R1)[12]を介した小胞体からのカルシウムイオン(Ca2+)放出が必要であることを明らかにしました。さらに、このCa2+放出により活性化されたプロテインキナーゼC(PKC)というタンパク質リン酸化酵素がCaMKIIβのSer315をリン酸化していることが分かりました(図4)。対照的に、イオンチャネル型グルタミン酸受容体の一つであるAMPA型受容体[13]の活性化に続く細胞外からのCa2+流入は、PKCを活性化せず、CaMKIIβのリン酸化を引き起こしませんでした。
研究チームは以前に、成熟後の小脳でIP3R1が働かないとプルキンエ細胞のスパインが異常に増え、またスパインの形が長くなることを報告しています注1)。研究チームはこの現象に、IP3R1からのCa2+放出によるPKCの活性化が起こらず、その結果非リン酸化型CaMKIIβが増えてアクチン細胞骨格の安定化が過剰になることが関わっているのではないかと考えました。そこで、CaMKIIβとアクチン細胞骨格の結合を阻害する薬物を投与し、IP3R1欠損マウスのプルキンエ細胞でみられたスパイン形態の異常が回復するかどうかを調べました。その結果、CaMKIIβによるアクチン細胞骨格の安定化を阻害することにより、IP3R1欠損マウスのプルキンエ細胞のスパイン形態の異常が正常に回復することが分かりました。
これらの結果から研究チームは、「神経活動依存的なPKCによるCaMKIIβのリン酸化は、プルキンエ細胞のスパインが過剰に発達するのを抑制しており、この機構が小脳の神経回路を正しく維持することに極めて重要な役割を果たしている」という新たなモデルを提唱しました(図5)。
注1)2013年8月1日プレスリリース「マウスの成熟脳で神経回路を制御する新たな仕組みを解明」
今後の期待
研究チームは、小脳の神経回路を正しく維持する機構として、神経活動依存的なPKCの働きによるCaMKIIβのリン酸化が、プルキンエ細胞の正常なスパイン形成と維持に関わるという新たな分子メカニズムを示しました。
近年、自閉症や統合失調症など多くの精神・神経疾患において、神経細胞のスパイン形態異常が報告されており、スパイン形態と疾患発症との関連が注目されています。そのため、本研究による成果は、高次脳機能を支える構造的基盤であるスパインを制御する仕組みとこれら精神・神経疾患の病態の関連を理解する上で重要な発見です。今後、疾患の原因解明や治療法の確立につながると期待できます。
原論文情報
- Takeyuki Sugawara, Chihiro Hisatsune, Hiroyuki Miyamoto, Naoko Ogawa, Katsuhiko Mikoshiba, "Regulation of spinogenesis in mature Purkinje cells via mGluR/PKC-mediated phosphorylation of CaMKIIβ", Proceedings of the National Academy of Science of the United States of America
発表者
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
研究員 菅原 健之(すがわら たけゆき)
研究員 久恒 智博(ひさつね ちひろ)
 左より、御子柴克彦、菅原健之、久恒智博
左より、御子柴克彦、菅原健之、久恒智博
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.シナプス
神経細胞と神経細胞のつなぎ目であり連絡場所。シナプスを介して形成された神経細胞のネットワークが神経回路である。シナプスでは、シナプス前部である神経細胞の軸索終末からグルタミン酸などの神経伝達物質が放出され、シナプス後部である神経細胞のスパインがこれを受け取ることによって情報が伝達される。 - 2.スパイン
神経細胞の樹状突起にある小さなとげ状の構造物。神経伝達物質を受け取る受容体や細胞内のシグナル伝達に関わるさまざまな分子が集積する脳機能において重要な構造。 - 3.カルシウム/カルモジュリン依存性タンパク質キナーゼβサブユニット(CaMKIIβ)
基質となるタンパク質のアミノ酸残基(セリンもしくはスレオニン)にリン酸基を付加するリン酸化酵素の一つ。CaMKIIβは、アクチン繊維と結合する領域を持ち、リン酸化酵素としてだけでなく、アクチン細胞骨格を制御するタンパク質としても働いている。 - 4.小脳
後頭部に位置する脳部位で、歩行などの運動や平衡感覚の調節を担う。スポーツの上達など運動の学習や記憶にも関わる。小脳に異常があるとスムーズな動作ができなくなり、歩行障害などを引き起こす。 - 5.プルキンエ細胞
小脳皮質に一層に並ぶ神経細胞で、小脳の中で唯一の出力細胞。よく発達した樹状突起を扇形に伸ばした特徴的な形の大型の神経細胞であり、顆粒細胞の軸索である平行線維と下オリーブ核から伸びる登上線維からの情報を受ける。軸索は白質を通って深部小脳核へ投射する。 - 6.プロテインキナーゼC(PKC)
セリン/スレオニンリン酸化酵素の一つ。PKCには複数のサブタイプがあるが、本研究では特にカルシウムにより活性化されるタイプを指す。 - 7.リン酸化反応
タンパク質を修飾する反応の一つで、タンパク質にリン酸基を付加する化学反応。タンパク質の構造を変化させるなどして、そのタンパク質の機能に影響を与える。 - 8.顆粒細胞
小脳の神経細胞の一種。その軸索は平行線維と呼ばれ、プルキンエ細胞の遠位樹状突起上のスパインと興奮性シナプスを形成する。 - 9.神経可塑性
シナプス入力の強さや頻度に応じて、シナプスでの情報伝達の効率が柔軟に変化すること。記憶や学習の基礎になると考えられている。 - 10.アクチン細胞骨格
細胞質内にあり、細胞を形作る骨組みとなる繊維状の構造の一種。アクチン分子が重合したアクチン繊維と呼ばれるもので構成されるものをいう。 - 11.代謝型グルタミン酸受容体(mGluR)
中枢神経系の主要な興奮性神経伝達物質であるグルタミン酸の受容体の一種。脳神経細胞に豊富に発現しており、mGluRの活性化はイノシトール3リン酸受容体(IP3R)からカルシウムイオンを放出するきっかけとなる。 - 12.タイプ1型イノシトール3リン酸受容体(IP3R1)
IP3Rは、細胞内のカルシウム貯蔵庫の1つである小胞体の膜上に局在するカルシウムチャネル。細胞外の刺激(神経伝達物質やホルモンなど)に応じて産生されるイノシトール三リン酸(IP3)が結合することによりチャネルが開き、小胞体内のカルシウムイオンを細胞質に放出することで、細胞内のカルシウムイオン濃度を調節する。IP3Rには三つのサブタイプがあり、特にタイプ1型が神経細胞に豊富に発現している。 - 13.AMPA型受容体
中枢神経系の主要な興奮性神経伝達物質であるグルタミン酸の受容体の一種で、イオンチャネル型の受容体。グルタミン酸が結合することで、イオンチャネルが開き、陽イオンが細胞内に流入する。これがプルキンエ細胞の脱分極を引き起こし、続いて電位依存性カルシウムチャネルを介した細胞内へのカルシウムイオンの流入が起こる。
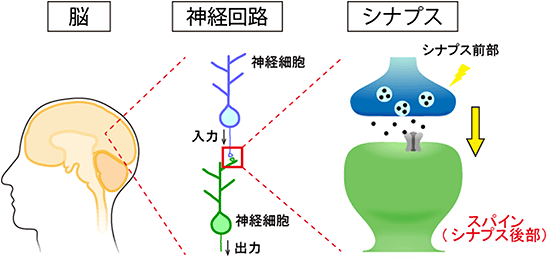
図1 神経細胞同士をつなぐシナプスの構造
神経細胞同士は、シナプスを介して結合し神経回路を形成する。神経細胞のスパインは、シナプス前部である神経軸索終末とシナプスを形成する後部構造である。スパインには、神経伝達物質を受け取る受容体やシグナル伝達物質が多く存在するため、脳機能に極めて重要な構造である。
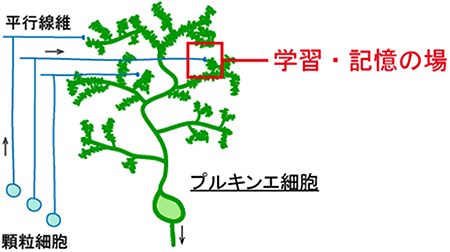
図2 運動の学習・記憶の場である小脳プルキンエ細胞のスパイン
プルキンエ細胞の遠位樹状突起上にあるスパインは、顆粒細胞の軸索である平行線維とシナプスを形成している。この平行線維-プルキンエ細胞間のシナプスで起こる神経可塑性は、小脳の機能である運動の学習・記憶のメカニズムであると考えられている。
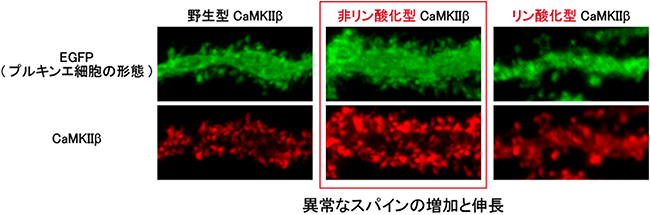
図3 非リン酸化CaMKIIβによるプルキンエ細胞のスパインの異常な増加と伸長
プルキンエ細胞に発現しているCaMKIIβを、315番目のセリン残基(Ser315)がリン酸化されない非リン酸化型CaMKIIβに変えると、スパインの異常な増加と伸長がみられた。一方で、リン酸化された状態に変異させたリン酸化型CaMKIIβに変えた場合には、そのような変化は観察されなかった。
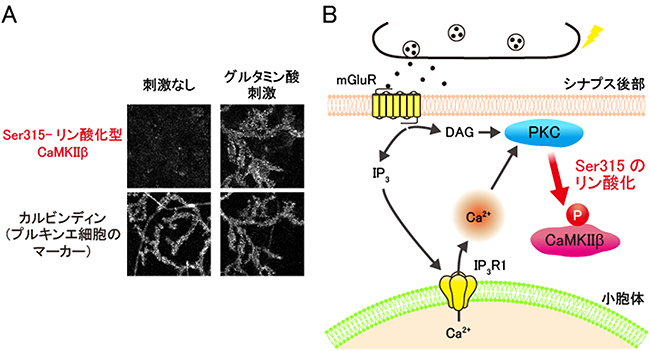
図4 プルキンエ細胞における神経活動に応じたCaMKIIβのSer315のリン酸化
A)培養プルキンエ細胞を、興奮性神経伝達物質であるグルタミン酸で刺激した後、細胞をSer315がリン酸化されたCaMKIIβだけを認識する抗体で染色した。すると、グルタミン酸刺激により、プルキンエ細胞のCaMKIIβのSer315のリン酸化が亢進することが分かった。カルビンディンはプルキンエ細胞のマーカーとなるタンパク質であり、これを染色することでプルキンエ細胞を可視化した。
B)神経活動に依存したCaMKIIβのSer315のリン酸化の細胞内シグナル経路の模式図。神経活動に応じた代謝型グルタミン酸受容体(mGluR)の活性化に次いで、タイプ1型イノシトール3リン酸受容体(IP3R1)を介した小胞体からのカルシウムイオン(Ca2+)放出が起こり、さらにこのCa2+放出により活性化されたプロテインキナーゼC(PKC)というタンパク質リン酸化酵素がCaMKIIβのSer315をリン酸化していることが明らかになった。
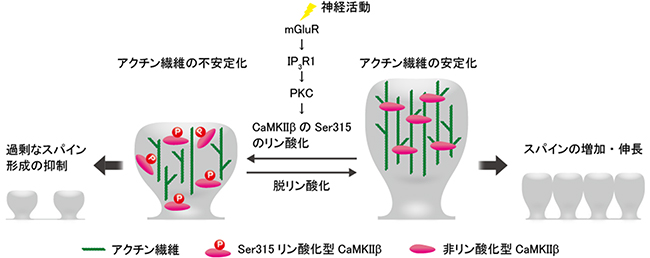
図5 小脳回路を正常に維持する分子メカニズム
研究チームは、神経活動依存的なPKCによるCaMKIIβのリン酸化は、プルキンエ細胞のスパインが過剰に発達するのを抑制しており、この機構が小脳の神経回路を正しく維持することに極めて重要な役割を果たしているという新たなモデルを提唱した。
