ポイント
要旨
理化学研究所(理研)多細胞システム形成研究センター高次構造形成研究チームの竹市雅俊チームリーダー、伊藤祥子研究員と環境資源科学研究センター創薬シード化合物探索基盤ユニットの大貫哲男副基盤ユニットリーダーらの共同研究グループ※は、大腸がん由来細胞株の細胞間接着の形成を回復させる機構を明らかにしました。
正常な上皮組織[1]の細胞には極性[2]があり、頂端部側で強固に接着して組織の安定性を維持しています。がんが進行すると極性が失われるとともに、細胞間の接着構造が乱れていきます。がん由来の細胞株では、さまざまなタイプの接着異常が観察され、このような変化は、がんの浸潤性や転移能を高める恐れがあります。しかし、この異常を元に戻す治療法は現在のところありません。
今回、共同研究グループは、正常に接着できない大腸がん由来細胞を用いて、約16万種類の化合物の中から細胞の接着を回復させる薬剤を探しました。その結果、細胞骨格の一つである微小管[3]を壊す複数の薬剤に、接着構造を回復させる作用があることを発見しました。微小管重合阻害剤などの薬剤は、微小管の脱重合を介して、RhoA[4]という細胞内シグナルタンパク質を活性化し、次いで、アクチン[5]とミオシン[6]の複合体であるアクトミオシン[7]を細胞表層で収縮させました。この収縮は、細胞と細胞の境界面に「張力」として伝わり、張力に反応して別のアクチン制御タンパク質が細胞境界面に集まり、その結果、大腸がん細胞に、正常に近い接着構造が再形成されることが明らかになりました。
今後、生体における実際のがん細胞が、同様な異常と薬剤反応性を持つかどうかを検討し、さらなる接着回復剤を探索することにより、新たながんの治療法として貢献すると期待できます。
本研究は、国際科学雑誌『Nature Communications』(11月28日付け)に掲載されました。
※共同研究グループ
理化学研究所
多細胞システム形成研究センター 高次構造形成研究チーム
チームリーダー 竹市 雅俊(たけいち まさとし)
研究員 伊藤 祥子(いとう しょうこ)
客員研究員 西村 珠子(にしむら たまこ)
立体組織形成研究チーム
研究員 奥田 覚(おくだ さとる)
環境資源科学研究センター 創薬・医療技術基盤連携部門
創薬シード化合物探索基盤ユニット
副基盤ユニットリーダー 大貫 哲男(おおぬき てつお)
テクニカルスタッフ(研究当時)安倍 昌子(あべ まさこ)
テクニカルスタッフ(研究当時)藤本 真理(ふじもと まり)
背景
多くの臓器は、「上皮細胞[1]」が強固に接着して形作られています。上皮細胞には頂端部-基底部という極性があり、その頂端部側でカドヘリン[8]とカテニン[9]などの結合分子がアクチン繊維と結びついて「接着帯[10]」を作り、これが、他の接着構造(密着結合[10]、デスモソーム[11])とともに「接着複合体」を形成します(図1)。
この構造によって、隣り合う細胞同士がシート状につながり、臓器の構造と機能が維持されます(図2上段)。
がんは日本での死因1位を維持し続けている病気です。がんになる細胞の約9割が上皮細胞に由来します。細胞ががん化し悪性化が進むと、秩序正しいシート状の構造が崩れ、浸潤・転移が起きて、しばしば治療が困難な状態に陥ります。がん化した上皮組織の構造変化には、極性が失われるなど、さまざまな要因が絡むと考えられますが、細胞の接着性の変化もその一つです。がん由来の細胞株を調べると、接着帯形成に必要な成分が減少するなどの例が観察されます。細胞間接着の異常により、細胞が遊離しやすくなるため、浸潤・転移を促進する要因の一つと推測されます。しかし、これを抑制する治療法は現在のところありません。
竹市チームリーダーらおよび他のグループによるこれまでの研究から、①大腸がん細胞株の中には、カドヘリン、カテニンを正常に持つにも関わらず、接着帯を形成できない細胞があること、②それらの細胞は特定の薬剤刺激や遺伝子の導入などによって強固な細胞間接着を回復できることが分かっていました注1,2)。しかし、その機構は明らかではありませんでした。共同研究グループはこの機構を明らかにし、細胞間接着回復法が確立されれば、新たながんの治療法として貢献できると考えました。
注1)Aono, S., Nakagawa, S., Reynolds, A.B., and Takeichi, M. p120ctn acts as an inhibitory regulator of cadherin function in colon carcinoma cells. J. Cell Biol. 145, 551-562. (1999)
注2)Keller, M.S., Ezaki, T., Guo, R.J., and Lynch, J.P. Cdx1 or Cdx2 expression activates E-cadherin-mediated cell-cell adhesion and compaction in human COLO 205 cells. Am J Physiol Gastrointest Liver Physiol. 287, G104-14. (2004)
研究手法と成果
共同研究グループはまず、大腸がん由来細胞株HT29を用い、ハイコンテントスクリーニング[12]によって、約16万種類の化合物の中から、細胞間接着を回復させる作用のある薬剤を探しました。HT29細胞は、カドヘリンなどの細胞間接着分子の発現量は十分であるにも関わらず、なぜか、接着複合体を形成することができません(図2下段)。スクリーニングの結果、124種類の化合物が、接着構造を正常に近い状態に回復させることが分かりました。それらの化合物の構造と作用機序の分析を進めたところ、細胞骨格の一つである微小管の重合を阻害する薬剤が8割を占めていました(図3、図4)。
そこで、微小管重合阻害剤がどのような機構によって、HT29細胞の接着を回復させるのかを調べました。その結果、微小管が壊れることにより、RhoAという細胞内シグナルタンパク質が活性化され、これが、細胞の頂端部側の表層においてアクトミオシン(アクチンとミオシンの複合体)を収縮させることが分かりました。アクトミオシンは、筋肉を収縮させるために必要なタンパク質ですが、筋肉以外の細胞でも働きます。微小管重合阻害剤で処理したHT29細胞の表層では、筋肉で形成される縞模様状のサルコメア[13]に似た構造が観察されました(図5)。
カドヘリンの細胞内領域に結合するα-カテニンは、アクチン繊維に連結することが知られています。表層部のアクトミオシン中のアクチンの一部は、細胞と細胞の境界面に濃縮するカドヘリン/α-カテニン複合体につながっていると予想され、アクトミオシンの収縮によって発生した力は、この複合体を引っ張ると考えられます。実際、アクチン繊維のレーザー切断実験によって、この「張力」の存在が確認されました。さらにこの張力に依存して、ビンキュリン[14]というタンパク質が細胞-細胞境界面に集まることが分かりました。集まったビンキュリンが、別のアクチン制御タンパク質を細胞境界面に集結させ、それらの働きにより、細胞間接着が回復することが明らかになりました。浸潤性のがん細胞は力学的に「やわらかい」とされていますが、接着を回復した細胞は、表層が「かたく」なっていることも分かりました。
また、HT29細胞だけでなく、他の複数の大腸がん由来細胞株が、微小管重合阻害剤に反応し、細胞間接着が改善されました。したがって、大腸がん由来細胞に関する限り、共通の機構により接着異常が起きていると推測されます。さらに重要なことは、微小管を壊さなくても、他の方法によりRhoAを活性化すれば、接着が回復することが分かりました。RhoAは正常細胞においても接着構造を維持するために重要な因子とされていますが、一群の大腸がん細胞では、何らかの異常により、接着構造形成のために過剰なRhoA活性を必要とする、と結論づけられました。
以上のことから、細胞間接着に異常がある一部のがん細胞では、微小管重合阻害剤の投与など、何らかの手法によりRhoAの活性を高めることで表層部アクトミオシンの収縮が誘発され、その結果、細胞境界部に張力が働き、これが細胞間接着の回復を引き起こす、という機構が明らかになりました(図6)。
今後の期待
細胞間接着の異常は、がん細胞の異常行動の一因と考えられます。今回の発見を指標として、接着異常を引き起こす原因を究明し、同時に、実際のがんでも細胞間接着を正常化させる方法が開発できれば、新たながんの治療法に貢献すると期待できます。
原論文情報
- Shoko Ito, Satoru Okuda, Masako Abe, Mari Fujimoto, Tetsuo Onuki, Tamako Nishimura, Masatoshi Takeichi, "Induced cortical tension restores functional junctions in adhesion-defective carcinoma cells", Nature Communications, doi: 10.1038/s41467-017-01945-y
発表者
理化学研究所
多細胞システム形成研究センター 高次構造形成研究チーム
チームリーダー 竹市 雅俊(たけいち まさとし)
研究員 伊藤 祥子(いとう しょうこ)
環境資源科学研究センター 創薬・医療技術基盤連携部門 創薬シード化合物探索基盤ユニット
副基盤ユニットリーダー 大貫 哲男(おおぬき てつお)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.上皮組織、上皮細胞
多くの臓器(大腸、胃、食道、肺、肝臓、膵臓、乳腺など)における機能的な主成分が上皮組織で、これを構成する細胞を上皮細胞と呼ぶ。隣り合う細胞同士が強固に接着して、単層または多層のシート状、管腔状の構造を形成する。 - 2.極性
上皮細胞は、体腔側に面している頂端部と、基質側に面している基底部という極性を持つ。 - 3.微小管
細胞骨格の一つ。チューブリンから構成される繊維状の構造である。重合・脱重合により変化するダイナミックな構造であるが、重合阻害剤によって重合を阻害されると、脱重合のみが促進されるため、最終的に微小管の構造は壊れる。 - 4.RhoA
Rhoファミリータンパク質の一つ。Rhoファミリータンパク質は細胞骨格などのダイナミックな変化を制御する分子スイッチとして機能する。RhoAは主にアクチン骨格系の変化を制御する。 - 5.アクチン
真核細胞に最も多量に含まれるタンパク質。細胞の骨格を作るとともに、運動、収縮をつかさどる。アクチン同士が重合、または脱重合することにより、細胞の形態や運動が制御される。 - 6.ミオシン
太いフィラメントを構成し、アクチン上を移動するモータータンパク質。 - 7.アクトミオシン
ミオシンとアクチンの複合体。活性化されたミオシンは、ミオシン同士で複合体を形成し、さらにアクチン繊維と結合する。ミオシンがアクチン線維上を滑るように動くことで、収縮力が発生する。ミオシンの活性化は、RhoAおよびその下流因子などによって引き起こされる。 - 8.カドヘリン
動物細胞を結び付けるために必要な細胞間接着分子の一つ。膜貫通型タンパク質。細胞間で、カドヘリンの細胞外領域どうしが結合し、細胞を接着させる。 - 9.カテニン
カドヘリンの細胞内領域に結合するタンパク質群。β-カテニン、α-カテニンなどがあり、カドヘリンの機能を制御している。α-カテニンは、アクチン繊維とも結合することで、カドヘリンとアクチン繊維の連結を仲介している。 - 10.接着帯、密着結合
接着帯および密着結合は、上皮細胞の頂端部側で、隣り合って形成される接着構造。細胞を密着させながらシート状に並べるために重要である。接着帯はカドヘリンによる接着構造で、細胞質側ではα-カテニンが環状のアクチン繊維と結合し、細胞骨格系と共同して細胞をジッパー状にくっつける。密着結合はクローディンタンパク質などから成り、細胞間の隙間を塞ぐことでバリア機能を果たす。なお、カドヘリンは、細胞同士の境界面全体に分布しているが、接着帯の形成なしでは上皮細胞を密着させることができない。 - 11.デスモソーム
カドヘリンに近縁の接着分子、デスモグレインやデモスモコリンによる細胞間接着構造。密着結合や接着帯が細胞内でアクチン繊維に連結するのに対し、デスモソームは中間系フィラメントと連結している。接着帯の直下から接着面全体に分布する。 - 12.ハイコンテントスクリーニング
薬剤などの細胞への影響を、画像取得・処理によって、網羅的にスクリーニングする方法。 - 13.サルコメア
動物の骨格筋は筋繊維により構成されており、筋繊維を形成している細胞のほとんどは筋原繊維である。筋原繊維では規則的な縞模様が観察され、その構成単位をサルコメアと呼ぶ。サルコメアは、平行に並んだミオシンによる太い繊維とアクチンによる細い繊維によって形成される。 - 14.ビンキュリン
接着帯や細胞の底部に形成される接着斑に集合するタンパク質。接着帯では、α-カテニンがアクチン繊維により引っ張られて構造が変化したときに、ビンキュリンがα-カテニンに結合するという機構が報告されている。
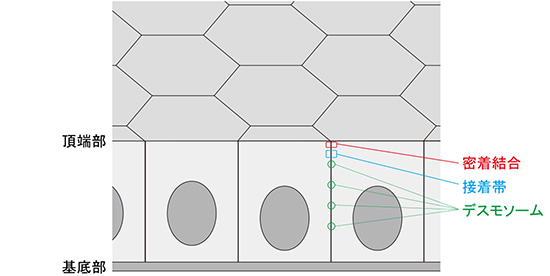
図1 上皮細胞における接着構造
上皮細胞には頂端部-基底部という極性があり、頂端部側でカドヘリンとその結合分子(カテニンなど)がアクチン繊維と結びついて「接着帯」を作る。これが、他の接着構造(密着結合、デスモソーム)とともに「接着複合体」を形成する。
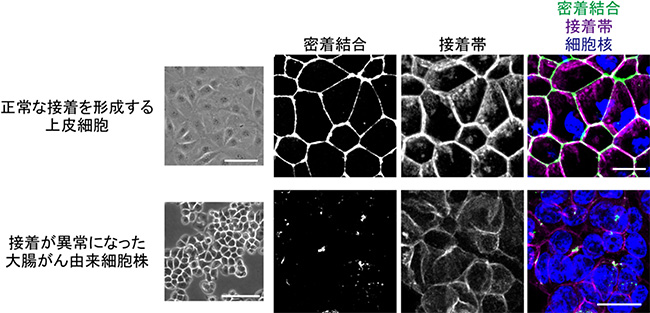
図2 大腸がん由来細胞における接着異常
上段:極性化した上皮細胞は、密着結合、接着帯を形成する(Caco2細胞)。
下段:多くの大腸がん由来細胞株は、密着結合、接着帯を形成できない(HT29細胞)。
密着結合は抗ZO-1抗体、接着帯は抗E-カドヘリン抗体で標識した。スケールバーは100μm(明視野写真)、10μm(蛍光染色写真)。
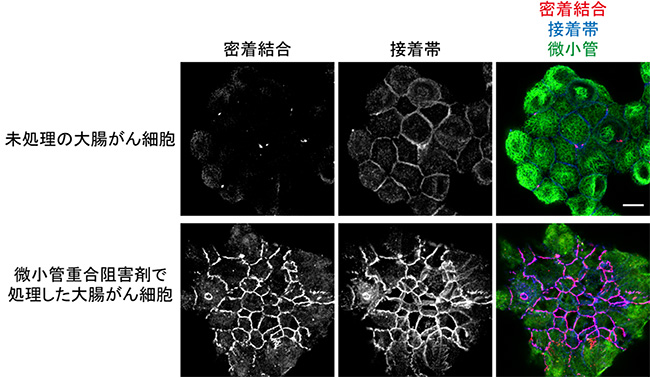
図3 微小管重合阻害剤で大腸がん由来細胞株の接着が回復
上段:大腸がん由来細胞株のHT29細胞。未処理の状態では、密着結合、接着帯を形成しない。
下段:微小管重合阻害剤で1時間処理したHT29細胞。微小管重合阻害剤での処理により微小管を壊すと、密着結合、接着帯の形成が誘導される。
密着結合は抗ZO-1抗体、接着帯は抗E-カドヘリン抗体、微小管は抗α-チューブリン抗体で標識した。スケールバーは10μm。
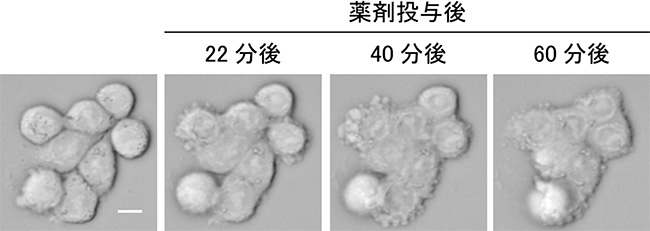
図4 大腸がん由来細胞株の接着が回復していく様子
微小管重合阻害剤によって大腸がん由来細胞株の接着が回復していく様子。薬剤投与の前は個々の細胞は丸まっており、その輪郭がはっきり分かるが、時間が経つにつれて、隣り合う細胞が密着し、細胞の輪郭が分からなくなる。スケールバーは10μm。
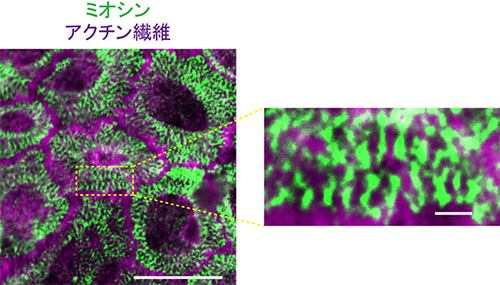
図5 接着回復時のアクトミオシン
微小管重合阻害剤で処理し、接着が回復しているときの細胞表層のアクトミオシン。ミオシン(緑)が縞状に並んでおり、筋肉で見られるサルコメアのように見える。ミオシンは抗ミオシン長鎖IIA抗体、アクチン繊維はファロイジンで標識した。スケールバーは10μm(左)、1μm(右)。
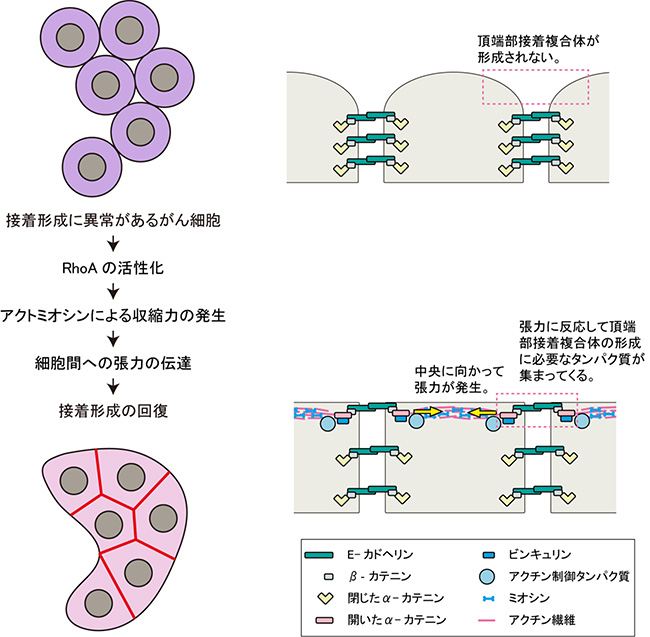
図6 大腸がん細胞株で細胞間接着が回復する機構
接着形成に異常があるがん細胞に微小管重合阻害剤などを加えると、RhoAの活性化が起きる。RhoAが活性化することにより頂端部表層でアクトミオシンが収縮し、それによって発生した収縮力がアクチン繊維とα-カテニンの連結を介して、細胞境界面に伝達される。その結果、細胞間接着が回復する。
