2018年2月23日
理化学研究所
日本医療研究開発機構
革新的技術による脳機能ネットワークの全容解明プロジェクト
脳の深部を非侵襲的に観察できる人工生物発光システムAkaBLI
―霊長類動物にも適用可能、高次脳機能のリアルタイム可視化への応用-
ポイント
要旨
理化学研究所(理研)脳科学総合研究センター細胞機能探索技術開発チームの宮脇敦史チームリーダー(光量子工学研究領域生命光学技術研究チーム チームリーダー)と岩野智基礎科学特別研究員らの共同研究グループは、ホタルが産生する化合物(基質)とタンパク質(酵素)をベースに新規の人工生物発光システムAkaBLIを開発し、生きた動物個体深部からのシグナル検出能を飛躍的に向上させました。
AkaBLIは、2013年に開発した人工基質AkaLumineと、AkaLumineに合わせて今回開発した人工酵素Akalucから構成されます。動物個体のバイオイメージングにおいては、一般的にホタルの生物発光システム(天然基質D-luciferin[1]と天然酵素Fluc[2])が用いられていますが、AkaBLIを用いると深部からの発光シグナルを従来と比べ100~1,000倍の強さで検出できることが分かりました。
具体的には、マウスの線条体[3](大脳皮質下の領域)の中の標識神経細胞からの発光を、無麻酔かつ自由行動の状態で非侵襲的に可視化することに成功しました。同様に、マーモセット(霊長類動物)の成体でも可視化を実現しました。また、マウス海馬のわずか数十個の神経細胞がさまざまな環境の変化に応じて興奮する様子を、同一動物個体を使って追跡することができました。昨今、脳深部を観察する光学的技術として例えば蛍光内視鏡が注目されていますが、強い侵襲性と狭い観察視野が問題となっています。AkaBLIを使えば、注目する神経回路を遺伝的にAkalucで標識し、その活性化を非侵襲的かつ包括的にモニタすることができます。本成果は、高等動物の高次脳機能をより自然な状況で解析するための技術として期待できます。
また、Akalucで標識した腫瘍細胞がマウスの肺の毛細血管にトラップされる現象を一細胞レベルで可視化することにも成功しました。AkaBLIは、少数の腫瘍細胞や幹細胞の新生や移入、さらにその後に起こる生着、増殖、転移などの現象を高感度にかつ定量的に観察することを可能にし、動物個体を扱う生命科学分野で幅広い活躍が期待されます。
本研究は、米国の科学雑誌『Science』(2月22日付け:日本時間2月23日)に掲載されます。
本研究は、日本学術振興会(JSPS)科学研究費補助金 新学術領域「共鳴誘導で革新するバイオイメージング(領域代表者:宮脇敦史)」および日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」の支援を受けて行われました。
※共同研究グループ
理化学研究所 脳科学総合研究センター
細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史 (みやわき あつし)
基礎科学特別研究員 岩野 智 (いわの さとし)
神経回路・行動生理学研究チーム
チームリーダー トーマス・ジョン・マックヒュー(Thomas John McHugh)
基礎科学特別研究員 田中 和正 (たなか かずまさ)
脳機能ネットワークの包括的解明プロジェクト
高次機能分子解析チーム
チームリーダー 山森 哲雄 (やまもり てつお)
研究員 渡我部 昭哉(わたかべ あきや)
マーモセット神経構造研究チーム
チームリーダー 岡野 栄之 (おかの ひでゆき)
研究員 畑 純一 (はた じゅんいち)
電気通信大学 大学院情報理工学研究科 先進理工学専攻
助教 牧 昌次郎 (まき しょうじろう)
京都大学大学院 医学系研究科
助教 日置 寛之 (ひおき ひろゆき)
東京工業大学 生命理工学院 生命理工学系
教授 近藤 科江 (こんどう しなえ)
助教 口丸 高弘 (くちまる たかひろ)
背景
生物発光は基質(ルシフェリン)と酵素(ルシフェラーゼ)から構成され、ルシフェリンがルシフェラーゼによって酸化されることで発光が起こります。生物発光のバイオイメージングでは、主に2種類のルシフェリンが用いられています。セレンテラジン[4]とD-luciferinです。
セレンテラジンは海に棲む生物発光動物が共有するルシフェリンで、その発光色は青色領域にあります。例えばRluc[5](ウミシイタケに由来)などのルシフェラーゼがセレンテラジンを効率よく酸化します。セレンテラジンとRlucの組み合わせは、試験管内や培養細胞の系で非常に強いシグナルをもたらす生物発光システムとして重宝されています。ただし、動物体内に入るとセレンテラジンは不安定で、ルシフェラーゼに到達する前に分解するかまたは酸化して光ってしまいます。
D-luciferinはホタルなどの陸生生物の生物発光に認められる基質で、発光色は黄緑色領域にあります。D-luciferinに対応するルシフェラーゼとしては、ホタルのFlucが最も有名です。D-luciferinは動物体内において安定しており、これとFlucのペアが動物個体バイオイメージングの世界標準として用いられています。
しかしD-luciferinにも重大な問題があります。組織透過性があまりよくないので、動物体内で不均一に分布してしまうのです。動物個体の生物発光バイオイメージングでは、あくまでもルシフェラーゼ酵素の遺伝子発現の量に比例してシグナル量が決定されるべきなのに、むしろルシフェリン基質の濃度によってシグナルの強弱が変わる状況が多いです。さらに、D-luciferinは血液脳関門(BBB)[6]を通過しにくいので、腹腔内投与[7]や経静脈投与[8]で体内に送り込まれても、脳内で発現するルシフェラーゼまで到達しないという問題があります(図1)。
そこでD-luciferinの誘導体が作製されました。2013年に、電気通信大学の牧研究室で合成されたのがAkaLumineという化合物です注1)。D-luciferinに比べて際立った長所が二つあります。第一にAkaLumineそのものの組織透過性がよいこと、第二にAkaLumineは組織透過性の高い赤色光を発することが挙げられます。実際にAkaLumineとFlucのペア(図2)を使うと、動物個体深部のイメージングの性能が向上することが明らかにされています。
注1)Iwano S et al., “Development of simple firefly luciferin analogs emiting blue, green, red, and near-infrared biological window light.” Tetrahedron 69, 3847-3856 (2013).
研究手法と成果
ホタルは長い進化の過程で、D-luciferinとFlucという基質と酵素のペアを最適化してきたと考えられます。共同研究グループは、Flucに試験管内進化を施せばAkaLumineをさらに効率よく酸化するFluc変異体が得られるはずだという仮説を立てていました。
そこで、大腸菌コロニーを扱う発現系を構築し、Fluc遺伝子に変異を導入しながら、AkaLumine噴霧によるコロニー発光の明るさを指標に、スクリーニングを実行しました。明るさ指向の試験管内進化は行きつ戻りつしながらも、最終的に28個のアミノ酸置換をFlucに入れてAkalucを開発しました(図2下)。そしてAkaLumineを基質とした場合、AkalucはFlucと比べて、約10倍の酸化反応活性を示すことが分かりました。さらに、哺乳類細胞内で、AkalucはFlucと比べて約4倍の発現量を示すことが分かりました。
共同研究グループは、AkaLumineとAkalucのペアを人工生物発光システム「AkaBLI」と命名しました(図2下)。従来のD-luciferinとFlucのペアと比べると、特に動物個体バイオイメージングにおいてAkaBLIの性能向上が顕著に表れます。対象部位が深ければ深いほどAkaBLIの威力が増し、マウスを用いた実験では、肺や脳の深部で従来法と比較して100~1,000倍のシグナル量増加が確認されています。
動物個体レベルの生物発光イメージングでは、多くの場合、基質(ルシフェリン)を全身に行きわたらせることが求められます(図1)。基質の全身投与は腹腔内投与や経静脈投与によって行われます。しかし、D-luciferinはBBBを通過しにくいため、これまで脳の生物発光イメージングはほとんど行われてきませんでした。共同研究グループは、アデノ随伴ウイルス(AAV)ベクター[9]を使ってマウスの線条体の一部の神経細胞にFlucまたはAkaluc遺伝子を導入しました。約2週間後に、それぞれのマウスの腹腔内にD-luciferinまたはAkaLumineを注射して麻酔下に観察したところ、頭表面で検出される発光シグナルに大きな差が認められました。すなわち、D-luciferin/Flucペア(従来法)に比べてAkaLumine/Akalucペア(AkaBLI)が約1,400倍強いシグナルを与えることが分かりました(図3)。AkaBLIの発光シグナルは極めて明るく、線条体からのシグナルを無麻酔・自由行動下で毎秒十数枚の速度で追跡することができました(図4)。またこうした高速観察は、マウスにAkaLumine含有水を自発的に摂取させる経口投与(PO)(図2)でもできることが分かりました。注射を使わない基質投与はストレスに影響を受けやすい生体現象を調べる上で有用です。
新しく開発された薬や治療法の有効性・安全性の検証では、実験動物としてマウスが最も多く用いられていますが、生理学的および解剖学的にヒトに近い性質を持つ霊長類の実験動物が必要になります。昨今は、より高次の脳機能を解析することを目的に、霊長類動物のマーモセットを使用する研究が増えています。共同研究グループは、線条体の生物発光イメージングを成獣マーモセットで試しました。AAVの感染後1カ月以上たってからAkaLumineを腹腔内投与し頭表面を観察したところ、線条体からの発光シグナルを明瞭に観察できました(図5上、感染後4カ月の画像)。こうした発光観察は、感染後1年以上たっても繰り返し行うことが可能で(図5下)、Akalucの安定発現を確認するデータを得られました。また、無麻酔・自由行動下の発光追跡も同じマーモセット個体を使って行うことができました(図6)。
共同研究グループは、AkaBLIを使って神経細胞の興奮を可視化する実験にも取り組みました。一般的に、神経細胞の興奮に伴ってc-fos遺伝子[10]の転写が起こることが知られており、この現象にAkalucの遺伝子発現がリンクするような実験系をマウスで組みました。マウスが新しい環境を探索する際に神経発火が起こる海馬領域[11]に注目し、そこで発現するAkalucの量を発光シグナルでモニタしたところ、白い発泡スチロール箱や青いバケツの中に置かれた際に海馬神経が興奮し、一方で、馴染み深い飼育ケージに置かれた際には海馬神経が興奮しない様子を、同一のマウス個体を使って追跡できました(図7)。一連の実験が終了した後に、脳を固定、ScaleS[12]試薬で透明化しAkalucが導入された神経細胞を海馬領域で数えたところ、わずかに49個であることが判明しました(図7)。極少数の標識で海馬の神経興奮を追跡したことで、AkaBLIの実用的な明るさを証明しました。従来こうした実験は、多数のマウスを白い発泡スチロール箱、青いバケツ、飼育ケージ、対照の群に分け、多くの脳切片を調整してc-fos発現量を定量し、個体間で統計的に比較するやり方で行われてきました。
共同研究グループはまた、脳以外の深部臓器として肺に注目しました。マウスの尾静脈から腫瘍細胞を多数注入すると、まずは肺の毛細血管にトラップされることが明らかになっています。従来のようにFluc発現腫瘍細胞を注入し引き続きD-luciferinを静脈注射する手法では、何万個という数の細胞を注入しないと肺における発光シグナルを有意に検出できませんでした。ところが、がんの肺転移にしても、血管内を循環する細胞の数はそれほど多くないはずです。一度に何万個もの細胞の注入はあまりにも不自然です。そこで、Akaluc発現腫瘍細胞とAkaLumineの組み合わせを試したところ、注入細胞数を10個、3個、2個、1個まで減らしても肺における発光シグナルを可視化できました(図8)。1~10の少数個注入を検討する限り、発光シグナルは1カ所に集中する場合が多く、そのシグナル総量が注入細胞数に正比例することが確認できました。注入された腫瘍細胞が血管内で凝集した後に肺に着床することを示すデータです。
今後の期待
蛍光タンパク質を含むさまざまな蛍光分子がバイオイメージングで著しく活躍していますが、蛍光には励起光が必要で、これに基づく弱点がいくつかあります。一般的に、蛍光は生体の深部イメージングを苦手としますが、そこにも励起光問題が関わってきます。深部にある蛍光分子に励起光を送り込むことが難しく、高感度で定量的な観察が期待できないのです。一方、生物発光は光照射を必要としません。ただし、動物個体のイメージングの場合、体内で発現する酵素ルシフェラーゼに十分量(飽和量)の基質ルシフェリンを送り込むことが必要です。①体内で基質ルシフェリンが均一かつ安定に分布し、②適当な親和性で酵素ルシフェラーゼによって酸化され、③発生するエネルギーが高い確率で光に変換され、さらに④放出された光が効率よく組織を透過すると、理想に近い生物発光バイオイメージングが達成されます。
共同研究グループは、とくに動物深部イメージングを意識し、人工の生物発光システムAkaBLIを開発しました。AkaLumineとAkalucのペアは上記の四つの要求をよく満たし、その結果AkaBLIは、天然生物発光システムである従来のD-luciferin/Flucペアと比べ、特に脳の深部イメージングの性能を飛躍的に向上させることが分かりました。今回の研究の対象となった線条体や海馬以外にも、視床、視床下部、扁桃体などの脳深部領域にアプローチできると思われます。また、マーモセット以外の大型霊長類動物の脳にも適用が可能です。
実際の発光観察に必要なAkaluc発現細胞の寡少性も注目されます。AkaBLIで海馬興奮をモニタする実験系では僅か49個の神経細胞が応答シグナルを発信していました。今後、Cre-loxP[13]などの部位特異的組み換え技術を使って、Akalucの発現を特定の神経回路に限定すれば、脳機能に関してより精度の高い情報を得ることができます。いずれにしてもAkalucを蛍光タンパク質と連結することで、AkaBLIと蛍光イメージングとを補完的に組み合わせることが重要です。サンプルを固定したあとの透明化および蛍光シグナルの3次元再構築など、脳の構造と機能の相関を研究するアプローチはますます多角的に発展すると思われます。
生物発光イメージングの利点は非侵襲性にあります。頭蓋骨に穴を開ける、内視鏡を体内へ入れるというような侵襲的手技が要りません。ただし、従来の生物発光イメージングはシグナルが暗いゆえに、麻酔下で長時間露光撮影が一般的でした。ところがAkaBLIはシグナルが明るいゆえに、無麻酔かつ自由行動下のシグナル追跡を可能にします。AkaBLIをベースにカルシウムプローブなどの機能プローブが開発できれば、社会的行動関連の脳活動を含めた高次脳機能を、より自然な状況で解析する技術の開発が期待できます。
脳以外の組織や器官においてもAkaBLIの適用が増えると思われます。共同研究グループはAkalucの発現系を多様に進展させており、少数の腫瘍細胞や幹細胞から始まる生着、増殖、転移などの動態を高感度にかつ定量的に観察することが可能になると思われます。今回開発した人工生物発光システムAkaBLIは、今後、動物個体を扱う生命科学分野で幅広い活躍が期待されます。
原論文情報
- Satoshi Iwano, Mayu Sugiyama, Hiroshi Hama, Akiya Watakabe, Naomi Hasegawa, Takahiro Kuchimaru, Kazumasa Z. Tanaka, Megumu Takahashi, Yoko Ishida, Junichi Hata, Satoshi Shimozono, Kana Namiki, Takashi Fukano, Masahiro Kiyama, Hideyuki Okano, Shinae Kizaka-Kondoh, Thomas J. McHugh, Tetsuo Yamamori, Hiroyuki Hioki, Shojiro Maki, Atsushi Miyawaki, "Single cell bioluminescence imaging of deep tissue in freely moving animals", Science, doi: 10.1126/science.aaq1067
発表者
理化学研究所
脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史 (みやわき あつし)
(光量子工学研究領域 エクストリームフォトニクス研究グループ 生命光学技術研究チーム チームリーダー)
基礎科学特別研究員 岩野 智 (いわの さとし)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル22F
Tel: 03-6870-2222 / Fax: 03-6870-2244
brain-pm [at] amed.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.D-luciferin
ホタルなどの陸生生物の生物発光で使われる発光基質。Flucなどのルシフェラーゼによって酸化され光を発する。 - 2.Fluc
ホタル由来のルシフェラーゼ。D-luciferinを酸化する。FlucはFirefly luciferaseの略。 - 3.線条体
大脳基底核の主要構成要素の一つで、被殻と尾状核から成る。神経回路における大脳皮質からの入力を担い、運動機能、学習や記憶などさまざまな機能に関与する。 - 4.セレンテラジン
歴史的には、発光海洋生物のウミシイタケとオワンクラゲで見つかったルシフェリン。それぞれの動物でRenilla luciferase (Rluc)とAequorin(イクオリン)の基質となる。 - 5.Rluc
ウミシイタケのルシフェラーゼでセレンテラジンを酸化する。RlucはRenilla luciferaseの略。 - 6.血液脳関門(BBB)
脳内血管と脳内細胞(神経細胞、グリア細胞)間の物質交換を制限する機構。脳に必要な物質を血液中から選択して脳へ供給するとともに、有害な物質の侵入を阻止する。 - 7.腹腔内投与
薬物の全身投与法の一つ。腹腔内へ直接注射する方法。ipと略す。 - 8.経静脈投与
薬物の全身投与法の一つ。静脈注射のこと。マウスでは尾静脈を介する投与が一般的。ivと略す。 - 9.アデノ随伴ウイルス(AAV)ベクター
動物個体への遺伝子導入に適したウイルスベクター。とくに神経細胞などの非分裂細胞において長期間安定な目的遺伝子発現を可能にする。 - 10.c-fos遺伝子
c-Fosタンパク質は、興奮発火した神経細胞で急速かつ一過的に発現が誘導される。c-fos遺伝子は、活性化した神経細胞のマーカーとしてよく使われる。 - 11.海馬
記憶および空間学習などに関わる器官。大脳皮質の下にある。 - 12.Sca leS
尿素をベースにした生体組織透明化技術がSca le。尿素にソルビトールを加えて、さらに透明化能力および組織構造・シグナルの保持能力を高めた試薬がSca leS。 - 13.Cre-loxP
遺伝子組み換え技術の一つ。loxP配列(DNA配列)に対してDNA組み換え酵素Creが働くことで起こる部位特異的組み換え反応を利用。さまざまなCreドライバーマウスが揃っており、組織(領域)特異的あるいは時期特異的な遺伝子制御が可能。
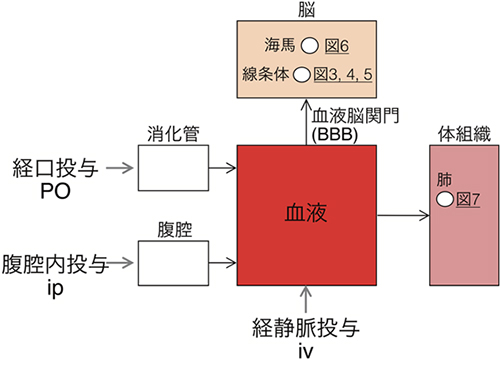
図1 動物個体生物発光イメージングのコンパートメントモデル
基質の全身投与は、iv(経静脈投与)、ip(腹腔内投与)、PO(経口投与)などで行われる。基質は直接的あるいは間接的に血管内に入り全身の組織に拡がる。脳への分布は血液脳関門における透過性に依存する。ルシフェラーゼの発現部位(線条体、海馬、肺)を○で示し、本稿において相当する図の番号を記入した。
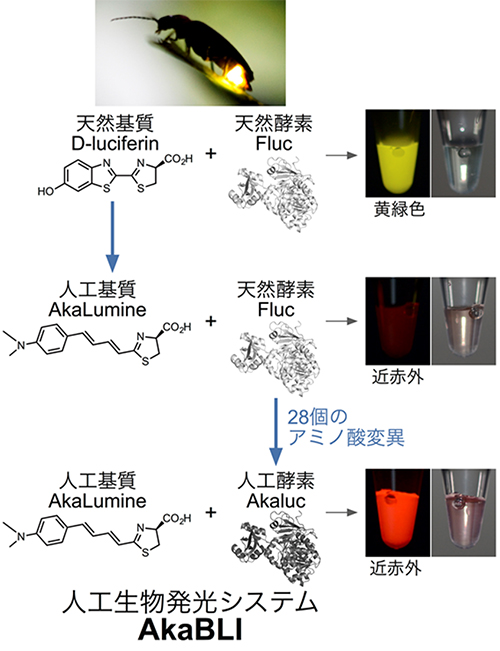
図2 人工生物発光システムAkaBLIの開発:ホタルの生物発光を基質と酵素の両面から共進化
天然基質D-luciferinと人工基質AkaLumineの化学構造式。AkaLumineは動物個体に投与する際は塩酸塩の形で用いる(AkaLumine-HCl)。
天然酵素Flucの結晶構造を灰色で示した。人工酵素Akalucの3次元構造(黒色)は未決定である。AkaLumineとAkalucのペアをAkaBLIと呼ぶ。
各基質・酵素ペアの試験管内発光の様子をデジタルカメラで撮影した(右側)。なお、AkalucはD-luciferinを全く酸化しない。
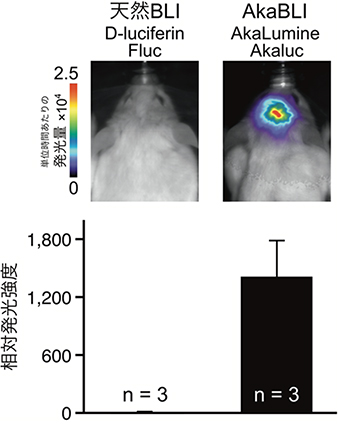
図3 マウス線条体の発光シグナル(従来システムとAkaBLIシステムとの比較)
AAVを使ってFluc(左)、Akaluc(右)の遺伝子をマウス線条体に導入。2週間後に、それぞれの基質、D-luciferin(左)、AkaLumine(右)を腹腔内投与し頭部を観察。同様の比較実験を別の2ペアマウスを使って行い、相対発光強度(D-luciferin/Flucの値で正規化)を棒グラフで表示(下)。
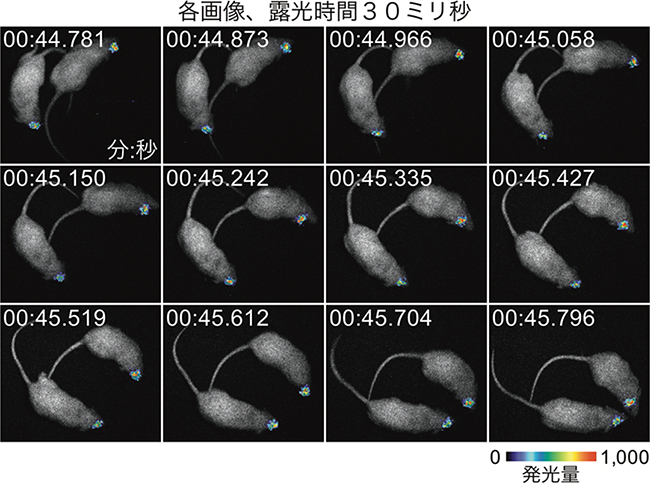
図4 自由行動マウスの線条体からのAkaBLI発光シグナル(ビデオレート撮影)
AAVを使ってAkalucの遺伝子をマウス線条体に導入。2週間後にAkaLumineを経静脈投与し全身を観察。2匹を同時に観察しモンタージュを作成。一発光画像の露光時間は30ミリ秒。各時刻の秒は小数3桁まで表示。各インターバル時間内に明視野画像を撮影し発光画像に重ね合わせた。こうした高速観察は1時間以上安定に継続できた。動画参照。
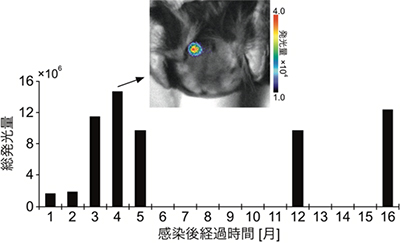
図5 マーモセット線条体のAkaBLI発光シグナル(麻酔下)
AAVを使ってAkalucの遺伝子をマーモセット(4歳、♀)の線条体に導入。AAVを感染させてから1、2、3、4、5、12、16カ月後にAlkaLumineを腹腔内投与して頭部を観察。4カ月後の除毛後の発光画像を表示(上)。各観察における発光シグナルの総量を棒グラフにプロットした(下)。
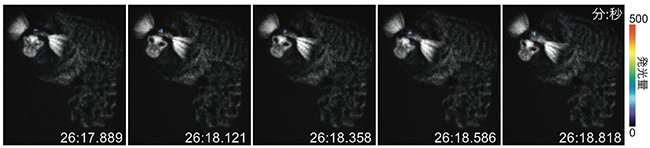
図6 A FIRE-MONKEY.マーモセット線条体のAkaBLI発光シグナル(自由行動下)
図5の12カ月後の観察において、麻酔施行の前に自由行動下の撮影を行った。一発光画像の露光時間は100ミリ秒。カメラ視線でウインクした時間帯でモンタージュを作成。各時刻の秒は小数3桁まで表示。明視野画像を各インターバル時に撮影し発光画像に重ね合わせた。こうした高速観察は1時間以上安定に継続することができた。
YouTube:自由行動下マウスとマーモセットの生体深部からの発光シグナルをリアルタイムで観察可能な「AkaBLI」(動画)参照。
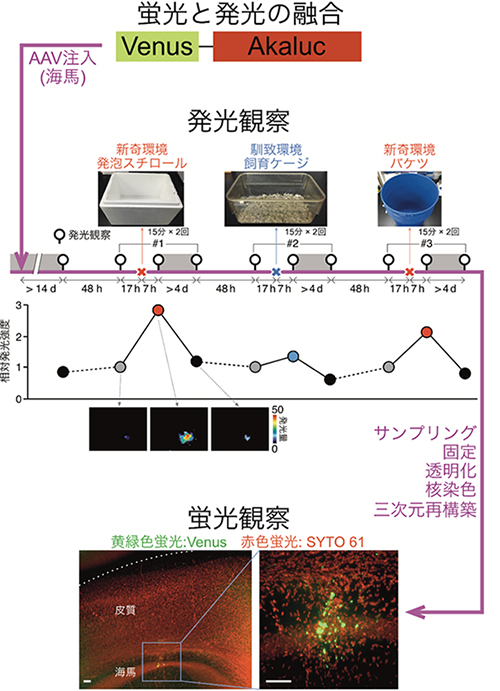
図7 環境変化で起こるマウス海馬神経の興奮をAkaBLIで追跡
Akaluc遺伝子に黄色蛍光タンパク質Venusの遺伝子を連結し、AAVを使ってマウス海馬領域に導入。Venus-Akalucが神経細胞の興奮に応じて発現するように系を組んだ。
一過的に(15分2回)、白い発泡スチロール箱、飼育ケージ、青いバケツの環境を体験させる実験を連続して行った。各実験において、体験の前後および薬剤(doxycyclin)投与(灰色で影を付けた時間帯)によるVenus-Akaluc除去後のAkaBLI発光画像を撮影。白い発泡スチロール箱を使った実験における3画像を表示。新奇環境の体験で発光シグナルが増強し、薬剤投与で元のレベルに戻ることが示された。観察と観察(体験)の間隔を下に記した。d: 日。h: 時間。
最終的に、カイニン酸投与で神経細胞を全般的に刺激した後で、脳を固定し透明化しながら核染色(SYTO 61)を施した。海馬におけるVenus蛍光の3次元再構築を行い、AAV感染神経細胞を包括的に検出した。
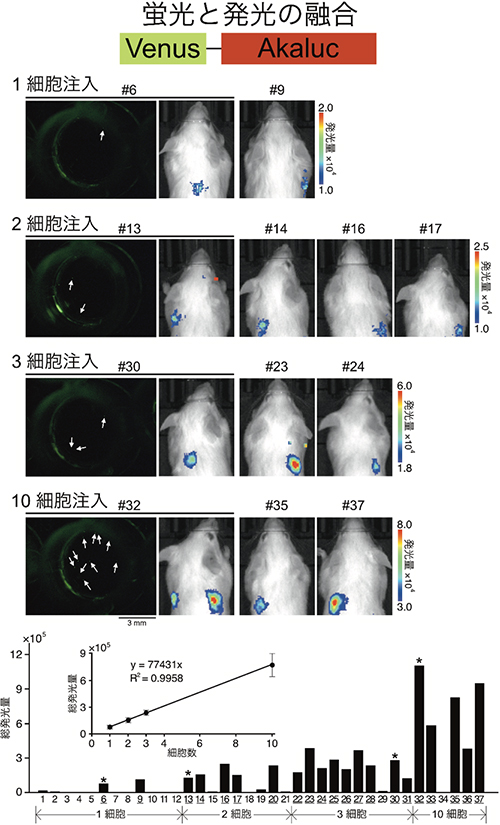
図8 肺でトラップされた腫瘍細胞の一細胞レベル検出(AkaBLIで実現)
Venus-Akalucを発現するヒト由来腫瘍細胞(HeLa細胞)の分散溶液を準備。適当に希釈して0.1 mlあたり1、2、3、10個の細胞が存在するような溶液を調製(Venus蛍光と明視野観察で確認)して尾静脈から注入。AkaLumineを経静脈投与し、麻酔下に発光画像を撮影。マウスの個体番号#1~12:1細胞を注入、#13~21:2細胞を注入、#22~31:3細胞を注入、#32~37:10細胞を注入。#6, #13, #30, #32について、注入直前の溶液の蛍光画像を発光画像に並べて示した。
マウスの背中表面で検出される総発光量を棒グラフで示した。下線ラベルの個体で有意な発光が認められ、発光量と注入細胞数の関係を表すグラフを挿入した。
