理化学研究所(理研)脳神経科学研究センター神経回路・行動生理学研究チームのトーマス・マックヒューチームリーダー、スティーヴン・ミドルトン研究員、神経遺伝研究チームの山川和弘チームリーダーらの国際共同研究チーム※は、知的障害モデルマウスにみられる記憶障害には、脳の海馬[1]における「再生(リプレイ)現象[2]」の異常が関与していることを発見しました。
本研究成果は、知的障害の患者の一部で観察される記憶障害を引き起こす脳メカニズムの理解に貢献すると期待できます。
知的障害の患者では、電位依存性ナトリウムチャネルNav1.2[3]をコードするSCN2A遺伝子[4]に高頻度で新生変異[5]が同定されています。一方、マウスが空間を探索するとそれぞれの場所に対応した海馬の場所細胞[6]が順番に活動し、その後マウスの休憩中に、場所細胞の活動が同じ順番でかつ時間的に圧縮されて再生されるリプレイという現象が起こり、空間記憶が固定されることが知られています。今回、国際共同研究チームが作製したScn2a遺伝子ノックアウトマウス[7](Scn2aKOマウス)は空間記憶の障害を示したため、知的障害モデルマウスとして、その海馬を詳しく調べました。その結果、Scn2aKOマウスの探索行動中の場所細胞の活動には異常が認められませんでしたが、鋭波[8]と呼ばれる脳波[9]に同期したリプレイに異常が認められることが分かりました。このことから、海馬リプレイの異常が記憶障害の発症に関与している可能性が示されました。
本研究は、米国の科学雑誌『Nature Neuroscience』の掲載に先立ち、オンライン版(6月4日付け:日本時間6月5日)に掲載されます。
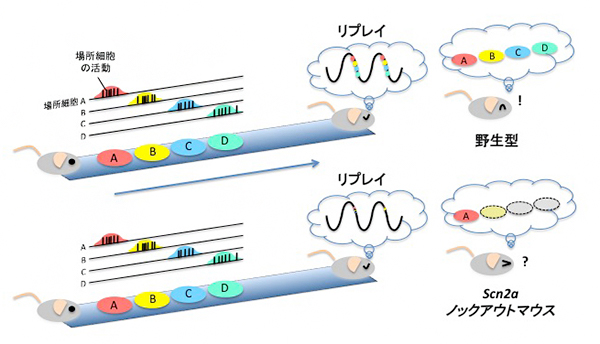
図 知的障害モデルマウスにおける海馬リプレイの異常と記憶障害
※研究チーム
理化学研究所 脳神経科学研究センター
神経回路・行動生理学研究チーム
チームリーダー トーマス・マックヒュー(Thomas J. McHugh)
研究員 スティーヴン・ミドルトン (Steven J. Middleton)
研修生 エミリー・ネラー(Emily M. Kneller)
基礎科学特別研究員 シュオ・チェン(Shuo Chen)
神経遺伝研究チーム
チームリーダー 山川 和弘(やまかわ かずひろ)
研究員(研究当時) 荻原 郁夫(おぎわら いくお)
(現日本医科大学医学部准教授)
カルフォリニア大学サンディエゴ校 神経科学学部
教授 マウリシオ・モンタール(Mauricio Montal)
※研究支援
本研究の一部は、JSPS科研費26750378, 21791020、NIHグラントGM49711、国立研究開発法人日本医療研究開発機構(AMED)の脳科学研究推進プログラム(分担:山川和弘)、による支援を受けて行われました。
背景
脳の海馬は、空間の記憶や「いつどこで何が起こった」といったエピソード記憶など、さまざまな種類の記憶の形成や保存に関与しています。空間記憶においては、海馬に存在する「場所細胞」と呼ばれる細胞の活動が重要な役割を果たします。例えばマウスが空間を探索する際には、それぞれの場所に応じて異なる場所細胞が次々に活動します。その後、マウスが休息をとる間に、探索中に活動したそれらの場所細胞の活動が同じ順番で、かつ時間的に圧縮されて繰り返し再生されることで、空間記憶が固定される可能性が示されています(図1)。この現象は「リプレイ」と呼ばれ、海馬の脳波のうち、鋭波(sharp wave ripples:SPW-Rs)に同期して起こることが知られており、実際に人為的に鋭波を乱すと記憶障害を起こすことがマウスで確かめられています。
しかし、記憶をはじめとする認知機能に発達の段階で遅れを生じる疾患である知的障害において、鋭波が記憶の形成や保存にどのような影響を与えているかについては、分かっていませんでした。
SCN2A遺伝子は、電位依存性ナトリウムチャネルNav1.2をコードしており、遺伝性のてんかんや重度の知的障害を伴うてんかん性脳症[10]、自閉症、統合失調症などの患者において、高頻度で新生変異が報告されています。今回、国際共同研究チームは、Scn2a遺伝子ノックアウトマウスを知的障害モデルマウスとして用いて、その脳の海馬における神経細胞の生理学的な性質を詳しく調べることで鋭波と記憶形成・保存の関係の解明を試みました。
研究手法と成果
Scn2a遺伝子ノックアウトのホモ接合体[11]マウスは、胎児の段階で死んでしまいます。また、患者でみられる変異はヘテロ変異です。そのため、国際共同研究チームは、Scn2a遺伝子ノックアウトのヘテロ接合体[11]マウス(Scn2a+/-、以下Scn2aKOマウス)を実験に用いました。Scn2aKOマウスは発育に大きな異常はなく、成体まで成長します。
まず、Scn2aKOマウスの空間記憶能力を調べるため、いくつかの空間記憶テストを行いました。まず、空間的なワーキングメモリ[12]能力をテストする目的で、Scn2aKOマウスと同胞の野生型マウスを、図2Aのような装置に入れ、スタート地点に応じて報酬の餌のあるゴールを目指すタスクを繰り返し、ゴールに正しくたどり着けるかを調べました。対照群の野生型マウスは、訓練開始から9日後にはゴールの位置を学習し空間記憶を形成したのに対し、Scn2aKOマウスは訓練開始から13日経っても学習できず、野生型マウスに比べて学習の進行が遅いことが分かりました(図2B)。同様にバーンズ迷路と呼ばれる別の空間記憶のテストにおいても、Scn2aKOマウスは野生型マウスに比べて学習が遅いことが分かりました。これらの結果は、Scn2aKOマウスは空間記憶が低下していることを示しています。
次に、Scn2aKOマウスの海馬の神経細胞の生理学的特性を調べました。Scn2aKOマウスと同胞の野生型マウスが、直線のトラックを探索中に、海馬CA1領域[1]の場所細胞の活動を記録したところ、場所細胞の基本的な性質(活動の頻度、対応する場所の大きさなど)において、Scn2aKOマウスと対照群の野生型マウスで違いはありませんでした(図3A)。また、海馬における各種脳波(γ波、θ波)の性質やこれらの脳波と場所細胞の活動との同期についても、Scn2aKOマウスと対照群の野生型マウスで違いはありませんでした。これらの結果は、Scn2aKO変異マウス海馬の神経細胞では、空間情報を取得する能力について、特に異常が認められないことを示しています。
次に、Scn2aKOマウスにおける海馬の鋭波に同期してリプレイする場所細胞の活動について調べたところ、Scn2aKOマウス海馬の鋭波と同期してリプレイする場所細胞の活動頻度のピークが、対照群の野生型マウスに比べて有意に減少していることが分かりました(図3B)。
海馬の鋭波は、休息中や睡眠中によく観察されます。そこで、Scn2aKOマウスの睡眠を調べたところ、対照群の野生型マウスと比べて、睡眠時間の割合は変化していませんでした。これは、Scn2aKOマウスでのリプレイの異常が睡眠の異常に由来しているわけではないことを示しています。
さらに、Scn2aKOマウス海馬の鋭波と同期する場所細胞の活動を詳しく調べたところ、鋭波に合わせて同時に活動しリプレイを可能にする場所細胞の集団(細胞アセンブリ)の活動の強さと頻度が、対照群の野生型マウスと比べて減少していました。また、細胞アセンブリを同時に活動させるメカニズムには、抑制性細胞の働きが重要だと考えられていることから、抑制性細胞であるパルブアルブミン陽性介在神経細胞(PV性介在神経細胞)[13]の活動を解析しました。その結果、Scn2aKOマウスではPV性介在神経細胞の活動のうち、鋭波と同期するものが有意に増加していました。
これらの結果から、Scn2aKOマウスでは、抑制性の介在神経細胞の活動亢進により、鋭波に合わせて同時に活動する細胞アセンブリの活動が減少することで、場所細胞のリプレイに異常が生じ、空間記憶障害を引き起こしている可能性が示されました。
今後の期待
本成果は、知的障害モデルマウスであるScn2aKOマウスにおいて、記憶障害と海馬の場所細胞のリプレイの異常の関連を初めて示したものです。今後、リプレイの異常が生じる過程をさらに研究することにより、知的障害の発症メカニズムの理解に貢献すると期待できます。
原論文情報
- Steven J. Middleton, Emily M. Kneller, Shuo Chen, Ikuo Ogiwara, Mauricio Montal, Kazuhiro Yamakawa and Thomas J. McHugh, "Altered hippocampal replay is associated with memory impairment in mice heterozygous for the SCN2A gene.", Nature Neuroscience, s41593-018-0163-8
発表者
理化学研究所
脳神経科学研究センター 神経回路・行動生理学研究チーム
チームリーダー トーマス・マックヒュー(Thomas J. McHugh)
研究員 スティーヴン・ミドルトン(Steven J. Middleton)
脳神経科学研究センター 神経遺伝研究チーム
チームリーダー 山川 和弘(やまかわ かずひろ)
 トーマス・マックヒュー
トーマス・マックヒュー
 スティーヴン・ミドルトン
スティーヴン・ミドルトン
 山川 和弘
山川 和弘
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.海馬、CA1領域
内側側頭葉に位置する脳部位であり、過去の体験についての記憶(エピソード記憶)など、一部の記憶や学習に深く関わる。CA1領域は海馬の領域の一つで、興奮性の錐体細胞と抑制性の介在神経細胞を含む。 - 2.再生(リプレイ)現象
場所細胞の活動が、対応した場所への物理的通過を伴うことなく発火順序を保ったまま再生もしくは逆再生される現象。リプレイの発生を妨害すると記憶の固定が損なわれることから、場所情報を記憶として固定させるのに重要であると考えられている。 - 3.電位依存性ナトリウムチャネルNav1.2
イオンチャネルは細胞膜上にイオンが通る穴を形成し、ナトリウムやカリウムなどのイオンを選択的に行き来させることで細胞の興奮や抑制を制御する重要な働きをする。神経細胞膜上には、ナトリウムチャネル、カリウムチャネル、カルシウムチャネルなどさまざまなイオンチャネルが存在し、神経細胞の興奮、抑制などをつかさどっている。電位依存性ナトリウムチャネルは、ナトリウムイオンを通す穴を形成する主要構成タンパク質であるαサブユニットと、その機能や細胞内移動を調節するβサブユニットからなるイオンチャネルである。ヒトにおいては、αサブユニットはNav1.1〜1.9の9種類が、βサブユニットはβ1~β4の4種類が知られている。αサブユニットには主に骨格筋で発現するNav1.4や心筋のNav1.5などがあるが、中枢神経系で発現するものとしては主にNav1.1, Nav1.2, Nav1.3, Nav1.6の4種類が知られている。 - 4.SCN2A遺伝子
電位依存性ナトリウムチャネルNav1.2をコードする遺伝子。 SCN2AやNav1.1をコードする遺伝子 SCN1Aなどの変異がてんかん患者で報告されている。 - 5.新生変異
変異が両親になく、その子供のみにみられる場合は「新生(de novo)変異」と呼ぶ。タンパク質を暗号化している領域の新生変異は、平均して1人当たり1~2個とされる。多くの散発性疾患の原因と想定されている。近年、タンパク質の機能を変化/喪失させる新生変異が重篤なてんかんや自閉症などの少なくとも一部の発症原因となっていることが明らかにされつつあり、そのような新生疾患変異を示す遺伝子は自閉症だけでも実に数百もしくは1,000種類を超えると予想されている。 - 6.場所細胞
動物が空間を移動する際、通過した位置に応答して活動する細胞のこと。物理的な空間に限らず、広い意味での認知座標としても機能すると考えられている。場所細胞がエピソード記憶の神経基盤であるとする説が有力である。 - 7.ノックアウトマウス
目的の遺伝子を人為的に欠失させたマウス。 - 8.鋭波(sharp wave ripples: SPW-Rs)
海馬における脳波の一種。海馬の細胞外記録(神経細胞の外に電極を静置する記録法)で検出される大きな振幅を持った活動のうち、高い周波数の振動を伴うものを指す。海馬神経細胞の同期的な集団活動を反映しており、前述のリプレイは鋭波中に観察される。 - 9.脳波
脳波は神経細胞の集団活動を反映すると考えられており、周波数によりデルタ(δ)波(0.5~4 Hz)、シータ(θ)波(4~8 Hz)、アルファ(α)波(8~12 Hz)、ベータ(β)波(12~30 Hz)、ガンマ(γ)波(30Hz以上)の5種類に分類される。比較的ゆったりと進むθ波は記憶と関連し、非常に速く進むγ波は意識と関連すると考えられている。 - 10.てんかん性脳症
新生児期から幼児期にかけて特徴的なてんかん発作で発症し、 特異的な脳波所見を呈し、難治性であり、知能・運動・情緒 に関する発達障害を併発する疾患群である。代表的な疾患として、大田原症候群、早期ミオクロニー脳症、 ウエスト症候群(点頭てんかん)、レンノックス・ガストー症候群が挙げられる。 - 11.ホモ接合体、ヘテロ接合体
通常、動物の遺伝情報は両親から受け継いでおり、遺伝情報は父親由来と母親由来の二つ存在する。Aという遺伝子であれば、通常AAと2倍の遺伝子からの情報を持つ。A遺伝子に変異を生じてa遺伝子となる場合、この遺伝子を片親から受け継いでAaという遺伝子情報を持った個体をヘテロ接合体と呼び、両親から同じ遺伝子を受け継いで、AAまたはaaという遺伝情報を持つ個体をホモ接合体と呼ぶ。 - 12.ワーキングメモリ
一時的な情報の保存と操作を可能にする記憶機能のこと。前頭前野などが関与すると考えられている。 - 13.パルブアルブミン陽性介在神経細胞(PV性介在神経細胞)
大脳皮質の介在細胞のうち、パルブアフブミンタンパク質を内在する抑制性神経細胞。介在細胞の約50%を占める。この細胞の形と機能から、錐体細胞の活動を強く抑制すると考えられている。
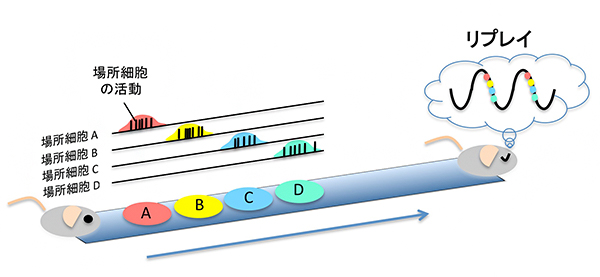
図1 海馬の場所細胞とリプレイ
動物の海馬の場所細胞は、特定の場所に来ると活動する性質を持つ。また、動物が休息中に、それらの場所細胞が同じ順番で時間的に圧縮されて繰り返し活動する(リプレイ)ことで、記憶が固定すると考えられている。
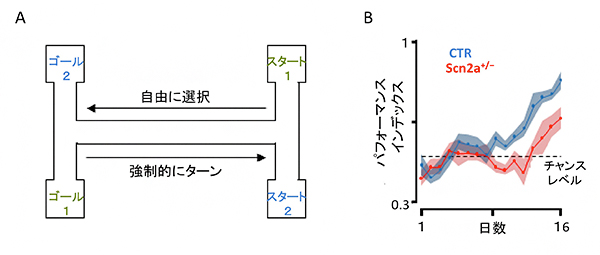
図2 Scn2aKOマウスの空間記憶障害
- A. 空間記憶ワーキングメモリ学習タスク。スタート1からは、ゴール1へ到達すると報酬がもらえる。スタート2からは、ゴール2へ到達すると報酬がもらえる。スタートからゴールを選ぶ際には自由に選択できるが、ゴールからスタートへ戻る際には強制的にターンさせられる。
- B. 対照群の野生型マウス(CTR)は、日数が経つにつれて正解率が偶然期待される確率(0.5:チャンスレベル)以上となり学習が進行したのに対し、Scn2aKOマウス(Scn2a+/-)は13日経過しても学習が進まなかった。
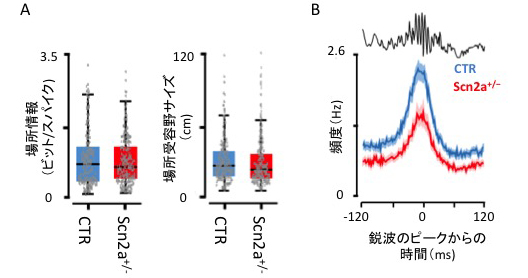
図3 Scn2aKOマウスのリプレイの異常
- A. マウスが探索中に、場所細胞の活動が示す場所情報や反応する場所の広さは、野生型マウス(CTR)とScn2aKOマウス(Scn2a+/-)で違いがなかった。
- B. 休息中の鋭波(上の黒線)に同期する場所細胞の活動頻度は、野生型マウス(CTR)に比べて、Scn2aKOマウスで有意に低下した。
