理化学研究所(理研)生命医科学研究センター免疫転写制御研究チームの香城諭上級研究員、谷内一郎チームリーダーらの研究チーム※は、T細胞の分化および機能発揮に重要な「Cd4遺伝子」の発現に関する新たな制御機構を発見しました。
本研究成果は、まだ不明な点が多いT細胞分化について、それを制御する分子機構の一端を明らかにするものです。近年進行しているiPS細胞(人工多能性幹細胞)[1]などを用いた人為的なT細胞の作製による疾患治療の試みに貢献すると期待できます。
今回、研究チームは、成熟した「ヘルパーT細胞[2]」において機能する新たな遺伝子制御領域(Cd4成熟エンハンサー[3])を同定しました。このCd4成熟エンハンサーを欠損させたマウスでは、ヘルパーT細胞におけるCd4遺伝子の発現が不安定となり、T細胞の分化異常が認められました。さらに、この成熟エンハンサーの機能が、ヘルパーT細胞では「オン」、「キラーT細胞[4]」では「オフ」となっている機構について解明を試みました。その結果、定説とは異なる「Cd4サイレンサー[3]非依存的かつ転写因子[5]Runx依存的に、Cd4遺伝子の発現が制御される」という新たな制御機構を発見しました。
本研究は、英国のオンライン科学雑誌『Nature Communications』(9月5日付け:日本時間9月5日)に掲載されます。
※研究チーム
理化学研究所 生命医科学研究センター 免疫転写制御研究チーム
チームリーダー 谷内 一郎 (たにうち いちろう)
上級研究員 香城 諭 (こうじょう さとし)
研究員(研究当時) ニッグハット・ヤスミン(Nighat Yasmin)
研究員(研究当時) 天野 麻理(てんの まり)
テクニカルスタッフI 室井 佐和子(むろい さわこ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「クロマチン構造制御によるヘルパー/キラー系列決定機構の解明(研究代表者:谷内一郎)」による支援を受けて行われました。
背景
私たちの身体を病原体(細菌、ウイルスなど)やがん細胞から守る免疫細胞の一つにT細胞があります。T細胞には、免疫系の司令塔となる「ヘルパーT細胞」や、細菌・ウイルス感染細胞やがん細胞を排除する「キラーT細胞」などが存在します。これらのT細胞は、共通の前駆細胞が胸腺[6]で行われる「ポジティブセレクション[7]」という分化イベントの後に、それぞれが発現するT細胞受容体[8]の性質に応じた細胞系列へ分化・成熟していくことで生み出されます。
ヘルパーT細胞の分化および機能発揮には、「CD4」という細胞表面のタンパク質が極めて重要です。CD4はポジティブセレクション前の未熟な胸腺細胞において発現が開始され、ヘルパーT細胞ではその発現が維持される一方、キラーT細胞では発現が抑制されます。
2002年に谷内チームリーダーらは、このヘルパーT細胞特異的な「Cd4遺伝子」の発現制御機構について、キラーT細胞では「Cd4サイレンサー(S4)」というシス転写調節領域[3]が転写因子Runx依存的に働き、Cd4遺伝子の発現を抑制することを報告しました注1)。これにより、ヘルパー系列特異的なCD4発現は、Cd4サイレンサーによるキラー系列でのCd4遺伝子サイレンシング(遺伝子発現の抑制)により担われることが定説となりました。
しかし、その後の報告において、ヘルパーT細胞特異的にCd4遺伝子の発現を誘導する未知のシス転写調節領域(成熟エンハンサー)が存在する可能性が示されました注2)。そこで研究チームは、「Cd4成熟エンハンサー」の同定を目的として、研究をスタートさせました。
- 注1) Taniuchi I, et al. "Differential requirements for Runx proteins in CD4 repression and epigenetic silencing during T Lymphocyte development", Cell 111: 621-633, (2002)
- 注2) Chong MM, et al. "Epigenetic propagation of CD4 expression is established by the Cd4 proximal enhancer in helper T cells", Genes Dev. 24: 659-669, (2010)
研究手法と成果
オープンクロマチン[9]構造のゲノム領域は、活性化したシス転写調節領域の候補となります。そこで、研究チームは、網羅的オープンクロマチン領域解析(ATAC-seq)[10]の結果より、成熟したヘルパーT細胞において、クロマチン構造が開かれる(オープンクロマチン構造)ゲノム領域を探索しました。
ここで、先行研究注3)の結果も踏まえて、Cd4サイレンサーの下流[11]に存在するオープンクロマチン構造のゲノム領域に注目し、この領域を欠損したマウスを作製しました。Cd4遺伝子の上流[11]にあるCd4近位エンハンサー(E4p)を欠損したマウスでは、未熟胸腺細胞におけるCD4発現は消失するものの、ポジティブセレクション後のヘルパーT細胞においてCD4発現が誘導されることが確認・報告されています注2)。しかし、今回作製した欠損マウス(Cd4近位エンハンサーに加え、オープンクロマチン構造のゲノム領域を欠損)では、ポジティブセレクション後のCD4の発現が完全に消失することが分かりました(図1a)。この結果から、今回発見したゲノム領域はポジティブセレクション後に活性化されるエンハンサー、すなわち「Cd4成熟エンハンサー(E4m)」であると結論づけました。
また、Cd4成熟エンハンサーの欠損マウスでは、ヘルパーT細胞が減り(図1b)、キラーT細胞が増えていたことから、Cd4成熟エンハンサーの欠損がヘルパー/キラーの系列決定に影響する可能性が考えられました。そこで、Cd4成熟エンハンサー欠損マウスを、β2ミクログロブリン[12]を欠損することで主要組織適合抗原複合体(MHC)[13]クラスⅠの発現が消失したマウスと交配させ、MHC クラスⅡによるポジティブセレクションを受けたT細胞の分化状況を調べました。その結果、興味深いことに、このマウスでは本来存在しないはずのキラーT細胞の出現が確認されました(図1c)。この結果は、ヘルパーT細胞になるべき細胞が、キラーT細胞へと分化したことを意味しています。すなわち、Cd4成熟エンハンサーによるCD4の発現制御は、適切なヘルパーT細胞分化に必要であることが分かりました。
- 注3) Henson DM, et al. A silencer-proximal intronic region is required for sustained CD4 expression in postselection thymocytes. J. Immunol. 192: 4620-4627, (2014)
次に、Cd4成熟エンハンサーを活性化する因子の探索を行いました。研究チームは2017年に、ChIP-seq法[14]を用いて転写因子Bcl11bのDNA結合領域を探索した際に、Bcl11bがCd4成熟エンハンサー領域に結合することを確認しています注4)。そこで、Bcl11bを活性化因子の候補として調べたところ、Bcl11bを欠損させたT細胞では、Cd4成熟エンハンサー依存的なCD4発現が大きく減弱していました(図2)。これにより、Bcl11bはCd4成熟エンハンサーの活性化に寄与する転写因子である可能性が示されました。
注4)2017年9月26日プレスリリース「T細胞分化を管理する転写制御機構を解明」
これまでの定説では、「細胞系列特異的なCD4発現は、Cd4サイレンサーとサイレンサーに結合するRunxによって制御される」と考えられています。そこで、Cd4成熟エンハンサーが、Cd4サイレンサーおよびRunxによって制御されるか否かについて調べました。
Cd4サイレンサー機能を喪失させたマウスのキラーT細胞におけるCd4成熟エンハンサー依存的なCD4発現を調べたところ、十分なCD4発現は認められませんでした。これは、キラーT細胞において、Cd4サイレンサーによるCd4成熟エンハンサーの抑制が限定的であることを示しています(図3a)。一方、興味深いことに、Runxの遺伝子発現抑制機能を喪失させたマウスにおいては、Cd4成熟エンハンサー依存的なCD4発現が強く認められました(図3b)。これは、RunxがCd4成熟エンハンサーを直接抑制することを示しています。
すなわち、これまで考えられていた「RunxによるCd4サイレンサー依存的なCD4発現抑制に加え、RunxがCd4サイレンサー非依存的にCd4成熟エンハンサーを抑制する」という、新たなCD4発現制御機構の存在が明らかになりました。
以上の結果をまとめると、胸腺細胞分化におけるCd4遺伝子の制御機構は図4のようになります。
今後の期待
本研究は、まだ不明な点が多いT細胞分化について、ヘルパーT細胞の分化および機能発揮に重要なCD4分子を対象とし、新たな遺伝子発現制御機構を明らかにするものです。
T細胞は免疫応答の中心として働く重要な細胞であり、その分化・機能を制御することにより、さまざまな疾患の治療が可能になると考えられています。実際、ES細胞(胚性幹細胞)[1]やiPS細胞を用いた人為的なT細胞の作製による疾患治療の試みが進行しています注5)。T細胞分化を制御する機構の解明は、人為的にT細胞を作製する方法の開発につながる可能性があります。本研究の成果によって、また一つT細胞分化を制御する機構の理解が進みました。この成果が、人為的T細胞誘導による新たな治療法の開発に貢献することを期待しています。
注5)2013年1月4日プレスリリース「がん細胞を殺すT細胞をiPS細胞化し若く元気なT細胞に再生」
原論文情報
- Satoshi Kojo, Nighat Yasmin, Sawako Muroi, Mari Tenno, Ichiro Taniuchi, "Runx-dependent and silencer-independent repression of a maturation enhancer in the Cd4 gene", Nature Communications, 10.1038/s41467-018-05803-3
発表者
理化学研究所
生命医科学研究センター 免疫転写制御研究チーム
チームリーダー 谷内 一郎 (たにうち いちろう)
上級研究員 香城 諭(こうじょう さとし)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.iPS細胞(人工多能性幹細胞)、ES細胞(胚性幹細胞)
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞である。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞に Oct3、 Sox2、 Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞のこと。 - 2.ヘルパーT細胞
免疫応答に関与するリンパ球、T細胞の一種。抗原の情報をB細胞へ伝えて抗体の産生を誘導したり、免疫応答を誘導する液性因子を放出することにより、免疫反応の司令塔として働く。CD4という細胞表面分子を発現することを特徴とし、ThPOKという転写因子によって分化が制御されている。 - 3.シス転写調節領域、エンハンサー、サイレンサー
シス転写調節領域は、遺伝子の上流や下流に位置し、遺伝子の転写を調節する領域のこと。転写の誘導に必要なプロモーター領域、転写効率を著しく高めるエンハンサー領域、転写を抑制するサイレンサー領域などが該当する。 - 4.キラーT細胞
免疫細胞の一種で細胞傷害性T細胞とも呼ばれる。ウイルス感染細胞やがん細胞など宿主にとって異物となる細胞を認識して破壊する。Runx3という転写因子によって分化が制御されている。CD8という細胞表面分子を発現することを特徴とする。 - 5.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子のシス転写調節領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。 - 6.胸腺
T細胞が作られる臓器で心臓の上に位置している。骨髄から移動してきた前駆細胞が、胸腺の中でT細胞へと分化・成熟する。 - 7.ポジティブセレクション
胸腺において、機能的なT細胞を選別するイベントの一つ。CD4およびCD8を共に発現する未熟な胸腺細胞(CD4/CD8 double positive: DP)より、主要組織適合抗原複合体(MHC)クラスⅠを認識するT細胞受容体を発現する細胞はキラーT細胞へ、MHCクラスⅡを認識するT細胞受容体を発現する細胞は、ヘルパーT細胞へ分化が誘導される。 - 8.T細胞受容体
T細胞の表面に発現している受容体。主要組織適合抗原複合体(MHC)上に提示された抗原を認識する。α鎖とβ鎖の2本鎖にて構成されており、それぞれのT細胞が一つの抗原に特異的なT細胞受容体を発現する。膨大なT細胞受容体の多様性は、T細胞受容体遺伝子の再構成によって形成される。 - 9.クロマチン
ゲノムDNAがヒストンタンパク質を代表としたタンパク質に巻き付くことで形成するDNA・タンパク質複合体。 - 10.網羅的オープンクロマチン領域解析(ATAC-seq)
ゲノムワイドにオープンクロマチン領域を探索する手法。開いたクロマチン領域は、活性化状態にあるシス転写調節領域に高頻度に観測されるため、シス転写調節領域の状態把握や新たなシス転写調節領域の探索などに応用可能である。 - 11.下流、上流
ゲノム上で遺伝子の読まれる方向と同じ向きを下流、逆の向きを上流と呼ぶ。 - 12.β2ミクログロブリン
主要組織適合抗原複合体(MHC)クラスⅠと会合するタンパク質。β2ミクログロブリンを欠損したマウスでは、MHCクラスⅠが細胞膜へと搬送されず、細胞表面のMHCクラスⅠ発現を欠く。その結果、MHCクラスⅠによるポジティブセレクションが行われず、キラーT細胞が消失する。 - 13.主要組織適合抗原複合体(MHC)
構成される分子から、クラスⅠとクラスⅡに分類される。T細胞受容体は、MHC上に提示される抗原を認識する。主として、MHCクラスⅠは細胞内の抗原(ウイルスや細菌成分など)、MHCクラスⅡは細胞外の抗原(外来の異物)をT細胞へ提示する。遺伝的な背景により、MHCには多型性があり、臓器移植の差異には、MHCが異なると拒絶反応が生じることから、主要組織適合抗原と呼ばれている。 - 14.ChIP-seq法
ゲノムへのタンパク質結合を網羅的に解析する手法。目的のタンパク質が結合したクロマチンを、タンパク質特異的抗体によって免疫沈降することによってDNAを回収する。回収したDNA断片を、次世代シーケンサーを用いて解読する。
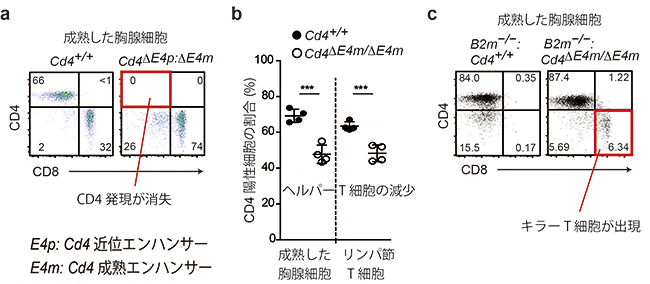
図1 Cd4成熟エンハンサーの同定とT細胞分化への関与
- a) Cd4近位エンハンサー(E4p)とCd4成熟エンハンサー(E4m)の両方を欠損したマウスの成熟した胸腺細胞では、CD4の発現は完全に消失していた。
- b) E4m欠損マウスの成熟した胸腺細胞では、成熟した胸腺細胞でもリンパ節T細胞でも、ヘルパーT細胞の減少が確認された。図中「***」は 統計学的に有意な減少(p<0.001)を示す。
- c) E4mを欠損させることによって、β2ミクログロブリン欠損マウスの成熟した胸腺細胞では(右)、キラーT細胞の出現が確認された。
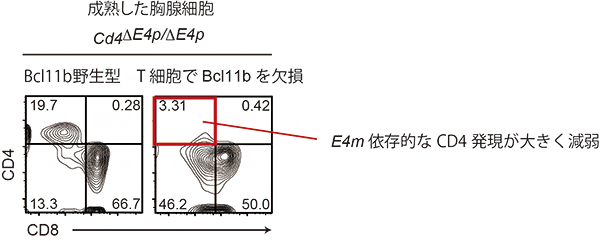
図2 転写因子Bcl11bによる成熟エンハンサーの活性化
成熟した胸腺細胞において、T細胞だけBcl11bを欠損させると(右)、ヘルパーT細胞におけるCD4の発現、すなわちCd4成熟エンハンサー(E4m)依存的なCD4発現が大きく減弱した。
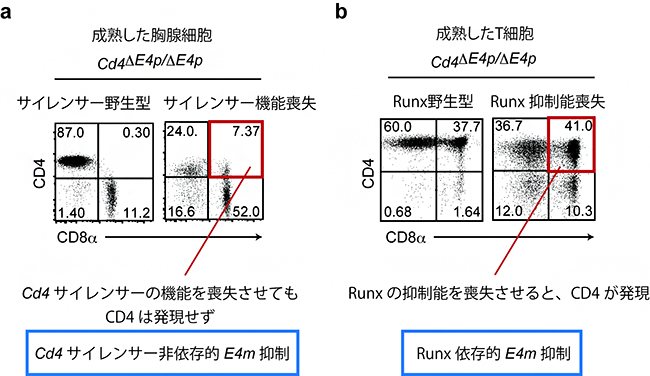
図3 キラーT細胞におけるCd4サイレンサー非依存的・Runx依存的なE4m機能抑制
- a) Cd4サイレンサー機能を喪失させたマウス(右)の成熟したT細胞では、キラーT細胞におけるCd4成熟エンハンサー(E4m)依存的なCD4の発現はわずかであった。これは、キラーT細胞において、Cd4サイレンサー非依存的にE4mが抑制されることを示す。
- b) Runxの遺伝子発現抑制能を喪失させたマウス(右)の成熟したT細胞では、キラーT細胞において、E4m依存的なCD4の発現が強く認められた。これは、Runx依存的にE4mが抑制されることを示す。
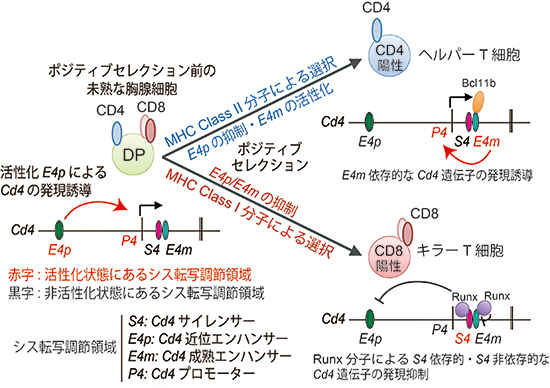
図4 胸腺細胞分化におけるCd4遺伝子制御機構
未熟な胸腺細胞(CD4/CD8 double positive; DP)におけるポジティブセレクションの後、ヘルパーT細胞では転写因子Bcl11bによってCd4成熟エンハンサー(E4m)が活性化され、Cd4遺伝子発現が安定化する。一方、キラーT細胞では、転写因子RunxによるCd4サイレンサー(S4)依存的(E4p)・Cd4サイレンサー非依存的(E4m)な機構によって、Cd4遺伝子の発現が強く抑制される。
