理化学研究所(理研)生命機能科学研究センター無細胞タンパク質合成研究チームの清水義宏チームリーダー、下條優研修生らの共同研究グループは、細胞内においてタンパク質合成を担う分子複合体である「リボソーム小サブユニット」の全構成要素の包括的解析に向け、大腸菌のリボソーム小サブユニットを自由に改変できる試験管内再構成系を開発しました。
本研究成果は、リボソームの構造や機能、細胞内でリボソームがどのように形成されるかなどの理解、リボソームの改変を通じたタンパク質の生産手段の向上や、細胞を人工的に作り出す人工細胞研究、生命がどのように誕生したかを調べる生命起源の研究などに貢献すると期待できます。
従来のリボソームの試験管内再構成の多くは、細胞から取得したリボソームを一旦ばらばらにしてそれを元に戻すという手法であったため、リボソームを構成する個々の要素の働きを詳細に解析することは困難でした。
今回、共同研究グループは、大腸菌由来の57種類の組換えタンパク質[1]で構成される無細胞転写/翻訳システム[2]を用いて、リボソーム小サブユニットの試験管内再構成とその活性検出を可能とする「R-iSAT(fully Recombinant-based integrated Synthesis, Assembly, and Translation)」を開発しました。R-iSATを用いて、リボソーム小サブユニットに存在する個々の要素(16S rRNA[3]と21種類のリボソームタンパク質)を包括的に解析できることを示しました。
本研究は、科学雑誌『Communications Biology』の掲載に先立ち、オンライン版(3月25日付)に掲載されます。
試験管内でリボソームの再構成とそれに伴うタンパク質合成を一挙に行う「R-iSAT」
背景
リボソームは、細胞内のタンパク質合成反応において中心的な役割を果たす分子複合体です。リボソーム上では、遺伝子配列にしたがって、アミノ酸が一つずつ付加され、数百~数千のアミノ酸が直鎖状につながったタンパク質が合成されます(図1)。がん治療薬としても用いられる抗体タンパク質や薬剤の標的となる膜タンパク質など、生体内に存在するほぼ全てのタンパク質はリボソーム上で合成されます。そのため、リボソームは、生命が生命として存在するための最も基本的な分子複合体の一つといえます。
リボソームは大小二つのサブユニットから構成されており、それぞれのサブユニット自体も複数の要素からなる複雑な複合体です。代表的なモデル真正細菌[4]である大腸菌のリボソーム小サブユニットは、1種類のリボソームRNA(16S rRNA)と21種類のリボソームタンパク質からなります。一方、大サブユニットは二つのリボソームRNA(5S rRNA、23S RNA)と33種類のリボソームタンパク質からなります(図1)。
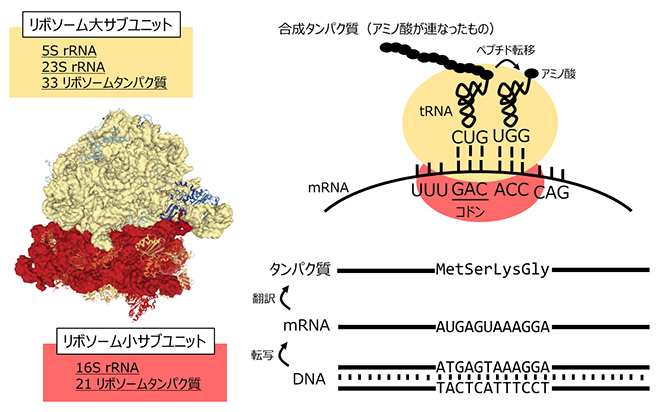
図1 リボソームによるタンパク質合成の仕組み
リボソームは大小二つのサブユニットからなり、大サブユニットは二つのリボソームRNA(5Sおよび23S rRNA)と33種類のリボソームタンパク質より構成され、小サブユニットは一つのリボソームRNA(16S rRNA)と21種類のリボソームタンパク質より構成される。リボソームでは、DNA配列から転写されたメッセンジャーRNA(mRNA)の配列にしたがってアミノ酸の重合が進み、タンパク質が合成される。図中、ATGAGTAAAGGAという配列は、AUGAGUAAAGGAという配列を持つmRNAに転写され、遺伝暗号表にしたがってMet-Ser-Lys-Glyというアミノ酸配列に翻訳される。リボソームの三次元構造はタンパク質構造データバンク(PDB)のID番号4V65より取得した。
リボソームが細胞内でどのように形成されるのか、またリボソームを構成する個々の要素がどのような働きをするかについては、実に50年以上にわたる研究の歴史がありますが、いまだに全容は解明されていません。その理由の一つに、リボソームを研究者自らの手で分子的に再現すること(試験管内再構成)が難しい点が挙げられます。
リボソームの試験管内再構成はこれまでも行われてきましたが、それらの多くは細胞から取得したリボソームを一旦ばらばらにしてそれを元に戻すという手法が用いられていたため、リボソームを構成する個々の要素の働きを詳細に解析することが困難でした。そこで共同研究グループは、リボソームをばらばらにすることなく個々の要素を自由に改変できるようにするため、リボソームタンパク質を組換えタンパク質として用意し、試験管内で小サブユニットを再構成させ、さらに再構成させたリボソームの活性検出までを一つの試験管内で行う手法の開発に取り組みました。
研究手法と成果
- (1)
リボソーム小サブユニットの完全試験管内再構成系「R-iSAT」の開発
共同研究グループは、無細胞転写/翻訳システムであるPUREシステム[5]に着目しました。PUREシステムはリボソームの大小のサブユニットを含み、タンパク質合成(翻訳)ができるほか、転写酵素[6]を含むためDNAからのRNA合成反応(転写)も行うことができます。
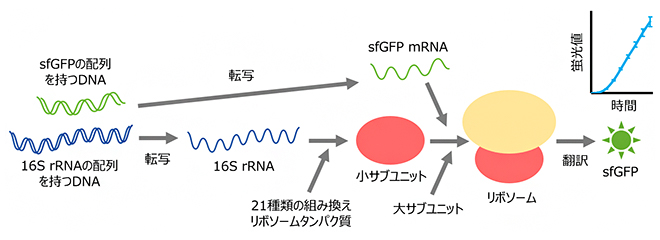
この性質を利用し、PUREシステムのリボソーム小サブユニットの代わりに16S rRNAの配列を持つDNA断片と、組換えタンパク質として用意した21種類のリボソームタンパク質を加えました。そして、緑色蛍光タンパク質(GFP)を改変したsfGFP[7]の配列を持つDNA断片をPUREシステムに投入しました(図2、灰色で囲っていない部分)。
すると、転写酵素によって16S rRNAが合成され、それに21種類のリボソームタンパク質が結合し、小サブユニットが形成されます。形成された小サブユニットは、あらかじめ入れておいた大サブユニットと結合し、リボソームが形成されます。形成されたリボソームは、転写反応によって合成されたsfGFPの配列を持つメッセンジャーRNA(mRNA)と結合し、sfGFPタンパク質の合成が開始されます。
このようにして合成されたsfGFP由来の蛍光を指標に、形成されたリボソームの活性を測定しました(図2、右上)。時間が経つにつれて蛍光値が上昇していったことから、PUREシステム内で形成されたリボソームが問題なく機能していることが確認できました。
共同研究グループは、これらの実験を行うことによって構築した系を「R-iSAT(fully Recombinant-based integrated Synthesis, Assembly, and Translation)」と名付けました。R-iSATは、PUREシステムに用いられている36種類の組換えタンパク質と小サブユニットの再構成に用いた21種類の組換えタンパク質の合計57種類の組換えタンパク質による、世界で初めての完全再構成システムとして構築されました。
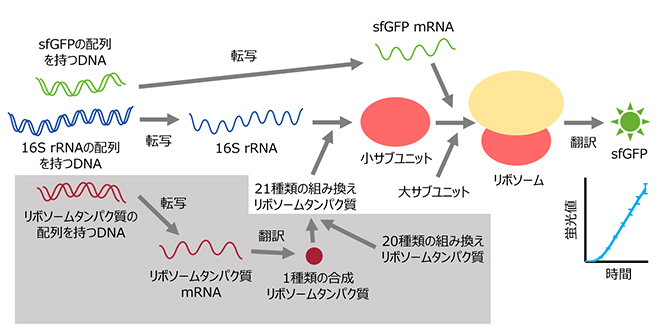
図2 R-iSATを用いたリボソームの再構成
R-iSATでは、2種類のDNAおよび21種類の組換えリボソームタンパク質をPUREシステムに加え、小サブユニットの再構成と形成された小サブユニットによるsfGFPの合成を同時に行う。灰色で囲った部分は、(2)に記載したリボソームタンパク質合成をR-iSATに組み込んだ際に必要となる要素。
- (2)
R-iSATへのリボソームタンパク質合成の組み込み
R-iSATの構築により、例えば、16S rRNAの配列を持つDNA配列を書き換えることで変異を導入し、16S rRNAの特定の場所がどのような機能を持っているかを調べることができます。一方、リボソームタンパク質は組換えタンパク質として別途用意していますが、R-iSATにリボソームタンパク質の試験管内合成を組み込むことができれば、改変したリボソームタンパク質の機能をより簡便に調べられるようになると考えられます。
そこで、R-iSATに加える21個のリボソームタンパク質から一つだけ除き、その代わりに、除いたリボソームタンパク質の配列を持つDNAを加え、小サブユニットを形成させる実験を行いました(図2、灰色で囲った部分)。その結果、リボソームタンパク質の配列を持つDNAを加えたときだけ、sfGFPの蛍光が観察され、リボソームタンパク質の試験管内合成の組み込みに成功したことが示されました。なお、この実験では、細胞から取得した小サブユニット(野生型小サブユニット)を用いており、野生型小サブユニットでリボソームタンパク質を合成し、新しく形成させた小サブユニットでのみ、sfGFPを合成できるように、16S rRNAの配列に工夫を加えています。
- (3)
R-iSATを用いたリボソームタンパク質の機能解析
R-iSATにリボソームタンパク質合成を組み込むことによって、リボソームタンパク質のDNA配列に変異を導入し、そのリボソームタンパク質がどのような機能を持っているかを調べることができます。そこで、抗生物質ストレプトマイシン[8]耐性を持つとされるリボソームタンパク質uS12[9]の1アミノ酸変異体を用いることで、抗生物質耐性を持つ小サブユニットを形成できるか、確認しました。その結果、変異のないuS12(野生型)を合成した場合は、抗生物質の存在下ではsfGFPの合成ができないのに対して、変異体のuS12を合成した場合は、sfGFPの合成が観察されました(図3)。このことから、R-iSATを用いてさまざまなリボソームタンパク質の機能を解析できることが示されました。
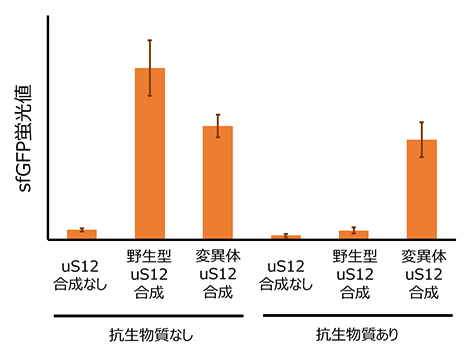
図3 R-iSATを用いたリボソームタンパク質の機能解析
抗生物質(ストレプトマイシン)を入れない場合は、リボソームタンパク質uS12の合成に依存して、野生型・変異体ともにsfGFPの蛍光値の上昇が観察されたが、抗生物質を入れた場合は変異体uS12を合成した場合のみsfGFPの蛍光値の上昇が観察された。
今後の期待
R-iSATの構築により、リボソームRNAまたはリボソームタンパク質をさまざまな形に置き換え、それらを元に小サブユニットを実際に作って調べることができるようになりました。このことは、小サブユニットの全要素を包括的に解析できることを示すものであり、リボソームの構造や機能、また細胞内でリボソームがどのように形成されるのかなど、さまざまな情報を得ることにつながります。
また、リボソームは、医薬品や工業製品など私たちの生活に欠かせないタンパク質を生産するための基礎となる分子複合体であるため、より活性の高いリボソームを作ることによって、タンパク質の生産手段の向上にも大きく寄与する可能性があります。
さらに、リボソームが形成されるプロセスを正確に知ることによって、細胞を人工的に作り出す人工細胞研究や、生命がどのようにして誕生したかを調べる生命起源の研究への展開にも期待できます。
補足説明
- 1.組換えタンパク質
特定のタンパク質を、大腸菌などの細胞を用いて人為的に合成する技術を用いて作られたタンパク質。 - 2.無細胞転写/翻訳システム
細胞内のRNA合成過程(転写)およびタンパク質合成過程(翻訳)を、試験管の中で再現する技術。DNA分子を試験管の中に添加することにより、DNAからRNAへの転写およびRNAからタンパク質への翻訳反応が起こり、最終的にDNAにコードされたタンパク質やペプチドを合成できる。 - 3.16S rRNA
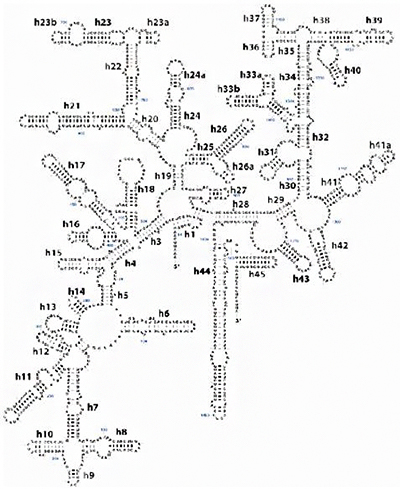
リボソーム小サブユニットを構成するリボソームRNA(rRNA)。構造は下図参照のこと。真正細菌のrRNAはその大きさによって5S、16S、23Sの三種類があり、16Sは約1500塩基からなる。Sは遠心分離にかけたときの沈降係数の単位(スベドベリ)に由来し、値が大きいほど粒子が大きいことを示す。
- 4.真正細菌
生物を大きく分類すると、真正細菌・古細菌・真核生物の三種類に分類される。ヒトを含む我々が目にするほとんどの生物は真核生物として分類される一方、真正細菌は、大腸菌や乳酸菌、納豆菌などを含む生物群であり、細菌類とも呼ばれる。 - 5.PUREシステム
無細胞転写/翻訳システムの中でも、必要な要素のみ(翻訳開始因子・翻訳伸長因子・翻訳終結因子など10種類、アミノアシルtRNA合成酵素20種類、転写酵素1種類、その他エネルギー再生酵素など5種類)を一つずつ組換えタンパク質として精製し、試験管内において再構成する技術。PUREはProtein synthesis Using Recombinant Elementsの略。 - 6.転写酵素
DNAからRNAへの転写反応を行う酵素。 - 7.sfGFP
オワンクラゲ由来の緑色蛍光タンパク質として知られているGFPを改変したもので、Superfolder GFPの略である。タンパク質は合成されてから正しい立体構造を形成する(フォールディング)までに時間を要する。sfGFPは、合成されてからフォールディングされるまでの時間が短くなるように改変されたもので、本実験では新しく形成されたリボソームで合成されたタンパク質を短時間で高感度に検出することに利用した。 - 8.抗生物質ストレプトマイシン
抗生物質は大腸菌などの微生物の生育を阻害する物質の総称。ストレプトマイシンは抗生物質の一種で、リボソームに結合し、タンパク質合成を阻害する。 - 9.リボソームタンパク質uS12
21種類あるリボソームタンパク質のうちの一つ。野生型のuS12はストレプトマイシンによって、その機能が阻害されることが分かっている。
共同研究グループ
理化学研究所生命機能科学研究センター 無細胞タンパク質合成研究チーム
チームリーダー 清水 義宏(しみず よしひろ)
研究員 益田 恵子(ますだ けいこ)
研修生 下條 優(しもじょう まさる)
(東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻 博士過程2年)
東京大学 新領域創成科学研究科 メディカル情報生命専攻
教授(研究当時) 上田 卓也(うえだ たくや)
(現 早稲田大学大学院 先進理工学研究科 生命理工学専攻 教授)
助教(研究当時) 網藏 和晃(あみくら かずあき)
(現 イェール大学 研究員)
ジーンフロンティア株式会社
研究員 金森 崇(かなもり たかし)
研究支援
本研究は、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)「A PURE-ly synthetic ribosome biogenesis in DNA compartments on a chip(研究代表者:清水義宏)、自然科学研究機構(NINS)アストロバイオロジーセンタープロジェクト研究「試験管内リボソーム再構成から迫る遺伝暗号の起源(研究代表者:清水義宏)」、「全ての生命が普遍的に有する翻訳系の起源(研究代表者:網藏和晃)」、日本学術振興会(JSPS)科学研究費補助金 新学術領域研究(研究領域提案型)「翻訳鋳型核酸の部位特異的大規模解析によるセントラルドグマが持つ高次性の解明(研究代表者:清水義宏)」、同若手研究(B)「初期生命が用いたタンパク質のみから構成される人工ゲノムの合成(研究代表者:網藏和晃)」による支援を受けて行われました。
原論文情報
- Masaru Shimojo, Kazuaki Amikura, Keiko Masuda, Takashi Kanamori, Takuya Ueda, Yoshihiro Shimizu, "In vitro reconstitution of functional small ribosomal subunit assembly for comprehensive analysis of ribosomal elements in E. coli", Communications Biology, 10.1038/s42003-020-0874-8
発表者
理化学研究所
生命機能科学研究センター 無細胞タンパク質合成研究チーム
チームリーダー 清水 義宏(しみず よしひろ)
研修生 下條 優(しもじょう まさる)
 清水 義宏
清水 義宏
 下條 優
下條 優
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
