理化学研究所(理研)生命機能科学研究センター発生幾何研究チームの森下喜弘チームリーダー、大塚大輔上級研究員、川平直史大学院生リサーチ・アソシエイト(研究当時、現 京都大学大学院医学研究科博士課程大学院生)らの共同研究チームは、心臓[1]の初期発生で見られる左右非対称の「ループ状構造」が、心臓を作る「細胞そのものの再配列」という内因的かつ動的な要因により形成されることを明らかにしました。
本研究成果は、「臓器の形がどのように作られるのか」という生物学上の根本問題を、実験と理論の融合研究、および組織と細胞という異なる階層間の定量比較解析で解き明かしたものです。今後、同様の解析が、心臓以外の臓器や、先天性疾患・奇形の発生機序の解明に応用されると期待できます。
今回、共同研究チームは、発生のある時刻での形から次の時刻で見られる心臓の形の変化の過程を詳細に追跡し、その背後にある細胞プロセスの解明を目指しました。ニワトリ胚の心臓初期発生における形態形成過程(ループ状構造ができる過程)について、二光子顕微鏡[2]による四次元(空間三次元+時間一次元)計測と数理解析を行いました。その結果、「心筒[1]」と呼ばれる原始心臓内の組織が、左右で異なる方向に伸長することで左右非対称のループ状構造が形成されること、そしてその主な要因が特に右側の心筋細胞集団が特定方向に再配列するためであることを突き止めました。これは、従来の心臓形成モデルが前提とした、空間的な制約や外部組織からの細胞流入ではなく、心臓を構成する細胞の「集団運動」が左右非対称な心臓を形作ることを示した重要な発見です。
本研究は、科学雑誌『Cell Reports』オンライン版(3月17日付:日本時間3月18日)に掲載されました。
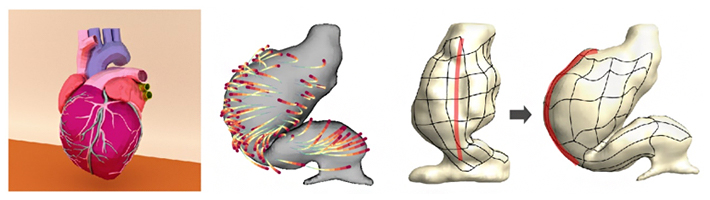
発生初期の心臓の外形変化と細胞の軌道計測に基づく組織変形動態の再構成
背景
私たちの体を構成する各臓器は、たくさんの細胞が集まった一つの集合体として、しばしば非常に複雑な構造を持ち、機能を発揮します。発生中の胚において、各臓器の正常な形がどのように作られるのかを理解することは、先天性疾患や奇形の発生機序を知るための基礎情報として重要です。また、その知見は、機能的な臓器形態のデザインや制御技術の開発へも展開できることから、生物学の長い歴史の中でも重要な課題の一つとなっています。
この課題に対して生物学者は、これまで発生中の臓器の形を観察することで答えようとしてきました。しかし、時間とともに変化する形のスナップショットを撮って並べただけでは、見た目の変化は分かっても、ある時刻の形から次の時刻で見られる形への変化を表すための動的な情報(変形ダイナミクス)を得られません。理論上は、二つの異なる形をつなぐ変換方法は無数に存在するからです。また、仮に組織の変形ダイナミクスが明らかになっても、それがどのような細胞の振る舞いによって実現されているか自明とはいえません。細胞の増殖頻度や分裂方向、細胞の大きさや形状の変化、細胞集団運動など、同じ変形を実現するための細胞プロセスにも複数の可能性があるからです。
心臓は、複雑かつ左右非対称な三次元構造を持つ臓器です。その発生は、「心筒」と呼ばれる真っすぐな管状の構造の形成から始まり、それが体の右側に飛び出した「ループ状構造」へと変化し、明確な左右非対称性が現れます。このプロセスは、心筒がCの字となることから「Cルーピング[1]」と呼ばれます(図1)。
これまで、Cルーピングを説明するための二つの有力なモデルが広く受け入れられてきました(図1)。一つは、心筒がまず腹側に曲がり、飛び出した後に右側に回転するという「Ventral bending and rotationモデル」、もう一つは、心筒が限られた体内空間において長軸方向に伸び、両端からかかる力が徐々に増大することにより、急激に大きくたわむという「Physical Bucklingモデル」です。これらのモデルはいずれも、心筒の長軸伸長と心筒の両端における境界条件(心臓に接続する血管からもたらされる左右非対称な細胞の流入や力の負荷)が、右側へのループを引き起こす主要なメカニズムであると仮定しています。
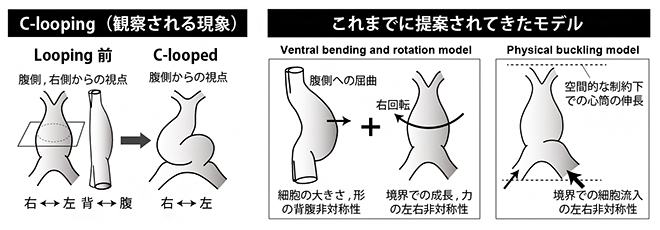
図1 心筒のCルーピングとこれまでに提案されてきたモデル
- 左)心臓の初期発生の模式図。初期の心臓(心筒)は、血管に似た1本の管状の構造から、「Cルーピング」により左右非対称な形へと変形する。
- 右)Cルーピングを説明するために提案された二つのモデル。「Ventral bending and rotationモデル」では、心筒がまず腹側に曲がり、飛び出した後に右側に回転する。「Physical Bucklingモデル」では、心筒が限られた体内空間において長軸方向に伸びることで、その圧力に耐えられず大きくたわみループする。
近年の顕微鏡技術やデータ解析技術などの進歩は、こうした過去に提案されてきた仮説モデルのどちらが正しいのかという問題に対する、客観的なアプローチを可能にしつつあります。特に、発生初期の臓器は数千個の細胞がもととなって形を作っており、そこで起きている細胞の振る舞いを1細胞の解像度で計測・解析することが可能となりました。心臓の発生を高解像度で4次元(空間3次元+時間1次元)観察することは、これまで困難でした。しかし、共同研究チームは、心臓のライブイメージングと、先行研究で開発した細胞軌道情報から臓器形態の変形過程を再構築する数理的手法注1)を用いて、心臓の初期の形ができるCルーピングを組織レベルと細胞レベルの二つのスケールから明らかにすることを目標としました。
- 注1)2017年5月2日プレスリリース「臓器が形作られる過程を復元する計算手法を開発」
研究手法と成果
発生中の心臓の変形過程を算出するためには、臓器の形状データと、内部の細胞の軌跡データが必要となります。共同研究チームは、ヒトと同じ二心房二心室型[1]の心臓を持ち、器官発生の観察が容易なニワトリ胚を用いました。心筒を蛍光色素で、心筒を構成する心筋細胞を蛍光タンパク質[3]で、それぞれ異なる色でラベルし、二光子顕微鏡によるタイムラプスイメージング[4]を行いました。
まず、Cルーピングの過程をさまざまな方向から観察することで従来のモデルの検証を試みたところ、「Ventral bending and rotationモデル」が提唱する心筒の腹側への屈曲は、実際にはごくわずかにしか起きていないことが分かりました。また、心筒は全体として確かに右側へと回転しますが、心筋細胞ごとの回転量は、場所によって異なっていることも分かりました(図2左)。これらの観察結果から、Cルーピングは固いチューブが一体となって折れ曲がったり回転したりするような単純な現象ではなく、心筒そのものの変形を伴うものである可能性が示されました。
そこで、計測データをさらに詳細に解析し、Cルーピングが起こる際の心筒の変形過程を再構成し、局所的な変形量を求めました。その結果、心筒を構成する左右の心筋組織が異なる方向に伸長していることが分かりました。右側では、心筋組織が心筒の長軸方向に沿って伸びるのに対し、左側では、心筒の周長に近い方向に伸びることで、ループ状構造が形成されることが明らかになりました(図2右)。
これまで想定されていた二つのモデルでは、心筒左右両端からの細胞流入による長軸方向への伸長と、心筒の頭側および尾側での境界条件(接続する血管からもたらされる左右非対称な細胞の流入や力の負荷)がループ形成に重要だと考えられていましたが、今回の解析結果は、境界条件の重要性よりはむしろ、心筒を構成する組織自体が異なる方向へダイナミックに変形することでループ状構造が形成されることを示しています。
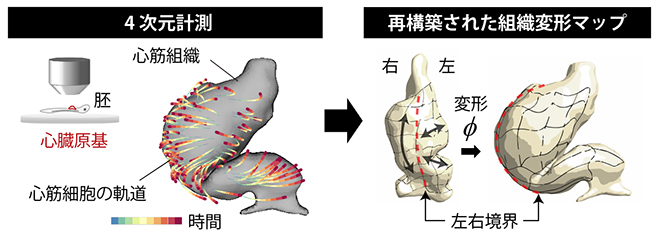
図2 心臓発生過程の4D計測と組織変形動態解析
- 左)二光子顕微鏡によるタイムラプスイメージングにより観測した、心筋細胞の軌跡と心臓原基(原始心筒)の外形。Cルーピング後の細胞の位置(赤)が、Cルーピング前(青)からどのような軌跡(青→赤)で移動したかを示した。
- 右)ラベルされた心筋細胞をランドマーク(目印)とし、その位置変化情報から組織全体の変形動態を再構築した「組織変形マップ」。外形変化を見るだけでは分からない、内部組織の動きを定量的に評価できる。赤点線は、Cルーピング前の心筒の正中線を示し、Cルーピング後に大きく右側に移動したことが分かる。黒矢印は、Cルーピングに伴って生じた組織変形の方向を示す。
次に、左右の組織が異なる方向に伸長するのは、どのような細胞プロセスによって実現されているのかを知るために、考えられるさまざまな細胞の振る舞い(細胞の増殖、細胞の大きさ・形の変化、細胞の再配列、細胞死)をそれぞれ測定しました。過去の研究での重要な知見から、細胞増殖や細胞死がCルーピングに与える影響は少ないことが示されています。事実、本研究でも、細胞増殖を止めてもCルーピングが起きることを確認しました。そこで、細胞の大きさ・形の変化と、細胞の再配列のそれぞれが、左右で異なる組織変形量にどれくらい寄与するかを算出しました。その結果、右側の心筋組織では、細胞が並び替わることによる「細胞の再配列」が長軸方向の伸長に大きく寄与し、左側の心筋組織では、「細胞の形状変化」が心筒の周長に近い方向への変形に大きく寄与することが明らかになりました(図3)。
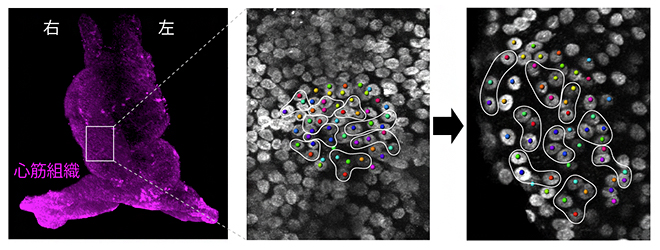
図3 心筒右側組織で見られる細胞の再配列による前後軸への組織伸長
- 左)脂質二重膜に結合する色素で心筒を染色し、二光子顕微鏡で腹側から観察した図。心筒の長さは約300マイクロメートル(μm、1μmは1,000分の1mm)。
- 中)Cルーピングが起きる前の右側組織の心筋細胞の位置。隣接する3~4つの細胞を色分けし、曲線で囲んだ。
- 右)(中)で示した細胞のCルーピング後の位置。心筒の長軸方向への再配列が起きたことが分かる。
細胞の再配列は、形態形成のさまざまな場面で観察される現象であり、細胞骨格であるアクチン[5]が関与していることが知られています。また先行研究では、アクチン重合を阻害するとCルーピングが起きずに、心筒が左右対称な太い管となることが示されています注2)。そこで、心筋細胞のアクチン重合を実験的に阻害し、そのときの細胞の振る舞いを調べてみると、右側組織で見られていた心筒の長軸方向の伸長をもたらす細胞の再配列が消失しました。このことから、Cルーピングは、アクチン重合に依存して細胞集団が頻繁に並び変わる「細胞の再配列」で実現されていることが明らかになりました。この結果は、一度形成された心筋組織の管が、静的に保たれているのではなく、管を形成する心筋細胞集団が次々と並び変わることで自ら形を作っているという、従来想定されていたモデルよりもはるかにダイナミックな描像を明らかにしました。
- 注2)Manasek, F.J., Burnside, B., and Stroman, J., The sensitivity of devel- oping cardiac myofibrils to cytochalasin-B (electron microscopy-polarized light-Z-bands-heartbeat). Proc. Natl. Acad. Sci. USA 69, 1972.
今後の期待
本研究は、器官形成の過程を細胞レベルの実験研究と数学的な理論研究を組み合わせることで、心臓初期発生での組織・細胞のダイナミクスを初めて明らかにしました。得られた結果は、発生学の教科書に書かれている従来のモデルとは異なり、細胞の再配列の重要性を見いだした発見であり、現象の背後にある真の仕組みを明らかにするためには、定量的な計測と解析が不可欠であることを示しています。
一方、なぜ左右の組織で細胞の集団運動様式が変わるのか、という問いについては未解明のままです。右側組織で見られる一方向的な細胞の再配列は、アクチン依存的に起こる現象であること、またアクチンは細胞への力学刺激応答に関わることから、共同研究チームは力学シミュレーションを行い、心筋組織の左右で力学応答能が異なるという新たなモデル[6]を提案しました。今後、組織内応力の計測や操作の技術が進展することで、このアイデアの実験的な検証が可能になると期待できます。
ヒトを含む脊椎動物のほとんどの臓器に対して、その形がどのように形成されるのかは分かっていません。本研究で行った研究アプローチを他臓器にも応用することで、臓器固有の、あるいは臓器間で共通した形づくりの仕組みや、それを担う重要な細胞プロセスが何であるかが、今後明らかになっていくことが期待できます。また、正常発生だけでなく発生異常についても解析することで、これまでに明らかとなってきた疾患・奇形関連遺伝子が、具体的にどのように細胞、組織のスケールで臓器形成に影響するかという問題にアプローチすることが可能であり、これまでの分子生物学的知識を補完することで疾患の発生機序の解明に大きく貢献することが期待できます。
補足説明
- 1.心臓、Cルーピング、心筒、二心房二心室型
脊椎動物の「心臓」は、心臓外から血液が流入する心房と、心房からの血液を心臓外に送り出す心室で構成される。発生初期の心臓は「心筒」と呼ばれ、1本の管状構造の頭側に予定心室、尾側に予定心房を持つ「一心房一心室」状態である。発生が進むと、正中線上にあった心筒は体の右方向にループしてC字型になり(「Cルーピング」)、さらに心室が尾側に下がっていくことで、心房が頭側に位置するようになる。魚類では、このまま一心房一心室型の心臓を発生させるが、鳥類や哺乳類では、心臓の内部構造が発達し、体循環と肺循環を分ける「二心房二心室型」の心臓となる。 - 2.二光子顕微鏡
一般の蛍光顕微鏡法では、蛍光色素は1個の光子を吸収して蛍光を発する(一光子励起法)。これに対し、蛍光色素が2個の光子を同時に吸収して励起状態へと遷移し、蛍光を発する「二光子吸収」現象を応用したものを二光子顕微鏡と呼ぶ。二光子顕微鏡では蛍光物質に一光子励起の半分のエネルギー(2倍の波長)の光子を2個吸収させるため、長波長帯域のレーザーを用いる。長波長の光は、組織など透過性が低い試料の内部に浸透しやすいことから、二光子顕微鏡は心臓のような生体深部の観察に向いている。 - 3.蛍光タンパク質
特定波長の光で励起され、蛍光を発するタンパク質。さまざまな蛍光タンパク質をコードする遺伝子が発見・開発されている。本研究では、蛍光タンパク質EGFPを発現するベクターを電気穿孔法でニワトリ胚に導入し、心臓の細胞を標識した。 - 4.タイムラプスイメージング
経時的に撮影を行い、時間経過を画像で記録する手法。本研究では、培養したニワトリ胚の3次元画像を2時間ごとに撮影することで、心臓発生の4次元(空間3次元+時間1次元)計測を行った。 - 5.アクチン
重合して繊維状の構造を作るタンパク質。単量体をG-アクチン、重合体をF-アクチンと区別して呼ぶ場合がある。細胞骨格として機能するともに、運動、収縮をつかさどる。アクチン同士が重合、または脱重合することにより、細胞の形態や運動が制御される。 - 6.力学応答能が異なるという新たなモデル
心筒内に弱い静水圧が存在するという条件下で力学シミュレーションを行うと、心筒を構成する心筋組織は、左右ともに周長方向に引張応力を受けていると予想された。これは実験的に観察されたアクチンの配向性と一致した。そこで、力学シミュレーションによって明らかになった応力方向と、ライブイメージングデータから算出された組織の変形方向の角度を比較すると、右側組織は組織内応力と直交方向に組織が伸び、左側組織は組織内応力に平行に組織が伸びるという、「力学応答能」の差で左右非対称な心臓発生を説明するモデルが考えられた。
共同研究チーム
理化学研究所 生命機能科学研究センター 発生幾何研究チーム
チームリーダー 森下 喜弘(もりした よしひろ)
上級研究員 大塚 大輔(おおつか だいすけ)
大学院生リサーチ・アソシエイト(研究当時) 川平 直史(かわひら なおふみ)
(京都大学大学院医学研究科博士課程大学院生)
研究員 木田 直樹(きだ なおき)
東京大学大学院 理学系研究科 生物科学専攻
特任助教 廣中 謙一(ひろなか けんいち)
研究支援
本研究は、本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「器官立体構築原理をデータに基づく数理モデルによって解明する-心臓発生を例に(研究代表者:森下喜弘)」、科学技術振興機構(JST)戦略的創造研究推進事業(PRESTO)「計測技術と高度情報処理の融合によるインテリジェント計測・解析手法の開発と応用(研究代表者:森下喜弘)」、武田科学振興財団医学部博士課程奨学助成「ニワトリ心発生における組織変形動態の定量解析(研究代表者:川平直史)」による支援を受けて行われました。
原論文情報
- Naofumi Kawahira, Daisuke Ohtsuka, Naoki Kida, Ken-ichi Hironaka, and Yoshihiro Morishita, "Quantitative analysis of 3D tissue deformation reveals key cellular mechanism associated with initial heart looping", Cell Reports, 10.1016/j.celrep.2020.02.071
発表者
理化学研究所
生命機能科学研究センター 発生幾何研究チーム
チームリーダー 森下 喜弘(もりした よしひろ)
上級研究員 大塚 大輔(おおつか だいすけ)
大学院生リサーチ・アソシエイト(研究当時) 川平 直史(かわひら なおふみ)
 川平 直史
川平 直史
 大塚 大輔
大塚 大輔
 森下 喜弘
森下 喜弘
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
京都大学総務部広報課 国際広報室
Tel: 075-753-5729 / Fax: 075-753-2094
Email: comms [at] mail2.adm.kyoto-u.ac.jp ※[at]は@に置き換えてください。
