理化学研究所(理研)生命医科学研究センター炎症制御研究チームの城道絢テクニカルスタッフI、田中貴志チームリーダーらの共同研究チームは、炎症反応を制御する新たな分子「PDLIM7」を発見しました。
本研究成果は、炎症性疾患や自己免疫疾患[1]の治療を目的とした、人為的な免疫制御法の開発に貢献すると期待できます。
炎症反応は感染早期の生体防御に重要な反応ですが、過剰になると炎症性疾患や自己免疫疾患を発症するため、生体は、炎症が過剰にならないように抑制するシステムを備えています。田中貴志チームリーダーらは、炎症反応に必須の核内転写因子NF-κB[2]に結合し、これをユビキチン化[3]・分解することで炎症反応を抑制する分子PDLIM2[4]を同定し、その分子メカニズムを研究してきました。
今回、共同研究チームは、PDLIM7というタンパク質が、炎症反応を収束させる新たな分子であることを発見しました。PDLIM7は、NF-κBを直接ユビキチン化してその分解を誘導するとともに、PDLIM2とも結合してこれをユビキチン化することにより、PDLIM2-NF-κB複合体のプロテアソーム[3]というタンパク質分解酵素への輸送を助けてNF-κBの分解を促進することで、より効率的に炎症反応を抑制していることが明らかになりました。
本研究は、オンライン科学雑誌『Frontiers in Immunology』(8月4日付)に掲載されました。
背景
ヒトが細菌やウイルスに感染すると、まず免疫細胞の一つである樹状細胞[5]が、細胞膜上のセンサーであるToll(トール)様受容体(TLR)[6]を使ってこれらの病原体を認識し、炎症反応という一連の免疫反応を起こし、侵入した病原体と戦います。樹状細胞による炎症反応の発動には、「NF-κB」という核内の転写因子の活性化が極めて重要であることが知られています。活性化したNF-κBは、炎症性サイトカイン[7]などの炎症反応に必要な多くの遺伝子が順序良く働くように指令を出し、炎症反応の開始と進行に必要不可欠な役割を果たしています。
ところが、このNF-κBが過剰に活性化して、免疫細胞が暴走するような状態が続くと、炎症性疾患や自己免疫疾患を発症することが報告されています。このため、正常な免疫応答を保ちながらこれら疾患の発症を防ぐには、NF-κBの活性をオンにするだけでなく、それを適切な時点でオフにするシステムが重要です。
田中貴志チームリーダーらは2007年、核内タンパク質「PDLIM2(PDZ and LIM domain protein 2)」が、樹状細胞においてNF-κBの分解を誘導することにより炎症反応を抑制することを明らかにしました注1)。つまり、NF-κBは活性化すると細胞質から核へと移行し、標的遺伝子の転写を誘導しますが、PDLIM2は、核内に移行したNF-κBにユビキチン[3]という小さなタンパク質を付加(ユビキチン化)します。ユビキチン化はタンパク質分解酵素の目印となることから、ユビキチン化されたNF-κBは、プロテアソームというタンパク質分解酵素複合体で分解され炎症反応が終息します。田中貴志チームリーダーらは、その後一貫して炎症反応の負の制御機構の分子メカニズムを研究し、樹状細胞における炎症反応の新たな制御因子の探索を行ってきました。
PDLIM2はPDZドメイン[8]とLIMドメインという特有の構造を持っており、この二つのドメインを持つタンパク質はPDZ-LIMタンパク質と呼ばれます。PDLIM2は、このうちのLIMドメインを介して、NF-κBをユビキチン化し分解に導きます。このように標的タンパク質を選別して結合し、これにユビキチン分子を連結するという役割を担う分子をユビキチンリガーゼといいます。これまでに、PDLIM2を含めて7個のPDZ-LIMタンパク質が報告されていますが、PDLIM2以外のPDZ-LIMタンパク質がNF-κBのユビキチン化と分解を誘導するのかについては明らかにされていませんでした。
- 注1)2007年4月30日プレスリリース「炎症反応を制御する新たなメカニズムを解明」
研究手法と成果
共同研究チームは、まずこれらのPDZ-LIMタンパク質がNF-κBをユビキチン化するかどうかを調べました。その結果、7個のPDZ-LIMタンパク質の中で、NF-κBをユビキチン化し、かつ樹状細胞に発現しているのは、PDLIM2とPDLIM7の二つのみであることが明らかになりました。次に、PDLIM7のNF-κBに対する作用を調べたところ、PDLIM7は、PDLIM2と同様、NF-κBと結合し、NF-κBをユビキチン化して分解に導くことでNF-κBの働きを抑制しました。また、PDLIM7を欠損させた樹状細胞をリポ多糖(LPS)[9]で刺激したときの炎症性サイトカインの産生量を測定したところ、コントロールの細胞と比べて2~3倍に増加しており、同時にNF-κBの分解も妨げられていました。よって、PDLIM7は樹状細胞におけるNF-κBに対する新しいユビキチンリガーゼであり、炎症反応を負に制御することが明らかになりました。
これまでに、複数のユビキチンリガーゼが同一の標的タンパク質をユビキチン化する場合、ユビキチンリガーゼが2量体を形成し、相乗的に標的タンパク質の分解を促進することが報告されています注2)。そこで、PDLIM7とPDLIM2という二つのユビキチンリガーゼが、NF-κBをユビキチン化・分解する反応において、どのように働くのかを調べました。その結果、PDLIM7がPDLIM2とも結合し、PDLIM2をユビキチン化することが分かりました。さらに、ユビキチン化されたPDLIM2とNF-κBの複合体は、このユビキチン鎖を介して、プロテアソーム結合タンパク質として知られているp62/Sqstm1とも結合し、プロテアソームへの輸送が促進されることが明らかになりました。実際、PDLIM7とPDLIM2の両方を欠損させた樹状細胞においては、PDLIM7またはPDLIM2のみを欠損させた細胞と比べて、LPSで刺激したときの炎症性サイトカインの産生がさらに2倍増加していました。
以上より、PDLIM7は、NF-κBを直接ユビキチン化して分解に導くだけでなく、PDLIM2によるNF-κBのプロテアソームでの分解を促進することで、より効率的にNF-κBが分解し、炎症反応を負に制御していることが明らかになりました(図1)。
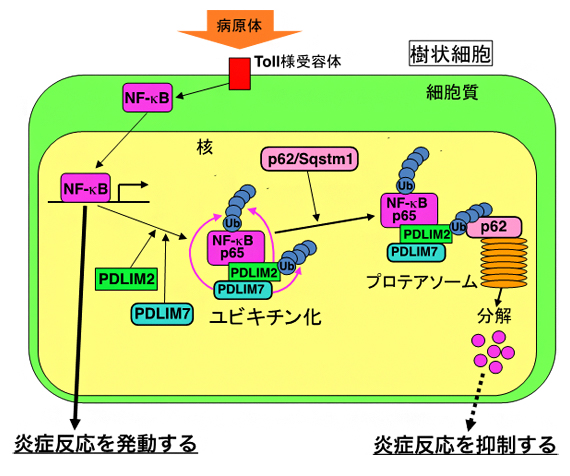
図1 PDLIM7、PDLIM2およびp62/Sqstm1による炎症反応制御機構
樹状細胞において、NF-κBは活性化すると細胞質から核へ移行し、炎症反応に関連する一連の遺伝子の転写を促進することにより、炎症反応を誘導する。PDLIM7は、核内に移行したNF-κBをユビキチン化し、プロテアソームでの分解を誘導することにより不活性化する。さらに、PDLIM7は、PDLIM2もユビキチン化し、p62/Sqstm1と共同して、PDLIM2- NF-κBのプロテアソームへの輸送を促進することで、より効率的なNF-κBの分解を誘導する。これらの二つのメカニズムにより、PDLIM7は炎症反応を抑制する。
- 注2)Metzger M.B. et al. RING-type E3 ligases: master manipulators of E2 ubiquitin-conjugating enzymes and ubiquitination. Biochem Biophys Acta (2014) 1843: 47-60. doi:10.1016/j.bbamcr.2013.05.026
今後の期待
今回の研究で、PDLIM7とPDLIM2というLIMドメインを持つファミリー遺伝子が、互いに協調し合って炎症反応を抑制しているという新たな分子メカニズムが明らかになりました。これらのタンパク質による炎症反応の抑制機構は、炎症性疾患や自己免疫疾患の治療を目的とした人為的な免疫制御法の開発に役立つと期待できます。
補足説明
- 1.自己免疫疾患
何らかの免疫異常によって自分の体や組織を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の体を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。 - 2.転写因子NF-κB
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質を転写因子という。転写因子のNF-κBにはp65を含む5種類のサブユニットが知られており、これらが二量体を形成したものが転写因子として機能する。細菌やウイルスの構成成分などの刺激で活性化され、炎症性サイトカインなどの発現を亢進させることで、炎症反応の誘導に中心的役割を果たす。 - 3.ユビキチン化、ユビキチン、プロテアソーム
ユビキチンは76個のアミノ酸からなる小さなタンパク質で、標的となるタンパク質に多数のユビキチン分子が鎖状に結合すると(ユビキチン化)、標的タンパク質はプロテアソームという巨大なタンパク質分解酵素複合体に認識され分解される。 - 4.PDLIM2
PDZドメインとLIMドメインという二つの特殊な構造を持つタンパク質で、田中貴志チームリーダーらが発見した。標的タンパク質となる転写因子をユビキチン化し分解を誘導することで、シグナル伝達を抑制させるように働く。 - 5.樹状細胞
樹状突起を持つ白血球で、病原体を認識して取り込み、感染局所に炎症反応を誘導するとともに、Tリンパ球に異物の情報を伝える細胞。Tリンパ球は、病原体を攻撃したり、他の免疫細胞を刺激したりして抗体の生産を活性化する免疫細胞。 - 6.Toll(トール)様受容体(TLR)
病原体由来のさまざまな成分の認識に関与する膜タンパク質群の総称。ヒトでは10種類、マウスでは12種類が報告されており、それぞれのTLRが病原体特異的な成分(膜分子や核酸)を認識する。TLRはToll-like receptorの略。 - 7.炎症性サイトカイン
サイトカインとは、細胞同士の情報伝達に関わるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。 - 8.ドメイン
タンパク質は、その分子中で複数の領域に分けることができる場合がある。これをドメインと呼び、特定の機能や構造で他と区別できる。 - 9.リポ多糖(LPS)
グラム陰性桿菌(かんきん)の細胞壁を構成する糖脂質の一つ。樹状細胞の細胞膜表面にあるToll様受容体の一つTLR4を刺激することにより、転写因子NF-κBを活性する。
共同研究グループ
理化学研究所 生命医科学研究センター 炎症制御研究チーム
テクニカルスタッフI 城道 絢(じょうどう あや)
特別研究員(研究当時) 芝崎 あずさ(しばざき あずさ)
特別研究員 小沼 あすか(おぬま あすか)
チームリーダー 田中 貴志(たなか たかし)
和歌山県立医科大学 医学部先端医学研究所
教授 改正 恒康(かいしょう つねやす)
研究支援
本研究は科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)「炎症の慢性化機構の解明と制御(研究総括:高津聖志)」の研究課題「炎症反応を負に制御する分子機構の解明(研究者:田中貴志)」の支援を受けて行われました。
原論文情報
- Aya Jodo, Azusa Shibazaki, Asuka Onuma, Tsuneyasu Kaisho, Takashi Tanaka, "PDLIM7 synergizes with PDLIM2 and p62/Sqstm1 to inhibit inflammatory signaling by promoting degradation of the p65 subunit of NF- B.", Frontiers in Immunology, 10.3389/fimmu.2020.01559
発表者
理化学研究所
生命医科学研究センター 炎症制御研究チーム
チームリーダー 田中 貴志(たなか たかし)
テクニカルスタッフI 城道 絢(じょうどう あや)
 田中 貴志
田中 貴志
 城道 絢
城道 絢
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
