2020年8月27日
理化学研究所
神奈川県立産業技術総合研究所
横浜市立大学
日本医療研究開発機構
腸内細菌が中枢神経系炎症を促進する仕組みを解明
-多発性硬化症の予防・治療に新たな可能性-
理化学研究所(理研)生命医科学研究センター粘膜システム研究チームの宮内栄治研究員と大野博司チームリーダー(神奈川県立産業技術総合研究所プロジェクトリーダー、横浜市立大学大学院生命医科学研究科大学院客員教授)らの共同研究グループは、腸内細菌が自己免疫性[1]の中枢神経系炎症である多発性硬化症の発症や進行を促進する仕組みを発見しました。
本研究成果は、小腸細菌叢を制御することが多発性硬化症の発症や進行の緩和に寄与する可能性を示しており、多発性硬化症の新たな予防・治療法の開発につながると期待できます。
これまで、多発性硬化症患者の腸内細菌叢解析や多発性硬化症動物モデルを用いた研究から、中枢神経系の炎症に腸内細菌が大きく関与していると考えられていましたが、その作用機序は分かっていませんでした。
今回、共同研究グループは多発性硬化症のモデルマウスを用い、自己応答性T細胞[2]が小腸常在菌によって活性化され、それにより中枢神経系の自己免疫性炎症が増悪することを見いだしました。多発性硬化症は、神経軸索を覆うミエリン(髄鞘)に特異的なT細胞によって引き起こされると考えられています。今回の研究により、腸内細菌の一つであるLactobacillus reuteri[3]がミエリン特異的T細胞と交差反応[4]することでT細胞の増殖を促進し、Erysipelotrichaceae科[5]の菌がこのT細胞の病原性を高めることが明らかになりました。これら作用の異なる二つの菌が、相乗的に中枢神経系の炎症を増悪すると考えられます。
本研究は、科学雑誌『Nature』のオンライン版(8月26日付:日本時間8月27日)に掲載されます。
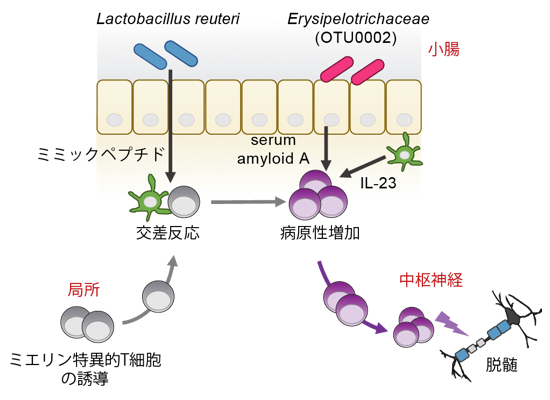
異なる作用を持つ二つの腸内細菌の相乗効果により、中枢神経系の炎症が増悪される
背景
「多発性硬化症(Multiple sclerosis;MS)」は、脳や脊髄といった中枢神経系の炎症疾患であり、その症状は視覚障害や四肢の麻痺など多岐にわたります。発症原因はまだ十分に解明されていませんが、環境的要因と遺伝的要因の両方が関与しています。
また、MSは自己免疫疾患[1]であると考えられており、MSの動物モデルである実験的自己免疫性脳脊髄炎(Experimental autoimmune encephalomyelitis ; EAE)では、ヘルパーT細胞[6]、特にサイトカイン[7]のインターロイキン-17(IL-17)を産生する「Th17細胞[6]」が病気の発症や進行に大きく寄与していることが分かっています。マウスを無菌状態で飼育すると、EAEの発症や進行が抑えられることは以前から報告されており、さらに近年、MS患者の腸内細菌叢が健常者と異なることが明らかになってきました。このように、ある種の腸内細菌がMSにおける中枢神経系の炎症増悪に加担している可能性が考えられていました。
しかし、どのような細菌が関与しているのか、さらには腸管内の細菌がいかにして中枢神経系の炎症に働きかけるのか、不明な点が多く残されていました。
研究手法と成果
多発性硬化症は、神経軸索を覆うミエリン(髄鞘)に特異的なT細胞によって引き起こされると考えられています。共同研究グループはまず、マウスに4種類の抗生剤(アンピシリン、バンコマイシン、ネオマイシン、メトロニダゾール)をそれぞれ投与することにより、異なる腸内細菌叢を持つマウスを用意しました。これらのマウスに、中枢神経のミエリンを構成するタンパク質の一つであるミエリンオリゴデンドロサイト糖タンパク質(MOG)[8]を投与することにより、EAEを発症誘導しました。その結果、アンピシリンを投与したマウスでは、EAEの症状(四肢の麻痺)が緩和されました(図1左)。
腸管におけるMOG特異的な免疫応答を確認したところ、小腸でMOG特異的なTh17細胞が活性化していることが明らかになりました。また、アンピシリンを投与したマウスの小腸では、この活性化が抑制されていました(図1右)。これらの結果から、MOG特異的な自己反応性T細胞であるTh17細胞が小腸の細菌によって活性化されることが示唆されました。
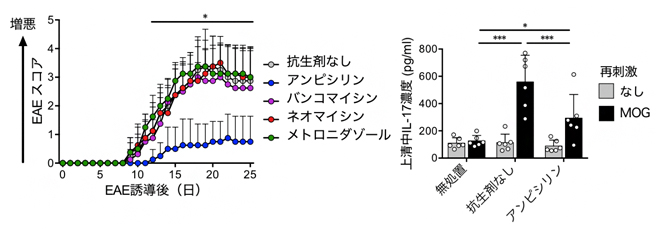
図1 アンピシリン投与によるEAE症状緩和と小腸におけるMOG特異的免疫応答の抑制
- 左:アンピシリンを投与したマウスは、実験的自己免疫性脳脊髄炎(EAE)の症状が緩和された。
- 右:小腸の細胞を回収し、ミエリンオリゴデンドロサイト糖タンパク質(MOG)で再刺激した後に、上清中のサイトカインのIL-17濃度を測定した。小腸でMOG特異的なサイトカイン産生が認められたが、アンピシリン投与でそれが抑制された。
次に、各マウスの小腸内細菌叢を次世代シーケンサー[9]を用いて解析したところ、アンピシリン投与マウスでのみErysipelotrichaceae科に属する菌(便宜上OTU0002と呼ぶ)の量が著しく減少していました。そこで、マウス小腸からOTU0002を単離培養し、無菌マウスに定着させた後にEAEを誘導しました。対照として抗生剤の影響を受けなかったLactobacillus reuteriを定着させたマウスと比較した結果、OTU0002の定着により小腸のTh17細胞が増加するとともに、EAEの症状が悪化しました(図2)。また、OTU0002は、血清アミロイドA[10]やインターロイキンー23(IL-23)などのサイトカインを誘導することにより、Th17細胞の病原性を高めることが明らかになりました。この結果から、OTU0002はTh17細胞の反応を誘導することでEAEを悪化させる可能性が考えられました。
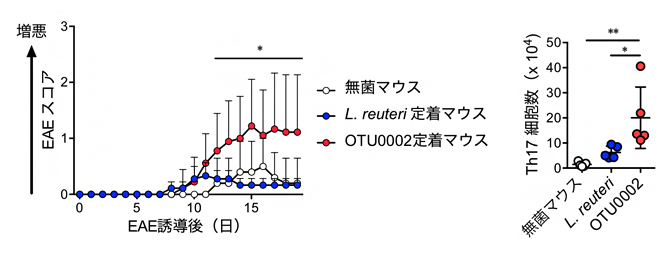
図2 OTU0002によるEAE増悪と小腸Th17細胞の増加
- 左:Erysipelotrichaceae科に属する菌OTU0002の定着により、EAEの症状が悪化した。
- 右:TU0002の定着により、小腸のTh17細胞が増加した。
一方、図1右の無処置マウスに比べ、OTU0002定着のみではEAEの症状は軽いことから、他の菌も関与していると可能性があります。そこで、MOG特異的T細胞と交差反応して活性化する菌由来のペプチドがあるのではないかと考えました。小腸内細菌ゲノムのショットガンシーケンシング[11]を行い、候補となるペプチドを探索した結果、L. reuteriが発現するUvrAペプチドがMOG特異的T細胞と交差反応することが分かりました(図3)。
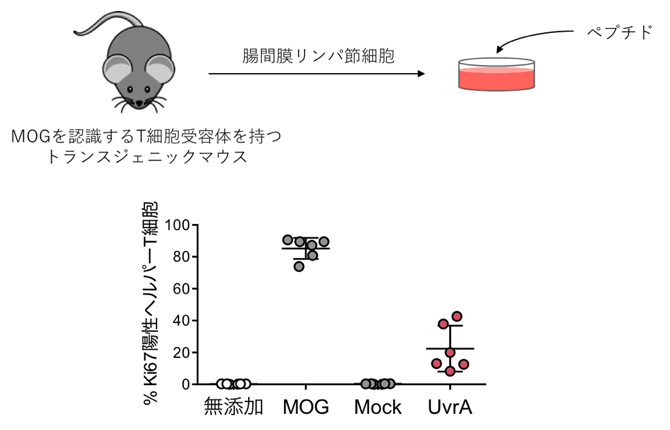
図3 L. reuteri由来ペプチド(UvrA)によるMOG特異的T細胞の増殖
MOGを認識するT細胞受容体を持つマウスから細胞を調製し、MOG、Mock(MOGの逆配列)、UvrAペプチドで刺激した。UvrAは細胞増殖マーカーKi67の発現を増加させた。
図2のように、L. reuteriのみを無菌マウスに定着させてもEAEに影響しませんでしたが、L. reuteriとOTU0002の両方を定着させることで、相乗的にEAEの症状が悪化することが明らかになりました(図4左)。EAE発症誘導後、L. reuteriとOTU0002の両方を定着させたマウスでは、ヘルパーT細胞の増殖が促進されていました。(図4右)。また、UvrAを欠損させたL. reuteriではこの相乗効果は見られませんでした(図5)。
これらの結果から、Th17細胞を誘導する細菌(OTU0002)と、抗原特異的にT細胞の増殖を誘導する細菌(L. reuteri)が相乗的に働き、MOG特異的T細胞を活性化する可能性が見いだされました。
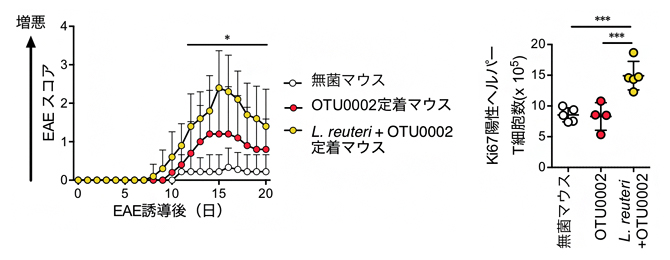
図4 L. reuteriとOTU0002の相乗効果
- 左:L. reuteriとOTU0002の共定着により、EAEの症状が悪化した。
- 右:L. reuteriとOTU0002の共定着により、EAE発症誘導後の小腸ヘルパーT細胞の増殖が促進した。
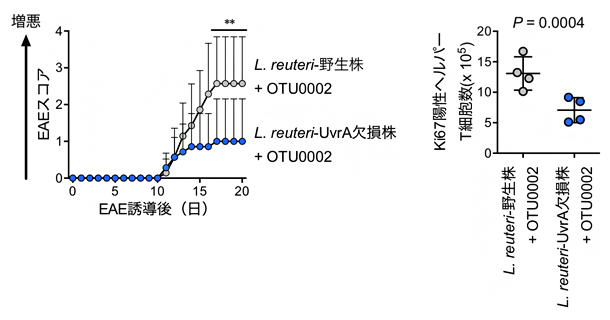
図5 L. reuteri UvrA欠損株のEAEへの影響
- 左:UvrAを欠損させることにより、L. reuteriとOTU0002によるEAE症状悪化が軽減した。
- 右:UvrAを欠損させることにより、EAE発症誘導後の小腸ヘルパーT細胞の増殖が抑制された。
今後の期待
MS患者の腸内細菌叢解析やEAEを用いた研究から、中枢神経系の炎症に腸内細菌が大きく関与していると考えられていましたが、その作用機序は分かっていませんでした。本研究では、作用の異なる二つの菌が相乗的に作用し、自己抗原[12]特異的なT細胞を小腸で活性化することを明らかにしました。このことは、小腸細菌叢を制御することがMSの発症や症状緩和に寄与する可能性を示しています。
ヒトとマウスでは常在する腸内細菌が異なり、また、MSではEAEとは異なる自己抗原が標的になると考えられます。今後、これらのギャップを埋めることにより、腸内細菌を起点としたMSの新しい予防・治療法の開発へとつながると期待できます。
補足説明
- 1.自己免疫性、自己免疫疾患
自己免疫性とは、本来は、外来から侵入してくる全ての異物から身を守るはずの免疫システムが異常を来し、誤って自分自身の細胞や組織を攻撃してしまう性質を指す。自己免疫疾患は自己免疫性により発症する病気で、多発性硬化症のほかに関節リウマチなどがある。 - 2.自己応答性T細胞
自分自身の細胞や組織の抗原に反応するT細胞。本来は、胸腺において負の選択により除去されるが、自己免疫疾患では自己応答性T細胞が活性化し、炎症を引き起こす。 - 3.Lactobacillus reuteri
ヒトなどの動物の腸内に生息する乳酸桿菌(かんきん)。 - 4.交差反応
ある抗原に特異的な抗体やT細胞などが、類似した別の抗原にも反応すること。 - 5.Erysipelotrichaceae科
Firmicutes門に属する細菌の科。ヒトなどの動物の腸内細菌で見られ、高脂肪食により増加するとの報告もある。 - 6.ヘルパーT細胞、Th17細胞
ヘルパーT細胞は、免疫応答に関与するT細胞の一つで、抗原の情報をB細胞に伝えて抗体の産生を誘導したり、免疫応答を誘導するサイトカインを放出することにより、免疫反応の司令塔として働く。Th17細胞は、サイトカインのインターロイキン-17(IL-17)を産生するヘルパーT細胞の一種。感染防御において重要な役割を果たしている一方で、多発性硬化症や関節リウマチなどの自己免疫疾患にも関与している。 - 7.サイトカイン
細胞から分泌されるタンパク質で、細胞間の情報伝達などの役割を担う。さまざまな種類が存在し、各種サイトカインごとにその作用は異なる。 - 8.ミエリンオリゴデンドロサイト糖タンパク質(MOG)
中枢神経のミエリン(髄鞘)を構成するタンパク質の一つ。高い抗原性を示し、マウスに免疫することでミエリン特異的なT細胞やB細胞応答を誘導できる。MOGはMyelin oligodendrocyte glycoproteinの略。 - 9.次世代シーケンサー
大量のDNA配列を高速で決定する実験機器のこと。数千から数百万ものDNA分子配列を同時に決定できる。 - 10.血清アミロイドA
炎症反応時に産生されるタンパク質。ある種の腸内細菌は腸管上皮細胞からの血清アミロイドAの産生を誘導する。インターロイキン-23(IL-23)と同様、病原性Th17細胞の誘導に関わることが報告されている。 - 11.ショットガンシーケンシング
腸内容物などの全ゲノムDNAを抽出し、断片化した後に次世代シーケンサーを用いて無作為に配列を決定する方法。断片化されたDNA配列をコンピューター上でつなぎ合わせ、腸内細菌が持つ遺伝子の定量などを行う。 - 12.自己抗原
自分自身の細胞を構成するタンパク質などの抗原。
共同研究グループ
理化学研究所 生命医科学研究センター
粘膜システム研究チーム
チームリーダー 大野 博司(おおの ひろし)
(神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト プロジェクトリーダー)
(横浜市立大学大学院 生命医科学研究科 大学院客員教授)
研究員 宮内 栄治(みやうち えいじ)
テクニカルスタッフⅡ 川住 雅美(かわすみ まさみ)
テクニカルスタッフⅡ(研究当時) 大縄 悟志(おおなわ さとし)
テクニカルスタッフⅠ 新奈 緒子(あたらし なおこ)
客員研究員(研究当時) Kim Seok-Won(キム ソクウォン)
マイクロバイオーム研究チーム
チームリーダー(研究当時) 服部 正平(はっとり まさひら)
副チームリーダー 須田 亙(すだ わたる)
上級研究員 Taylor D. Todd(テイラー トッド)
岡山大学大学院 環境生命科学研究科
教授 森田 英利(もりた ひでとし)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究(B)「腸内細菌による中枢神経系炎症制御メカニズムの解析(研究代表者:宮内栄治)」、同基盤研究(A)「自己免疫疾患における腸内細菌叢の役割の研究(研究代表者:大野博司)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)『疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出(研究開発総括:清水孝雄)」の「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築」(研究開発代表者:大野博司)、および一般財団法人糧食研究会による支援を受けて行われました。
原論文情報
- Eiji Miyauchi, Seok-Won Kim, Wataru Suda, Masami Kawasumi, Satoshi Onawa, Naoko Taguchi-Atarashi, Hidetoshi Morita, Todd D. Taylor, Masahira Hattori, Hiroshi Ohno, "Gut microbes act in concert to exacerbate inflammation in spinal cords", Nature, 10.1038/s41586-020-2634-9
発表者
理化学研究所
統合生命医科学研究センター 粘膜システム研究チーム
研究員 宮内 栄治(みやうち えいじ)
チームリーダー 大野 博司(おおの ひろし)
(神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト プロジェクトリーダー)
(横浜市立大学大学院 生命医科学研究科 大学院客員教授)
 宮内 栄治
宮内 栄治
 大野 博司
大野 博司
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
神奈川県立産業技術総合研究所 研究開発部 研究支援課
Tel: 044-819-2031 / Fax: 044-819-2026
Email: sks [at] newkast.or.jp
横浜市立大学 広報室
Tel: 045-787-2445 / Fax: 045-787-2048
Email: koho [at] yokohama-cu.ac.jp
産業利用に関するお問い合わせ
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
Tel: 03-6870-2224
Email: kenkyuk-ask [at] amed.go.jp
※上記の[at]は@に置き換えてください。
