2021年7月15日
理化学研究所
日本医療研究開発機構
ヒストンメチル化による自閉症の新しいメカニズムを発見
-自閉スペクトラム症の治療薬開発に役立つ可能性-
理化学研究所(理研)脳神経科学研究センター分子精神遺伝研究チームの吉川武男チームリーダー(研究当時)、シャビーシュ・バラン研究員(研究当時)、開拓研究本部眞貝細胞記憶研究室の眞貝洋一主任研究員らの国際共同研究グループは、自閉スペクトラム症[1](自閉症、ASD)でヒストンH3[2]のメチル化[3]に関連する「SUV39H2遺伝子[4]」に機能喪失を来すアミノ酸変異を見いだし、ヒストンメチル化の異常が自閉症に関連するメカニズムを発見しました。本研究成果は、自閉症の病態理解および治療薬の開発に向けた取り組みに貢献するものと期待できます。
自閉症の詳しい原因は不明な点が多く、今のところ病因に基づいた有効な治療薬はありません。今回、国際共同研究グループは、健常対照者と自閉症のDNA検体を用いた遺伝子配列解析により、機能喪失につながるまれなSUV39H2遺伝子のアミノ酸変異を発見しました。さらに、SUV39H2遺伝子破壊マウスは、自閉症の中核症状である「同一性への固執、習慣へのかたくななこだわり」に相当する行動を示しました。また、ヒストンH3のメチル化障害は「クラスター型プロトカドヘリンβ遺伝子群[5]」の発現の乱れを生じさせたことから、脳発達期のヒストンH3のメチル化不全が、プロトカドヘリン[5]を介した神経ネットワークの形成に影響を与え、自閉症につながるという新しいメカニズムを明らかにしました。
本研究は、科学雑誌『Molecular Psychiatry』のオンライン版(7月15日付:日本時間7月15日)に掲載されます。
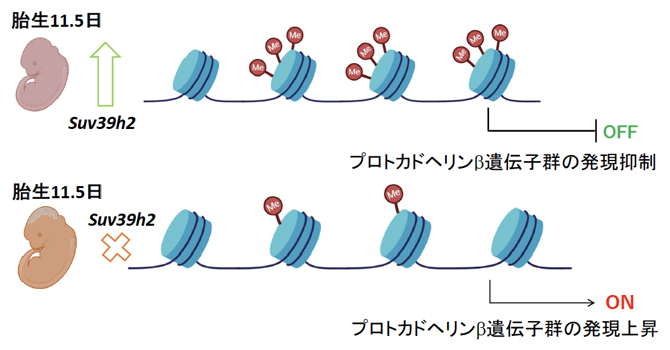
Suv39h2遺伝子の欠損は、胎生期にプロトカドヘリンβ遺伝子群の発現過剰を招く(下段)
背景
自閉スペクトラム症(自閉症、ASD: autism spectrum disorder)は、精神疾患診断の指針によると、社会的コミュニケーションや対人的相互反応における持続的な欠陥、行動・興味・活動の限定された反復的な様式を中核症状とし、加えて多動性などの非典型な行動が併存しやすいといった臨床的特徴を持つ神経発達障害の一つとされています。
その発症率は近年増加傾向にあるといわれており、2014年(平成26年)の厚生労働省の調査では自閉症を含む発達障害の患者が全国に19万5000人いると報告されています(2015年公表)注1)。しかし、自閉症の詳しい原因についてはまだ分かっていません。新しい診断法や治療法の開発への取り組みに貢献するため、自閉症の分子メカニズムの解明が望まれています。
自閉症の病理・病態メカニズムの一つとして、これまでの遺伝子研究からクロマチンリモデリング[6]に関係する因子の可能性が知られています。その中でも特に、ヒストンH3の9番目のアミノ酸であるリジン(H3K9)残基のメチル化に関係する遺伝子が注目されています。例えば、H3K9のメチル化酵素の一つにEHMT1(GLP)がありますが、EHMT1(GLP)遺伝子の異常は自閉症様症状を呈する神経遺伝性障害のクリーフストラ症候群[7]の原因として知られています。
一般的に、遺伝子のプロモーター領域[8]のH3K9がメチル化されると、その遺伝子の発現が抑えられます。しかし、自閉症とH3K9のメチル化の詳細な関連はこれまで不明でした。
研究手法と成果
国際共同研究グループは、H3K9のメチル化状態に関連する9個の遺伝子(EHMT1、EHMT2、WIZ、SETDB1、SUV39H1、SUV39H2、KDM3A、KDM3B、PHF8)に着目し、658例の自閉症患者と2,170例の健常対照者のDNAを比較しました。その結果、自閉症に特異的なまれな変異として、29個のミスセンス変異(アミノ酸変化を伴う変異)およびスプライスサイト変異(mRNAのスプライシングに影響する変異)が検出され、そのうち18個は世界の主だった公的データベースにも登録されていない新しいものでした。
さらにその中で、「SUV39H2遺伝子」の211番目のアラニン残基をセリン残基に変える変異(A211S)は、バイオインフォマティクス解析[9]から最も重要で有害な変異であることが予想されました(図1)。
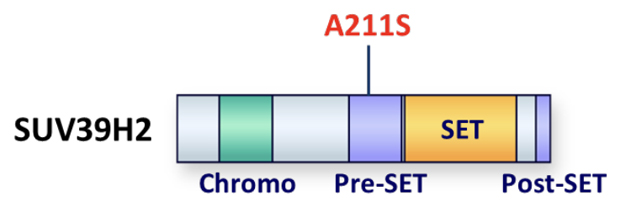
図1 SUV39H2タンパク質のドメイン構造とA211S変異
SUV39H2遺伝子の211番目のアラニン残基をセリン残基に変える変異(A211S変異)は、Pre-SETと呼ばれる機能的に重要なドメイン内にある。
そこで、211番目のアミノ酸をセリンに変えた変異型SUV39H2タンパク質を生合成し、試験管内でヒストンH3のメチル化能を調べたところ、変異型は大きく活性を失っていました。さらに、マウスのSUV39H2で変異型を作製し活性を調べたところ、野生型のタンパク質と比べてヒストンH3のメチル化能はやはり大きく低下していました。
これらの結果を受け、マウスでSuv39h2遺伝子をノックアウトし(Suv39h2 KO)、どのような行動異常が現れるかを、IntelliCageと呼ばれる集団飼育環境下全自動マウス行動試験システムと、IntelliCage認知行動試験ライブラリ(フェノバンス社)のプログラムを用いて詳しく調べました。すると、Suv39h2 KOマウスは、日常的に暗期での活動量が高く、ヒト自閉症の多くに併存しやすいといわれる「過活動性」を示しました(図2A)。
また、学習能力と行動の柔軟性を評価するため、ケージの四隅に設置された小型オペラントチャンバー(コーナー)のうち2カ所を往復することで報酬(水)を得るという行動系列を学習させました。さらにその後、個体ごとの成績に応じて往復すべきコーナーの位置を次々と変更していった場合に、いかにスムーズに行動転換できるかを調べました。その結果、図2B下段の一番左にあるように、はじめに対角線上にあるコーナー間の往復で報酬がもらえるという行動系列を学習するまでに要した試行錯誤の回数は、野生型とSuv39h2 KOマウスで有意差はありませんでした(図2B"最初の課題")。しかしその後、二つの報酬がもらえるコーナーのうち、一つの位置のみを変更する条件(部分シフト、PS:partial shift)と、両方の位置を同時に変更する条件(完全シフト、CS:complete shift)を混在させたCS/PS混在課題を行うと、KOマウスはCS課題に遭遇したところで野生型のような柔軟な行動転換が困難であることが示されました(図2B)。
この課題は、ヒトが実生活中で日常的に経験するような、予測困難な状況の変化に対してそれまでの習慣的行動を柔軟に転換、再構築し続ける能力を評価することを意図したものです。なお、事前に行われた、よりシンプルなCS条件のみの課題では、KOマウスに有意な成績の低下は見られていませんでした。
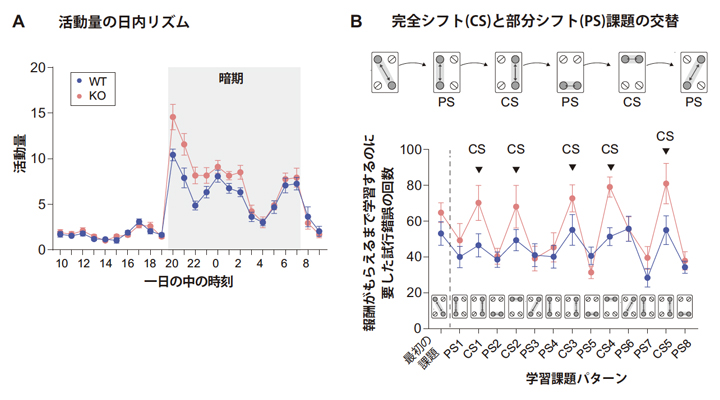
図2 Suv39h2 KOマウスの行動解析
- A:自発活動量の日内リズム。各時間の活動量は、2週間分の平均値を示す。KOマウスは、暗期での活動量が高い。
- B:変化する報酬課題に対応する能力。CS課題は、報酬がもらえる場所を二つとも替えた場合。PS課題は、報酬がもらえる場所を一つ替えた場合。KOマウスは、事前に行ったCS課題のみの条件では成績は正常だったが、このCS課題とPS課題が混在するさらに認知的負荷の高い条件の試験を課すと、柔軟な行動転換が困難になった。
以上から、KOマウスでは、①基本的な学習能力には問題がない、②予測しやすい単純なルールの変化であれば対応できる、しかし、③予測困難な複雑なルールの転換には適応しづらいことが分かりました。ヒト自閉症の中核症状の一つとして、「同一性への固執、習慣へのかたくななこだわり、または言語的・非言語的な儀式的行動様式」がありますが、特に予測困難な状況の変化に直面した際に強い抵抗を示すといわれています。Suv39h2 KOマウスの行動は、この自閉症の中核症状をよく反映していると考えられます。
次に、Suv39h2 KOマウスの脳内ではどのようなことが生じているのかを遺伝子発現から調べました。SUV39H2(ヒト)/Suv39h2(マウス)は、脳の発達の初期段階で発現のピークがあり、ヒトでは妊娠4~5週、マウスでは胎生11.5日(E11.5)といわれています(図3)。
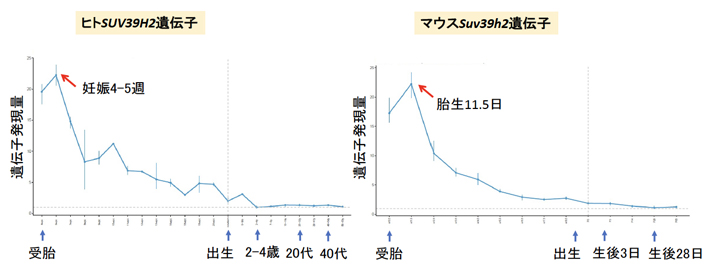
図3 SUV39H2(ヒト)/Suv39h2(マウス)の脳発生・発達依存的遺伝子発現変化
ヒトの脳(小脳を除く)では妊娠4~5週(左)、マウスの脳では胎生11.5日(E11.5)(右)に遺伝子発現量のピークがある。Evo-devo mammalian organs参照
そこで、胎生11.5日齢のマウス脳を用いて網羅的な遺伝子発現解析を行いました。その結果、Suv39h2 KOマウスでは野生型に比べて、15個の遺伝子の発現が上昇していました(図4A右上の区画の赤い点)。興味深いことに、そのうち9個は「クラスター型プロトカドヘリンβ遺伝子ファミリー[5]」と呼ばれる遺伝子群に属するものでした。プロトカドヘリンは細胞表面に存在する糖タンパク質の一群で、細胞接着をつかさどっています。クラスター型プロトカドヘリンの遺伝子は、ゲノムの中で同じ領域にまとまって位置しており、β遺伝子ファミリーメンバーは全部で22種類ありますが、そのうち9種類の発現が一斉に上昇していたことになります(図4A)。
マウスではプロトカドヘリン遺伝子は、胎生11.5日以降から発現が立ち上がりますが(図4B)、Suv39h2 KOマウスではその時点で既に発現が上昇しているといえます。図3右と図4Bを比べて見ると、Suv39h2遺伝子の発現がピークから下降に転じるのとプロトカドヘリンβ遺伝子ファミリーメンバーの発現が立ち上がるのが対応していることが分かります。
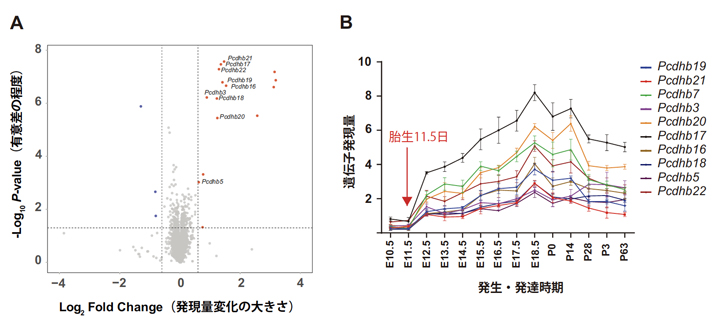
図4 マウス脳の網羅的遺伝子発現解析とプロトカドヘリンβ遺伝子群の脳発達依存的発現
- A:Suv39h2 KOマウス脳の網羅的遺伝子発現解析から、胎生11.5日でプロトカドヘリンβ遺伝子ファミリーメンバー(9種類)の発現が上昇していることが判明した(図右上の区画の赤い点)。Pcdhbはprotocadherin β(プロトカドヘリンβ)を表す。
- B:プロトカドヘリンβ遺伝子ファミリーメンバーの発現は、胎生11.5日以降に始まる。
E: 胎生日数、P: 生後日数、Evo-devo mammalian organs参照。
SUV39H2はヒストンH3のリジン残基(H3K9)をメチル化しますが、遺伝子プロモーター領域のH3K9がメチル化されるとその遺伝子の発現が抑えられることが分かっています。そこで、プロトカドヘリンβ遺伝子ファミリーメンバーのプロモーター領域のH3K9のメチル化の程度を調べました。クロマチン免疫沈降 (ChIP)-PCR解析[10]を行ったところ、Suv39h2 KOマウスの胎生11.5日齢の脳では、野生型に比べてプロモーター領域のH3K9のメチル化が軒並み減少していました(図5)。以上のことから、SUV39H2の機能が障害されるとプロモーター領域のH3K9メチル化が減少し、結果としてプロトカドヘリンβ遺伝子ファミリーメンバーの発現が高まることが分かりました。
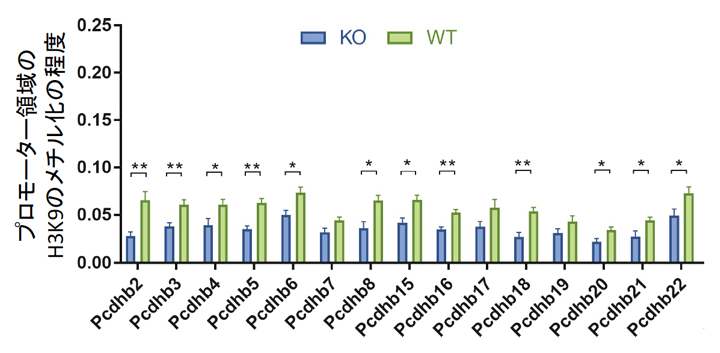
図5 胎生11.5日齢のマウス脳を用いたクロマチン免疫沈降(ChIP)-PCR解析
KOはSuv39h2 ノックアウトマウス、WTは野生型マウスマウスを示す。調べた15種類のプロトカドヘリンβ遺伝子ファミリーメンバーにおいて、野生型に比べてSuv39h2KOマウスでは、プロモーター領域のH3K9のメチル化が軒並み減少していた。
クラスター型プロトカドヘリンにはα、β、γの3群があり、それぞれ14種類、22種類、22種類のファミリーメンバーがあります。個々の神経細胞は、免疫グロブリンの可変領域が多様性を持つシステムと同じような発現制御様式で、ランダムに一つのα、一つのβ、一つのγが選ばれて発現します。同じα、β、γを持つ神経細胞同士は結合しますが、α、β、γのうち一つでも違う神経細胞同士は結合しないと考えられています。
したがって、クラスター型プロトカドヘリンは、「神経細胞どうしのつながり=神経ネットワークの形成」に重要な役割を果たすと考えられています。このことから、今後のさらなる検証は必要なものの、SUV39H2遺伝子の異常は、脳の発生・発達期にクラスター型プロトカドヘリンβ遺伝子群の発現の乱れを生じさせ、その結果、神経ネットワークの形成に乱れが生じ、最終的に自閉症につながる可能性が考えられました。
最後に、治療を考える上で、SUV39H2/Suv39h2遺伝子の効果は生後脳がある程度完成した時点でも見られるのか調べました。ヒト自閉症(4~20歳)の死後脳で、SUV39H2遺伝子およびその近縁のSUV39H1遺伝子の発現レベルを調べたところ、前者は背側縫線核で減少、後者は側頭葉で減少していることが分かりました(図6)。背側縫線核はセロトニン神経細胞[11]の起始核で、セロトニンと自閉症の関連についても多くの報告があります。以上から、生後自閉症を発症したあともSUV39H遺伝子の影響が考えられます。
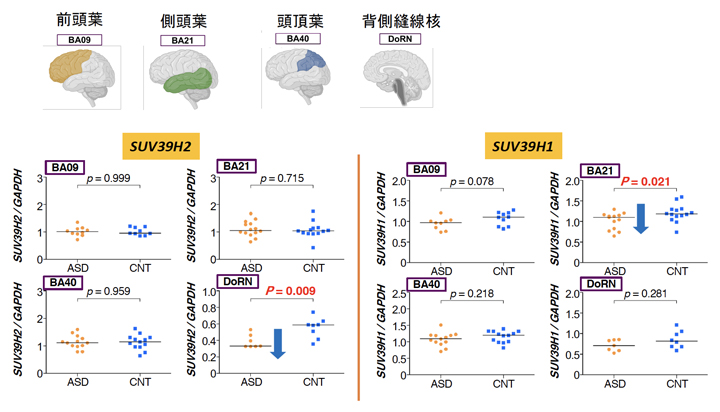
図6 ヒト自閉症死後脳における遺伝子発現解析
- 左パネル:SUV39H2の発現は、自閉症の背側縫線核(DoRN: dorsal raphe nucleus)で減少している。
- 右パネル:SUV39H1の発現は、自閉症の側頭葉(BA21: Brodmann Area 21)で減少している。
今後の期待
今回、国際共同研究グループは、自閉症の原因として、(1)SUV39H2遺伝子の機能喪失、(2)プロトカドヘリンβ遺伝子群のプロモーター領域のH3K9のメチル化の減少、(3)プロトカドヘリンβ遺伝子群の発現上昇 、結果として(4)神経ネットワーク形成の乱れにつながる可能性、を明らかにしました。また、SUV39H2遺伝子の障害による異常に対しては、ヒト死後脳の解析から生後でも介入の余地の可能性が考えられました。
SUV39H2遺伝子は、これまでの自閉症研究からエピゲノム[12]パスウェイの重要な位置を占めるということが予想されていましたが、実際機能喪失の変異が見つかり直接的証拠を示したのは、今回の研究が初めてです。また、エピゲノム変化が最終的にどのようなメカニズムで自閉症に影響するかについても、具体的な詳細が明らかになりました。自閉症を含む精神疾患は、症状が多様で、多くの遺伝子が関連しますが、ある一つの遺伝子がどの症状に対応するのかはほとんど明らかになっていません。今回の研究で得た、SUV39H2遺伝子の異常は、自閉症の症状のうち「同一性への固執、習慣へのかたくななこだわり」に関係することが判明したのは興味深い成果です。
自閉症は原因に基づいた治療法がないのが現状であるため、今後、今回の結果についてさらに検証を重ねることにより、治療に役立つ方法の開発につながることが期待できます。
補足説明
- 1.自閉スペクトラム症(ASD: autism spectrum disorder)
自閉スペクトラム症(自閉症)は、社会的コミュニケーションおよび対人的相互反応における持続的な欠陥や、行動、興味、または活動の限定された反復的な様式を中核的な特徴とする発達障害の一つ。近年発症率が増加していることが懸念されている。厚生労働省が平成27年に公表した結果では、医療機関に通院または入院している自閉症、アスペルガー症候群、学習障害、注意欠陥多動性障害などの発達障害患者の総数(推計値)は、19万5,000人(自閉症、アスペルガー症候群、学習障害などは14万4,000人、注意欠陥多動性障害などは5万1,000人)となっている。 - 2.ヒストンH3
ヒストンは、真核生物のクロマチン(染色質)の基本単位であるヌクレオソームを構成する塩基性タンパク質。DNAを核内に収納する役割を担う。ヒストンとDNAの相互作用は遺伝子発現の最初の段階である転写に大きな影響を及ぼす。ヒストンはH1、H2A、H2B、H3、H4の5種類に分類される。H1はリンカーヒストンと呼ばれる。一方、H2A、H2B、H3、H4の4種は、コアヒストンと呼ばれ、それぞれ2分子ずつが集合し、ヒストン八量体を形成する。 - 3.メチル化
ヒストンのコア領域に含まれないN末端・C末端側の領域をヒストンテールと呼び、アセチル化、メチル化、リン酸化、モノユビキチン化などさまざまな翻訳後修飾を受ける。これらの修飾はクロマチン構造を変化させ、遺伝子発現制御に関わっていると考えられている。ヒストンのメチル化は、ヒストン分子のアルギニン残基やリジン残基に生じ、遺伝子発現の促進と抑制のどちらにも働く。例えば、Set1というヒストンメチル化酵素がヒストンH3の4番目のリジンをメチル化すると、遺伝子の発現が促進される。一方、Suv39h2などのヒストンメチル化酵素によって9番目のリジンがメチル化されると、HP1と呼ばれるタンパク質が結合し、ヌクレオソームが凝縮し、ヘテロクロマチンの形成が促進されるため、転写が抑制される。 - 4.SUV39H2遺伝子
ヒストンH3の9番目のリジン残基をジメチル化、あるいはトリメチル化するメチルトランスフェラーゼという酵素をコードする遺伝子。 - 5.クラスター型プロトカドヘリンβ遺伝子群、プロトカドヘリン
プロトカドヘリンはカドヘリンスーパーファミリーに属する膜タンパク質で、クラスター型プロトカドヘリン(cPcdh)と非クラスター型プロトカドヘリンとに分けられる。cPcdhは、ゲノムにおいて直列に並ぶ複数の遺伝子コード領域(可変領域)から確率的に一部が選択され、定常領域とともに転写される仕組みを持つ。一方、非クラスター型プロトカドヘリンは通常の遺伝子と同様のゲノム構造を持つ。
cPcdhはカドヘリンスーパーファミリーの中で最大のサブファミリーを構成しており、脳神経系において強く発現している多様化した細胞表面タンパク質である。cPcdh遺伝子は同一の染色体にPcdh-α、Pcdh-β、Pcdh-γの三つの遺伝子クラスターを形成しており、58種類の遺伝子が縦列したゲノム構造をとっている。おのおののcPcdh遺伝子は独自のプロモーター領域を持ち、Pcdh-αクラスターおよびPcdh-γクラスターにおいては多様化した可変領域エキソンの中から一つが選択されて定常領域エキソンとの間でスプライシングされることにより発現している。Pcdh-βクラスターにおいては多様化した可変領域エキソンの中から一つが選択されて発現している。カドヘリンの細胞外領域にはカドヘリンモチーフがあり、同じカドヘリン分子同士が結合するホモフィリック結合により細胞接着活性を持っている。 - 6.クロマチンリモデリング
クロマチン構造の動的な調節であり、ゲノムDNAに対する転写調節装置のタンパク質のアクセスを制御し、遺伝子発現の制御を行なう。こうしたリモデリングは主に、(1) 特異的酵素による共有結合的なヒストン修飾(ヒストンアセチル化酵素、脱アセチル化酵素、メチル化酵素、脱メチル化酵素、リン酸化酵素などによるもの)、(2) ヌクレオソームを動かしたり、除去したり、再構築したりするATP依存的なクロマチン構造のリモデリングによって行われる。 - 7.クリーフストラ症候群
クリーフストラ症候群は、サブテロメア9q34.3欠失またはヒストンメチルトランスフェラーゼ1遺伝子(EHMT1)の遺伝子内突然変異によって引き起こされる、まれな神経遺伝性障害である。自閉症様の精神症状を呈することがある。 - 8.プロモーター領域
ゲノムDNA上でRNAに書き写される領域の一番上流にあり、遺伝子を発現させる機能を持つ部分。プロモーター配列ともいう。 - 9.バイオインフォマティクス解析
生命科学と情報科学を融合させて、DNAやRNA、タンパク質をはじめとする生命が持つさまざまな「情報」を対象に、情報科学や統計学などのアルゴリズムを用いた方法論やソフトウェアを駆使して、生命現象を解き明かしていく解析のこと。in silico 解析ともいう。 - 10.クロマチン免疫沈降 (ChIP)-PCR解析
クロマチン免疫沈降 (ChIP: Chromatin ImmunoPrecipitation) は、ヒストン、ヒストン修飾、転写因子、コファクターなどに選択的に結合する抗体を用い、特定のDNA結合タンパク質とそれに結合するDNA断片を選択的に濃縮する。ChIP-PCRは、ChIPの下流の解析の一つで、PCRを用いて免疫濃縮されたDNA断片の特定と定量を行う。 - 11.セロトニン神経細胞
セロトニンは別名5-ヒドロキシトリプタミンで、必須アミノ酸トリプトファンから生合成される脳内の神経伝達物質の一つで、ノルアドレナリン、ドーパミンと並び、動植物に広く分布する生理活性モノアミンの一種である。名称はserumとtoneに由来し、血管の緊張を調節する物質として発見・名付けられた。セロトニン神経細胞は、セロトニンを含有し、伝達物質として用いる神経細胞群。セロトニン神経の細胞体はそのほとんどが脳幹の縫線核にあるが、神経線維は中枢神経系全体に分布している。そのため、セロトニン神経系によって調節される中枢機能は、摂食行動や性行動などの本能行動から情動、認知機能まで多岐にわたる。 - 12.エピゲノム
DNAの塩基配列をゲノムと呼ぶことに対して、そのゲノムに加えられた修飾をエピゲノムと呼ぶ。主にDNAのメチル化やヒドロキシメチル化、ヒストンタンパク質の修飾(メチル化、アセチル化、リン酸化など)が知られている。エピゲノム状態は、遺伝子の発現制御に関わる。
国際共同研究グループ
理化学研究所
脳神経科学研究センター 分子精神遺伝研究チーム(研究当時)
チームリーダー 吉川 武男(よしかわ たけお)
副チームリーダー 大西 哲生(おおにし てつお)
研究員 シャビーシュ・バラン(Shabeesh Balan)
研究員 前川 素子(まえかわ もとこ)
研究員 豊島 学(とよしま まなぶ)
客員研究員 豊田 倫子(とよた ともこ)
テクニカルスタッフⅠ 岩山 佳美(いわやま よしみ)
テクニカルスタッフⅠ 久野泰子(ひさの やすこ)
テクニカルスタッフⅠ 大羽 尚子(おおば ひさこ)
テクニカルスタッフⅡ 渡辺 明子(わたなべ あきこ)
開拓研究本部 眞貝細胞記憶研究室
主任研究員 眞貝 洋一(しんかい よういち)
研究員 白井 温子(しらい あつこ)
研究員 山田 亜夕美(やまだ あゆみ)
特別技術員(研究当時) 福田 幹子(ふくだ みきこ)
テクニカルスタッフⅠ 事柴 芳(ことしば かおる)
生命機能科学研究センター 構造バイオインフォマティクス研究チーム
チームリーダー カイ・ザン(Kam Zhang)
客員研究員 デリープ・カラリカル・ヴィジャヤン(Dileep Kalarickal Vijayan)
浜松医科大学 医学部 精神医学講座
准教授 桑原 斉(くわばら ひとし)
帝京大学 医学部 精神神経科学講座
教授 栃木 衛(とちぎ まもる)
東京大学大学院 教育学研究科
教授 佐々木 司(ささき つかさ)
弘前大学大学院医学系研究科 神経精神医学講座
教授 中村 和彦(なかむら かずひこ)
中京大学 現代社会学部
教授 辻井 正次(つじい まさつぐ)
福井大学 子どものこころの発達研究センター 脳機能発達研究部門
教授 松﨑 秀夫(まつざき ひでお)
NTT東日本 関東病院 精神神経科
部長 音羽 健司(おとわ たけし)
フェノバンス・リサーチ・アンド・テクノロジー合同会社
代表 遠藤 俊裕(えんどう としひろ)
シュトゥットガルト大学 生化学・生物工学研究所
教授 アルバート・イェルチ(Albert Jeltsch)
研究員 サラ・ヴェイリッヒ(Sara Weirich)
研究員 マレン・シューマッハ(Maren Schuhmacher)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「Autism Spectrum Disorders (ASD) associated rare loss of function genetic variant in SUV39H2; a putative role of H3K9 methylation dynamics in ASD pathogenesis(研究代表者:Shabeesh Balan)」、同新学術領域研究(研究領域提案型)「マルチスケール精神病態の構成的理解(領域代表者:林朗子、分担:吉川武男)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)『エピゲノム研究に基づく診断・治療へ向けた新技術の創出』研究開発領域(研究開発総括:山本雅之)における研究開発課題「ヒストンリジンメチル化制御系に基づく脳機能の理解と治療戦略への展開(研究開発代表者:眞貝洋一、分担:吉川武男)」による支援を受けて行われました。
原論文情報
- Shabeesh Balan, Yoshimi Iwayama, Tetsuo Ohnishi, Mikiko Fukuda, Atsuko Shira4, Ayumi Yamada, Sara Weirich, Maren Kirstin Schuhmacher, Dileep Kalarickal Vijayan, Toshihiro Endo, Yasuko Hisano, Kaoru Kotoshiba, Tomoko Toyota, Takeshi Otowa, Hitoshi Kuwabara, Mamoru Tochigi, Akiko Watanabe, Hisako Ohba, Motoko Maekawa, Manabu Toyoshima, Tsukasa Sasaki, Kazuhiko Nakamura, Masatsugu Tsujii, Hideo Matsuzaki, Kam Y. J. Zhang, Albert Jeltsch, Yoichi Shinkai, Takeo Yoshikawa, "A loss-of-function variant in SUV39H2 identified in autism-spectrum disorder causes altered H3K9 trimethylation and dysregulation of protocadherin β-cluster genes in the developing brain", Molecular Psychiatry, 10.1038/s41380-021-01199-7
発表者
理化学研究所
脳神経科学研究センター 分子精神遺伝研究チーム(研究当時)
チームリーダー 吉川 武男(よしかわ たけお)
研究員 シャビーシュ・バラン(Shabeesh Balan)
開拓研究本部 眞貝細胞記憶研究室
主任研究員 眞貝 洋一(しんかい よういち)
 吉川 武男
吉川 武男
 シャビーシュ・バラン
シャビーシュ・バラン
 眞貝 洋一
眞貝 洋一
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
AMED事業について
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
Email: kenkyuk-ask [at] amed.go.jp
※[at]は@に置き換えてください。
