理化学研究所(理研)開拓研究本部伊藤ナノ医工学研究室の宮武秀行専任研究員(埼玉大学連携准教授)、伊藤嘉浩主任研究員、岡山大学大学院医歯薬学総合研究科(医)病理学(免疫病理)の松川昭博教授らの共同研究グループは、がん細胞中で異常に働くプロテインキナーゼ(タンパク質リン酸化酵素)[1]をピンポイントで阻害し、がん細胞の増殖を阻害する化合物を発見しました。
本研究成果は、より副作用の少ない、より効果的な新しい抗がん剤の開発につながるものと期待できます。
多くのがん細胞では、プロテインキナーゼの一種である「mTORC1[2]」が異常に活性化されているため、その阻害剤は抗がん剤として有望であると期待されてきました。ところが、従来のATP競合結合型阻害剤[3]では、mTORC1以外のプロテインキナーゼにも作用するため、思わぬ副作用や薬剤耐性が問題になっています。
今回、共同研究グループは、コンピュータを用いたドッキングシミュレーション[4]と細胞内相互作用アッセイ[5]を組み合わせた化合物スクリーニング法により、約70万種類の化合物の中からmTORC1の活性を抑える化合物「WRX606」を同定しました。WRX606の効果を調べたところ、がん細胞にだけ選択的に作用し、正常細胞には影響を与えないこと、ラパマイシン[6]よりも優れたがん抑制効果を示し、がん細胞の転移も軽微であることが明らかになりました。
本研究は、科学雑誌『Journal of Medicinal Chemistry』(2022年1月号)の掲載に先立ち、オンライン版(6月30日付)に掲載されました。
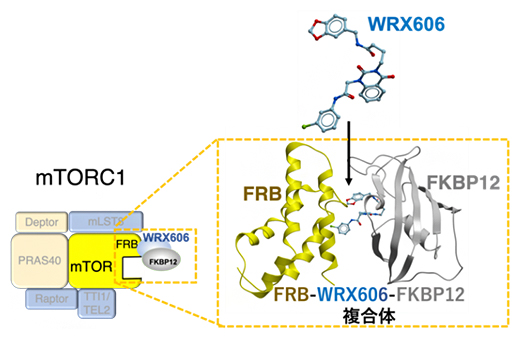
WRX606はFKBP12と結合後、mTORのFRB部位に結合し、mTORC1活性だけを精密に阻害する
背景
1980年代から継続して、がんは日本人の死因の第一位です。急速に進む超高齢化社会を迎え、がんによる死者数は増え続けており、2019年には37万6392人に達しています注1)。がんの克服は日本だけでなく、世界共通の課題といえます。がん治療では、手術のほかでは抗がん剤の使用が主な方法の一つですが、副作用や薬剤耐性が深刻な問題となっています。そのため、より副作用の少ない、優れた抗がん剤の開発が常に求められています。
がん細胞では、プロティンキナーゼ(タンパク質リン酸化酵素)の働きが過剰なために、異常に細胞増殖する場合が多く見られます。そのため、プロテインキナーゼの作用を抑えるいくつかの化合物が抗がん剤として使用されています。ただし、ヒトに存在する500種類以上のプロテインキナーゼは、抗がん剤と作用する部分の構造が類似しているために、特定のプロテインキナーゼだけに作用する抗がん剤の開発は困難でした。
そこで共同研究グループは、がん細胞中で過剰に働くプロテインキナーゼの一種である「mTORC1」だけに作用する化合物の探索を試みました。
研究手法と成果
共同研究グループは、コンピュータを用いたドッキングシミュレーションと、細胞内相互作用アッセイを組み合わせた化合物スクリーニング法(in silico/in cell複合選択法)を用いて、次の手順により、約70万種類の化合物の中から目的化合物を選び出しました(図1)。
まず、mTORC1のFRBドメイン[7]、ラパマイシン、およびFKBP12[8]の3者複合体結晶構造(PDB ID: 1FAP)をコンピュータ内に再現しました。次に、バーチャルリガンドライブラリー[9]のZINC15[10]から、分子量500前後の化合物を約70万種類選び出し、ラパマイシン結合部位を標的として、ドッキングシミュレーションを行いました(図1A)。その結果、高いドッキングスコアを持つ、3種類の化合物(WRX513、WRX939、WRX606)が選び出されました。そして、ヒト細胞(HEK293)を用いて、これらの化合物が実際にFRBとFKBP12に結合するかを調べたところ、「WRX606」だけが細胞内でFRB-WRX606-FKBP12の3者複合体を形成することが分かりました(図1B)。
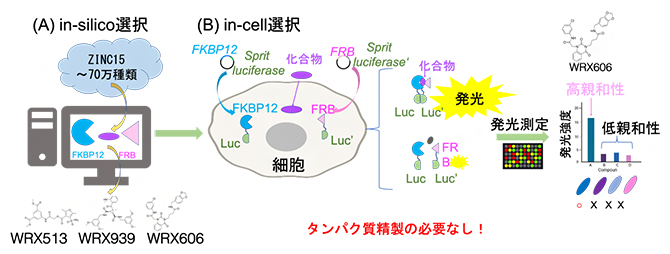
図1 in-silico/in-cell複合選択法の概要
- (A)in-silico選択。ZINC15から選んだ約70万種類のバーチャルリガンドをFRBとFKBP12にドッキング。3種類のハイスコア化合物を選び出した。
- (B)in-cell選択。分割ルシフェラーゼ遺伝子と、FRBおよびFKBP12遺伝子をそれぞれ融合させ、プラスミドに構築した。プラスミドを細胞に導入し、化合物を加えて発光により相互作用を測定した。
そこで、WRX606が細胞内でmTORC1のキナーゼ活性を抑えるかを調べたところ、WRX606は、mTORC1の基質(リン酸化されるタンパク質)であるS6K1と4E-BP1の両方のリン酸化を阻害することが分かりました。一方、同様の結合様式を持つラパマイシンは、S6K1のリン酸化だけを阻害し、4E-BP1は阻害しませんでした(図2)。S6K1と4E-BP1はどちらも細胞増殖に関わるタンパク質であるため、その両方を阻害するWRX606の方がラパマイシンよりも抗がん効果が高いことが示唆されました。
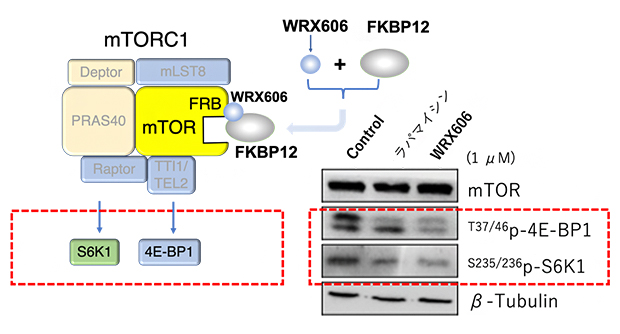
図2 WRX606のmTORC1阻害効果
WRX606は、mTORC1の基質であるS6K1および4E-BP1の両方のリン酸化を阻害した。一方、ラパマイシンはS6K1だけを阻害した。
さらに、WRX606のがん細胞への効果を調べました。すると、WRX606はがん細胞(HeLa子宮頸がん細胞)に選択的に作用し、正常細胞(NRK-49F細胞)にはほとんど影響を与えないことが分かりました(図3)。これは、WRX606がmTORC1だけに選択的に作用し、他のプロテインキナーゼには結合しない、つまりピンポイントに作用する精密な分子標的薬であることを示唆しています。
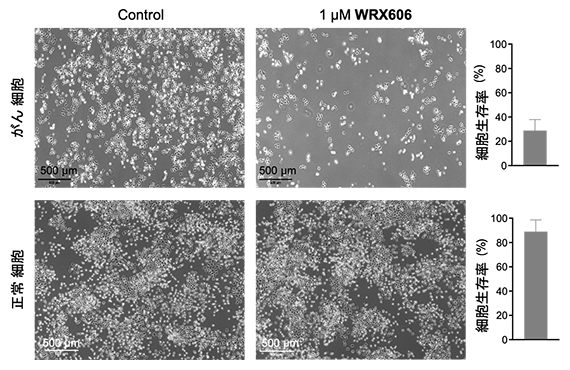
図3 WRX606のがん細胞と正常細胞に対する効果
WRX606は、がん細胞を殺傷する(上段)一方、正常細胞にはほとんど影響を与えなかった(下段)。
次に、マウスの表皮に乳がん細胞を移植し、そのサイズを測定することで抗がん効果を評価しました。また、肺に転移したがんコロニー数により、抗がん剤によって促進されるがん転移についても評価しました(図4)。その結果、WRX606はラパマイシンよりも優れたがん抑制効果を示し、がん細胞の転移も少ないことが分かりました。一方、抗がん効果のほかに免疫抑制効果によるがん細胞転移の副作用が知られているラパマイシンは、今回の実験でもがん細胞の肺転移が多数観察されました(図4)。
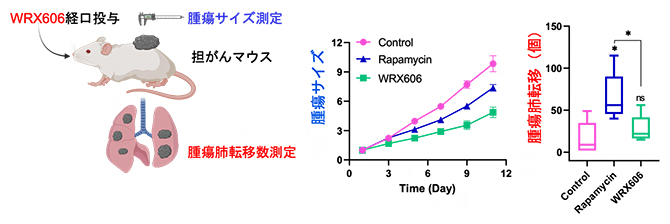
図4 担がんマウスによるWRX606の抗がん効果
WRX606とラパマイシンの抗がん効果を、乳がん細胞を移植したマウスで確認した。その結果、WRX606はラパマイシンよりも高い抗がん効果を示し、肺への転移も少なかった。
今後の期待
これまで、mTORC1は抗がん剤開発のターゲットではあったものの、ATP競合結合型阻害剤ではピンポイントにキナーゼ活性を阻害することは困難でした。オプジーボなどのモノクローナル抗体による抗がん剤[11]は、ピンポイントの阻害効果が得られますが、製造に高いコストがかかる、アレルギー反応が生じやすく経口投与できないなどの欠点があります。今回発見したWRX606は低分子化合物であるため、有機合成することで安価に製造でき、経口投与も可能です。
また、ラパマイシンとその誘導体は、mTORC1以外のプロテインキナーゼに結合しないものの、免疫抑制効果を併せ持つため、がん細胞の転移を誘発しやすく、抗がん剤としての薬効は限定的でした。今回初めて、免疫抑制効果を持たない、mTORC1だけに作用する精密分子標的薬候補が発見されたことは、今後の効果的な新しい抗がん剤の開発につながるものと期待できます。
補足説明
- 1.プロテインキナーゼ(タンパク質リン酸化酵素)
ATPを利用して、タンパク質のセリン残基とスレオニン残基の両方、またはその一方をリン酸化するセリン/スレオニンキナーゼ(STK)と、チロシン残基をリン酸化するチロシンキナーゼ(TK)に大別される。ヒトには500種類以上存在し、シグナル伝達を担っている。がん細胞ではプロテインキナーゼの働きが異常な場合が多く、それを阻害することは細胞増殖の抑制につながるため、抗がん剤のターゲットになっている。 - 2.mTORC1
セリン/スレオニンキナーゼであるmTORと、複数のタンパク質が結合した巨大なキナーゼ。細胞外から入力されるさまざまなシグナルに応じて、細胞増殖やオートファジーなどを制御している。mTORC1はMammalian/mechanistic Target of Rapamycin (mTOR) Complex1の略。 - 3.ATP競合結合型阻害剤
ATPと類似構造を持ち、キナーゼのATP結合部位に先回りして結合することにより、ATPの結合を阻害する。ATP結合部位だけに結合する(Type-I:ゲフィチニブ、エルロチニブなどの医薬品)とATP結合部位およびその近傍に結合する(Type-II:イマチニブ、ニロチニブなどの医薬品)に分類される。キナーゼのATP結合部位の構造は、異なるキナーゼ間でも類似しているため、目的キナーゼ以外のキナーゼにも結合(オフターゲット)しやすいことが問題である。 - 4.ドッキングシミュレーション
コンピュータでタンパク質と化合物などの結合を再現し、ドッキングスコアや結合エネルギーなどの指標により、結合の良し悪しを判定する方法。一般に、これらの指標が良好なほど、より良い化合物であることを示唆するが、シミュレーションでは生体内部で起こる本来の結合を完全には再現しきれないため、間違った判定が得られてしまう場合も多い。 - 5.細胞内相互作用アッセイ
細胞内部でタンパク質や化合物の結合を再現する方法。発光タンパク質を付加した目的タンパク質遺伝子を細胞に導入すると、目的タンパク質が細胞内部で合成され、タンパク質や化合物が相互作用する際に発光する。この強度により、相互作用の強さを測定する。 - 6.ラパマイシン
放線菌の産生する環状構造を持つ化合物。FKBP12と複合体を形成し、mTORのFRB部位に結合してATP活性を阻害する。一方で、免疫関連分子とも結合するため、免疫抑制効果も発揮する。 - 7.FRBドメイン
mTORのATP結合部位付近に存在する、FKBP12-ラパマイシン複合体が結合する領域。FRBはmTORの基質が結合する部分であるため、FKBP12-ラパマイシンの結合により、間接的にキナーゼ活性を阻害(アロステリック阻害)する。 - 8.FKBP12
12-kDa FK506結合タンパク質。FKBP12は広く保存された細胞内タンパク質で、プロリンイソメラーゼ活性を持ち、FK506(タクロリムス)と複合体を形成し、さらに脱リン酸化酵素のカルシニューリンと複合体を形成し機能を阻害する。これにより、免疫抑制効果が発揮される。 - 9.バーチャルリガンドライブラリー
一般に非常に多数の化合物情報が登録されており、そこから必要に応じて化合物を選び出して、より小さなライブラリーを構築し、ドッキングシミュレーションによるバーチャルリガンドスクリーニングを行う。 - 10.ZINC15
カリフォルニア大学サンフランシスコ校(UCSF)のIrwinとShoichetらにより整備されている、無償のバーチャルリガンドライブラリー(ZINC15)。最新バージョンはZINC20で、2021年現在、10億種ほどのバーチャルリガンドが登録されている。 - 11.モノクローナル抗体による抗がん剤
目的タンパク質に結合するヒト化されたIgG抗体が主に用いられ、近年、活発に開発が進められている。オプジーボやハーセプチンなどの抗がん剤も、モノクローナル抗体薬である。ピンポイントの結合により、高い効果や低い副作用が期待できる。一方で、生産には高額なコストがかかり、点滴による投与が必要であり、アレルギー反応が生じやすいなどの課題もある。
共同研究グループ
理化学研究所 開拓研究本部 伊藤ナノ医工学研究室
専任研究員 宮武 秀行(みやたけ ひでゆき)
(埼玉大学 連携准教授)
主任研究員 伊藤 嘉浩(いとう よしひろ)
埼玉大学大学院
大学院生 ラエフ・シャムス(Raef Shams)
岡山大学大学院 医歯薬学総合研究科(医) 病理学(免疫病理)
教授 松川 昭博(まつかわ あきひろ)
非常勤研究員 越智 由香利(おち ゆかり)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「免疫チェックポイントを阻害する、人工抗体分子の迅速設計と調製(研究代表者:宮武 秀行)」による助成を受けて行われました。
原論文情報
- Raef Shams, Akihiro Matsukawa, Yukari Ochi, Yoshihiro Ito, and Hideyuki Miyatake*, "In Silico and In Cell Hybrid Selection of Nonrapalog Ligands to Allosterically Inhibit the Kinase Activity of mTORC1", Journal of Medicinal Chemistry, 10.1021/acs.jmedchem.1c00536
発表者
理化学研究所
開拓研究本部 伊藤ナノ医工学研究室
専任研究員 宮武 秀行(みやたけ ひでゆき)
(埼玉大学 連携准教授)
主任研究員 伊藤 嘉浩(いとう よしひろ)
岡山大学 大学院医歯薬学総合研究科(医) 病理学(免疫病理)教室
教授 松川 昭博(まつかわ あきひろ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
岡山大学 総務・企画部広報課
Tel: 086-251-7292 / Fax: 086-251-7294
Email: www-adm [at] adm.okayama-u.ac.jp
埼玉大学 広報渉外室
Tel: 048-858-3932 / Fax: 048-858-9057
Email: koho [at] gr.saitama-u.ac.jp
※上記の[at]は@に置き換えてください。
