理化学研究所(理研)脳神経科学研究センターシナプス可塑性・回路制御研究チームのピーター・チップマン研究員(研究当時)、合田裕紀子チームリーダーらの国際共同研究グループは、脳内のアストロサイト[1]に発現するグルタミン酸受容体の一つであるGluN2C-NMDA受容体[2]が、海馬[3]の神経細胞間の情報の伝わりやすさを調整することを発見しました。
本研究結果は、記憶に重要な海馬の神経回路基盤に関わるアストロサイトの機構に新たな知見を与えるとともに、NMDA受容体を標的としたうつ病や認知症治療薬の作用機序の理解につながると期待できます。
グリア細胞[1]の一種であるアストロサイトは、神経細胞の形態と機能を支えるだけではなく、神経細胞の活動を主導的に制御する役割を果たすことが近年注目されつつあります。しかし、その分子的なメカニズムはよく分かっていません。
今回、国際共同研究グループは、GluN2C-NMDA受容体が海馬アストロサイトに多く発現し、神経細胞同士の接点であるシナプス[4]を介した情報の伝わりやすさの幅を広げていることを見いだしました。数理モデルを使ったシミュレーションにより、シナプス強度[5]分布幅の広がりがシナプス可塑性[6]を起こしやすくしていることが示されました。
本研究は、科学雑誌『eLife』オンライン版(11月16日付)に掲載されました。
背景
脳内では、神経細胞同士を結ぶ「シナプス」という部分を介して情報が伝達されます。一つの神経細胞には数千から数万個のシナプスがあり、さらには1千億個にも及ぶ脳内の神経細胞がシナプスにより特徴的なパターンでつながることで膨大な神経回路を形成しています。
シナプスでは、情報を送る側の神経細胞のシナプス前終末から神経伝達物質[7](興奮性シナプスでは主にグルタミン酸)が放出され、それが次の神経細胞のシナプス後部にある受容体に結合することで情報が伝わります。神経活動による情報伝達には揺らぎがあり、個々のシナプスでは「シナプス強度(シナプス伝達効率)」という情報の伝わりやすさが異なります。また同じシナプスでも、神経活動の頻度によりシナプス強度は変化します。このようなシナプス強度変化は「シナプス可塑性」と呼ばれ、学習や記憶に重要なメカニズムとして活発な研究が進められてきました。
情報伝達に必須な神経細胞は脳科学の中心的な要素ですが、脳内では神経細胞とほぼ同数のグリア細胞が存在します。グリア細胞の一種である「アストロサイト」は、脳内環境を整えて神経回路機能を支える役割を担うと考えられていましたが、最近、神経細胞の活動を主導的に制御することが分かってきました。ただし、そのメカニズムの多くは未解明です。
合田裕紀子チームリーダーらはアストロサイトによるシナプス制御メカニズムに着目し、2016年にアストロサイトが異なるシナプス間の相互作用を制御することを見いだしました注1)。しかし、その制御の作動様式、およびシナプス制御への関わりが示されたアストロサイトに発現するNMDA受容体の実体はよく分かっていませんでした。
- 注1)2016年4月26日プレスリリース「シナプス強度の調節機構を発見」
研究手法と成果
国際共同研究グループはまず、マウス脳から海馬急性切片を作製し、電気生理学的手法[8]を用いて、stratum radiatum層(SR)からCA1領域[3]の神経細胞へ入力するシナプス強度、特に神経伝達物質放出によるシナプス前終末強度の揺らぎ(分布幅)を測定しました(図1左、中央列、赤破線で囲まれた部分)。
アストロサイトとシナプス前終末側の神経細胞に局在するNMDA受容体を区別化しない状態で、NMDA受容体拮抗薬[9]の効果を観察したところ、基底状態と比べてシナプス強度の分布幅が狭まることを確認しました(図1B)。また、NMDA受容体に必須なサブユニットであるGrin1遺伝子の組換えにより、アストロサイト特異的にNMDA受容体の発現を阻害したマウスの海馬を、野生型コントロールマウスの海馬と比較しました(図1A)。すると、シナプス強度分布幅は基底状態で既に狭く、NMDA受容体拮抗薬を投与してもさらなる分布幅の減少は見られませんでした(図1C)。これにより、アストロサイトに由来するNMDA受容体がシナプス強度の分布幅を広げていることが分かりました。
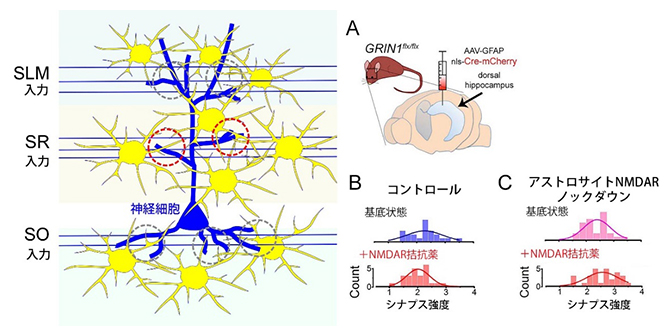
図1 海馬CA1領域の神経細胞へ入力するシナプス強度分布へのNMDA受容体の役割
- 左:海馬CA1領域の神経細胞(青)は三つの異なる層(SLM: stratum lacunosum moleculare; SR: stratum radiatum; SO: stratum oriens)において、それぞれの神経細胞群からシナプスの入力を受ける。アストロサイト(黄)はタイルのように海馬全体に散らばってネットワークを形成し、個々のアストロサイトの細い突起はシナプスへ密接にコンタクトする。本研究ではアストロサイトによるシナプス強度への影響を探った。
- 右:(A)アデノ随伴ウイルスベクターを使い、Grin1遺伝子改変マウスの海馬へアストロサイト特異的にGrin1遺伝子発現を阻害する酵素を導入して、アストロサイトのNMDA受容体の発現をノックダウンした。コントロール(野生型)マウス(B)とアストロサイトNMDA受容体ノックダウンマウス(C)から得た海馬切片を使い、基底状態(上)とNMDA受容体拮抗薬を投与後(下)のSR層でのシナプス強度分布を比較した。コントロールマウスの切片ではNMDA受容体拮抗薬によりシナプス強度分布幅が狭くなったが、アストロサイト特異的にNMDA受容体の発現を阻止すると、NMDA受容体拮抗薬によるシナプス強度分布幅の減少は見られなかった。
次に、数理モデルを使ったシミュレーションにより、シナプス強度分布幅、特に神経伝達物質が放出される効率の揺らぎの意義を検討しました。その結果、シナプス強度分布幅はシナプス可塑性の起きやすさを左右することが分かりました。シナプス強度の平均値は同じでも、その幅が拡大されると、長期的に維持されるシナプス可塑性(長期シナプス可塑性)がより容易に起きました。長期シナプス可塑性は、学習や記憶の細胞基盤とされています。従って、アストロサイトによるシナプス強度分布幅の調整が海馬の学習や記憶メカニズムに関与している可能性があります。
また、アストロサイトNMDA受容体の実体を突き止めるためにRNA解析を行いました。ガラス電極を使って個々のアストロサイトと神経細胞からRNAを採取し、NMDA受容体サブユニットを解析したところ、神経細胞ではGluN1、GluN2A、GluN2BのRNA発現量が多く、アストロサイトではGluN2CサブユニットのRNA発現量が多いことが判明しました。さらに、GluN2Cを発現する細胞だけに赤色蛍光プローブ(tdTomato)を合成するマウスを作製し、GluN2Cの発現分布を観察した結果、GluN2Cは主にアストロサイトに発現することが分かりました(図2)。
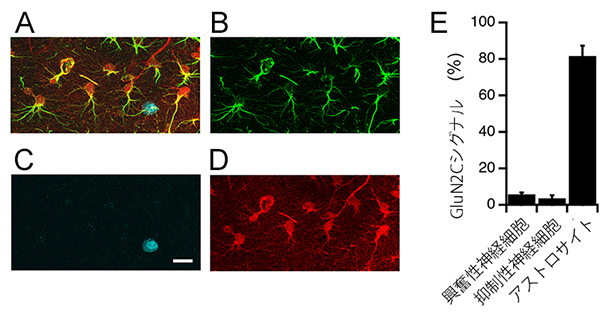
図2 GluN2C-NMDA受容体は主にアストロサイトに発現
- A-D:GluN2C NMDA受容体サブユニットが海馬アストロサイトに局在するかを調べた実験。GluN2Cを発現する細胞特異的に赤色蛍光プローブ(tdTomato)が合成されるマウスを作製して、そのマウスから得た海馬切片を使い、アストロサイトマーカーであるGFAP(B、緑)、神経細胞の核マーカーであるNeuN(B、青)、GluN2Cの標識であるtdTomato(D、赤)と三重に免疫染色した(A: B-Dを重ねた画像)。(スケールバー:25μm)
- E:各細胞タイプでGluN2Cに由来するtdTomatoラベルを持つ細胞数の率:pyramidal層の神経細胞(興奮性神経細胞)、SR層の神経細胞(抑制性神経細胞)、アストロサイト。GluN2Cは主にアストロサイトに発現することが分かった。
最後に、アストロサイトGluN2C-NMDA受容体によるシナプス強度分布幅の制御を電気生理学的手法で調べました。GluN2C/D-NMDA受容体へ特異的な拮抗薬を投与してその効果を観察したところ、基底状態と比べてGluN2C/D-NMDA受容体を阻害した状態ではシナプス強度分布幅が減少しました。海馬におけるGluN2Dサブユニットの発現は見られなかったため、この実験結果はアストロサイトのGluN2C-NMDA受容体がシナプス強度分布幅を調整していることを示しています。また、海馬ではSLM層、SR層、SO層(図1左)それぞれのアストロサイトでGluN2Cが発現されるものの、シナプス強度分布幅の制御はSR層のアストロサイトに特異的であることも見いだしました。
今後の期待
本研究では、新たにアストロサイトGluN2Cがシナプスの制御に関わることを発見しました。特に、GluN2C-NMDA受容体はシナプス前終末強度の分布幅を拡大する役割を果たし、その広い分布幅はシナプス可塑性を起こしやすくしています。今後、海馬の学習や記憶にはどのようにSR層のアストロサイトが関与するか新たな知見が得られる可能性があります。
うつ病や認知症の治療薬には、ケタミンやメマンチンなどNMDA受容体を標的とする拮抗薬があります。試験管内での実験では、ケタミンとメマンチンはNMDA受容体の中でもGluN2C-NMDA受容体により効果的であることが示唆されています。従って、今後は神経伝達異常を伴う脳神経疾患の病因や治療法へもアストロサイトが大きく関わることが見込まれます。
補足説明
- 1.アストロサイト、グリア細胞
神経系を構築する細胞のうち、神経細胞ではない細胞をグリア細胞という。アストロサイトはグリア細胞の一種で、多数の突起を持ち、星状に見えることから名付けられた。その表面積は広く、マウスやラットでは約9万個、ヒトでは200万個以上のシナプスを覆っていると考えられている。 - 2.NMDA受容体
神経伝達物質の一つであるグルタミン酸に結合する受容体の一つ。細胞膜表面での受容体機能に必須なGluN1サブユニットのほか、GluN2A、GluN2B、GluN2C、GluN2D、GluN3A、GluN3Bサブユニットが存在し、四つのサブユニットから構成される複合体。 - 3.海馬、CA1領域
海馬は脳の側頭葉にある記憶や空間認知などに関わる領域。CA1領域は海馬の中の一つの部位。 - 4.シナプス
神経細胞の軸索の末端と、次の神経細胞の樹状突起の間の小さな間隙。その多くは化学シナプスと呼ばれ、神経伝達物質という化学物質がシナプス前終末から放出されて、シナプス後部にある受容体に結合することで情報が伝達される。化学シナプスのほかに電気的につながっている電気シナプスもある。 - 5.シナプス強度
シナプスにおける情報伝達の効率。神経伝達物質の放出量や受容体の量などによって、情報伝達の効率が変化する。 - 6.シナプス可塑性
シナプスにおける情報伝達率。化学シナプスの場合は、シナプスにおける神経伝達物質の放出量や受容体の量などによって、情報伝達率が変化する。 - 7.神経伝達物質
シナプス前終末から放出される化学物質(グルタミン酸やアセチルコリンなど)。シナプス後部の受容体に結合することで、シナプスを介した情報伝達を担う。 - 8.電気生理学的手法
神経細胞の持つ電気的な特徴を計測する方法。 - 9.拮抗薬
細胞内の受容体に結合して、内在性物質が受容体へ作用する機能を阻害する薬物。
国際共同研究グループ
理化学研究所 脳神経科学研究センター シナプス可塑性・回路制御チーム
研究員(研究当時) ピーター・チップマン(Peter Chipman)
研究員(研究当時) アレハンドラ・パゾ・フェルナンデス (Alejandra Pazo Fernandez)
研究員(研究当時) アンジェロ・テドロディ(Angelo Tedoldi)
研究員(研究当時) スニタ・ギミレ・ガウタム(Sunita Ghimire Gautam)
テクニカルスタッフⅠ 黒澤 みず樹(くろさわ みずき)
チームリーダー 合田 裕紀子(ごうだ ゆきこ)
インド科学教育研究院プネ
大学院生(研究当時) アビラッシュ・サワント(Abhilash Sawant)
東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
大学院生(研究当時) 河井 敦(かわい あつし)
沖縄科学技術大学院大学 神経情報・脳計算ユニット
ユニットリーダー 深井 朋樹(ふかい ともき)
研究員 チーチュン・アラン・ファン(Chi Chung Alan Fung)
新潟大学 脳研究所 モデル動物開発分野
フェロー 崎村 建司(さきむら けんじ)
准教授 阿部 学(あべ まなぶ)
研究支援
本研究は、日本学術振興会(JSPS)外国人特別研究員(ピーター・チップマン)、同科学研究費補助金(15H04280, 合田裕紀子;18H05213, 深井朋樹;19K16885, チーチュン・アラン・ファン)、上原記念生命科学財団、日本医療研究開発機構(AMED)革新的技術による脳機能ネットワークの全容解明プロジェクトによる支援を受けて行われました。
原論文情報
- Peter Chipman, Chi Chung Alan Fung, Alejandra Pazo Fernandez, Abhilash Sawant, Angelo Tedoldi, Atsushi Kawai, Sunita Ghimire Gautam, Mizuki Kurosawa, Manabu Abe, Kenji Sakimura, Tomoki Fukai and Yukiko Goda, "Astrocyte GluN2C NMDA receptors control basal synaptic strengths of hippocampal CA1 pyramidal neurons in the stratum radiatum", eLife, 10.7554/eLife.70818
発表者
理化学研究所
脳神経科学研究センター シナプス可塑性・回路制御研究チーム
研究員(研究当時) ピーター・チップマン(Peter Chipman)
チームリーダー 合田 裕紀子(ごうだ ゆきこ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
